新型鹅细小病毒研究进展
卞国志,马海彬,罗梦萍,龚凤平,王贵平,廖 明,袁建丰
(1.华南农业大学兽医学院, 广州510642 ;2.广东海大畜牧兽医研究院有限公司, 广州 511400)
1956年我国首次报道发现小鹅瘟,并于1961年分离得到该病的病原体鹅细小病毒(Goose parvovirus,GPV)[1]。而番鸭细小病毒病最早于1980年在我国出现,1993年由程由铨等[2]首次分离到番鸭细小病毒(Muscovy duck parvovirus,MDPV)。GPV和MDPV引起的鸭细小病毒病呈全球流行,欧洲、东南亚、美洲等地区都有该病的报道[3-4]。经典GPV毒株可感染雏鹅和雏番鸭,MDPV只感染雏番鸭[4],但是两者都不感染樱桃谷鸭。
新型鹅细小病毒(Novel Goose Parvovirus,N-GPV)典型的临床症状为软脚、短嘴和生长障碍[5]。Villatte报道1971年该病症首次出现在法国西南部的半番鸭群中,另外1995年和2009年分别在波兰和匈牙利爆发[6]。国内最早于1989年台湾报道了1例由N-GPV和鸭肝炎病毒混合感染的病例[7]。N-GPV引起的细小病毒病在大陆最早出现在2008年,但是并未引起足够重视[8]。2015年福建部分地区的半番鸭爆发此流行病,随后陆续在山东省、河北省、河南省、安徽省和江西省的半番鸭和樱桃谷鸭中出现,该病发病率10%~30%,病死率一般低于3%,僵鸭淘汰率高达80%,造成养鸭业巨大经济损失[9]。
1 病原学特征
1.1 形态MDPV和GPV属于细小病毒科(parvoviridae)细小病毒亚科(parvovirinae)依赖病毒属(Dependovirus),为单股链状DNA病毒[10-12]。在电镜下MDPV和GPV病毒粒子分为实心和空心两种形态,直径为20~24 nm,无囊膜,正二十面体对称,衣壳由32个管桩排列的壳粒构成[13]。MDPV与GPV在病毒大小、形态、基因组结构等都很相似,发病症状也很相似[10]。
1.2 基因组MDPV、GPV和N-GPV的基因组序列差别不大,各分离株都在5.1 kb左右[14-16]。三者基因组都包括2个开放阅读框,左侧开放阅读框(left open reading frame,LORF)编码非结构蛋白,右侧开放阅读狂(right open reading frame,RORF)编码结构蛋白。非结构蛋白有2个,分别为NS1和NS2,肽链长度NS1>NS2,并且共用一个终止密码子。结构蛋白有3个,分别为VP1、VP2和VP3,肽链长度VP1>VP2>VP3,也具有同一个终止密码子。LORF和RORF间隔18 nt。
非结构蛋白(non-structural protein,NS)重要功能为参与病毒复制和转录的调节[17-18]。其中NS1参与病毒复制,并有结合ATP和抑制宿主细胞DNA复制等功能[19]。NS2对NS1的功能有促进作用,此外NS2蛋白还可能与病毒增值以及DNA合成相关[18]。
结构蛋白VP是病毒衣壳的组成成分,MDPV结构蛋白VP1、VP2、VP3大小分别为91、78、58 kDa。N-GPV和GPV结构蛋白VP1、VP2、VP3蛋白大小分别为87、70、60 kDa。MDPV、GPV和N-GPV的VP2蛋白是其主要免疫原性蛋白。与VP2蛋白相比,VP1、VP3蛋白的免疫原性较弱。
MDPV、GPV和N-GPV的基因组5'端均折叠形成发夹结构(图1),发夹结构呈“箭”形,两端存在着相同的末端重复序列(inverted terminal repeat,ITR),长度约为440 bp,发夹结构和ITR对病毒的复制起重要作用[20]。发夹结构有约180 nt的“茎”部和45 nt的“泡”区构成。“箭”头上有限制性内切酶SphI的酶切位点,是ITR的对称中心。ITR含有多个4~10 bp的重复序列,如TTCCGG及其衍生体重复了18次。在复制过程中ITR或发夹结构起到至关重要的作用。

图1 MDPV和GPV病毒基因序列图Fig.1 Genetic map of MDPV and GPV
1.3 核苷酸序列通过对2015年N-GPV爆发以来的7株分离株全基因组核苷酸序列比对分析发现,不同N-GPV的分离株全基因序列相似性为99.2%~99.7%。与2012年分离的经典GPV LH株全基因组核苷酸相似性为93.4%~95.2%。与2015年分离的MDPV P1株全基因组核苷酸相似性为81.3%~83.4%,见图2。
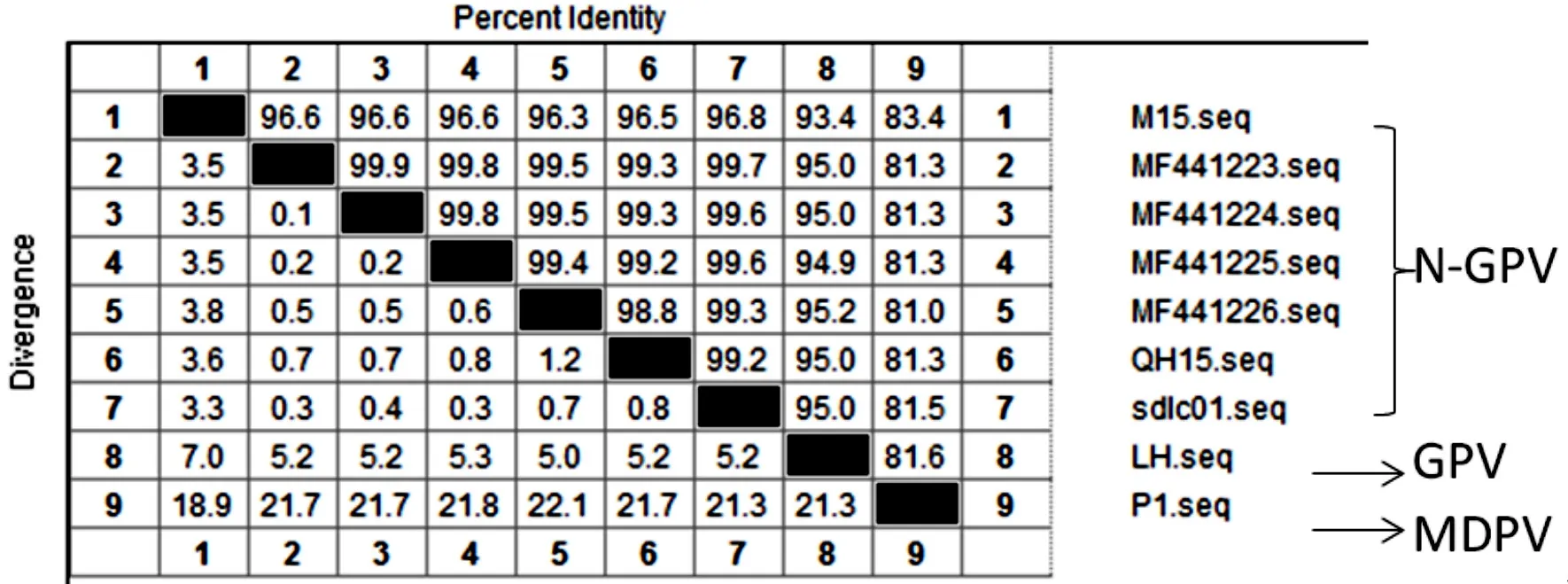
图2 全基因组核苷酸序列比对Fig.2 Genome nucleotide sequence comparison
通过对2015年N-GPV爆发以来的7株分离株非结构蛋白核苷酸序列比对分析发现,不同N-GPV的分离株非结构蛋白序列相似性为99.1%~99.9%。与2012年分离的经典GPV LH株非结构蛋白核苷酸相似性为96.2%~96.4 %。与2015年分离的MDPV P1株非结构蛋白核苷酸相似性为81.7% ~82.9%,见图3。

图3 非结构蛋白核苷酸序列比对Fig.3 Non-structural protein sequence comparisons
通过对2015年N-GPV爆发以来的6株分离株结构蛋白核苷酸序列比对分析发现,不同N-GPV的分离株结构蛋白序列相似性为99.6%~99.9%。与2012年分离的经典GPV LH株结构蛋白核苷酸相似性为94.7%~95.0 %。与2015年分离的MDPV P1株结构蛋白核苷酸相似性为80.4%~ 81.1%,见图4。
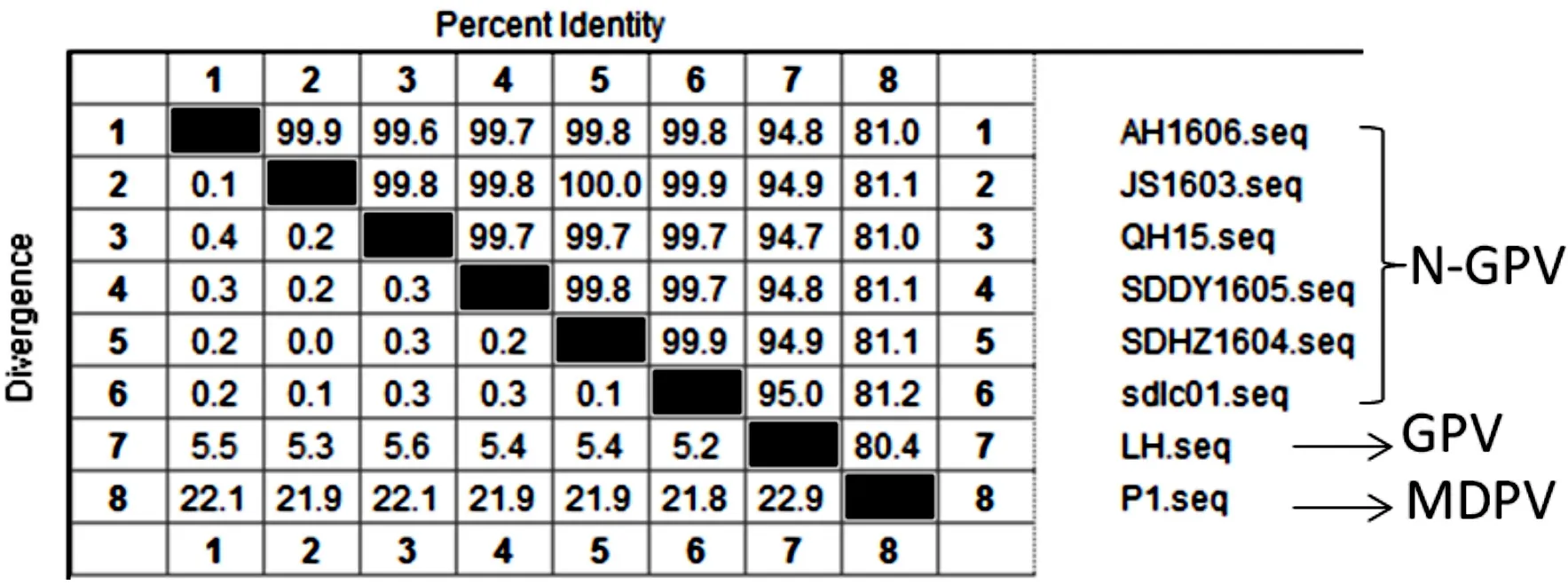
图4 结构蛋白核苷酸序列比对Fig.4 Structural protein sequence comparisons
1.4 N-GPV关键突变位点分析VP2蛋白是决定病毒结合位点和宿主特异性的关键因素[21]。其结构和氨基酸同源性分析证实N-GPV QH15株的VP2 3个不同表面位点(392、430和558位氨基酸)在GPV和MDPV中是有区别的。MDPV分别为I392、L430、N558或L392、K430、N558,GPV为L392、K430、D558,而N-GPV QH15株、GPV a2006株、GPV 1995株为I392、R430、N558,与MDPV和GPV都不同。暗示有可能是这些位点的变化导致GPV能在樱桃谷鸭、半番鸭体内复制并且致病[22]。
通过和其他GPV序列比对发现N-GPV SDLC01株的REP基因32位氨基酸由Asn替代了Ser,进而影响了磷酸酯酶A2(phospholipase A2,PLA2)的催化区域和活性,从而导致钙磷代谢的异常,导致骨发育异常,特别表现在喙、跖骨和翅骨。喙是由多个突出面组成,随着鸭的生长,这些突出面共同组成鸭喙。喙的额鼻处有2个增生区域,这些区域和骨形成蛋白4有关。可能是由于病毒感染导致骨形成蛋白4活性改变,导致鸭喙形状的改变[6]。
2 致病特征
2.1 临床症状N-GPV引起的病鸭临床症状为舌头肿胀、腹泻、胫骨变短,此外还有喙变短,舌头突出,生长障碍等[9](图5)。而典型的MDPV和GPV引起的鸭细小病毒病临床症状按照发病情况分为最急性、急性和亚急性。最急性:多发生于6日龄内番鸭,病程数小时,几乎不出现前期症状就死亡,临死前病鸭头颈朝一侧弯曲,两脚呈游泳状;急性型:多发生7~14日龄番鸭,病程2~4 d,前期症状为不同程度腹泻、呼吸困难、两脚无力、厌食;亚急性型:多发生14日龄以上的雏番鸭,病程5~7 d,症状与急性型相似,病死率较低[23]。比较发现N-GPV与典型细小病毒病的区别为喙变短,舌头突出,具有很好的区分度。

图5 N-GPV引起的病鸭典型症状Fig.5 Typical symptoms caused by N-GPV
2.2 剖检特点感染N-GPV后的病鸭舌头出现间质性炎症,舌部的结缔组织疏松、水肿;胸腺出血、水肿,并有坏死点;肾小管存在出血、水肿和炎性细胞浸润,肝脏轻微萎缩,胸腺肿胀和出血,其他器官无特征性病变[14]。而感染经典GPV和MDPV的番鸭细小病毒病特征性病理变化为渗出性肠炎和胰脏坏死,另外还包括肠粘膜充血出血,胰脏苍白,表面有灰白色坏死点,胆囊肿大,心肌束间有红细胞渗出,血管扩张,肝细胞局部有颗粒变性和脂肪变性,神经细胞轻度变性,胶质细胞轻度增生[1-2,24-25]。
与GPV和MDPV引起的症状相比,N-GPV的病理学变化更轻微,对组织的损伤相对较小。比较发现,3种毒株造成鸭群的发病率差异不显著,但病死率差别很大。
3 流行病学
N-GPV感染宿主为樱桃谷鸭和半番鸭,该病发病率10%~30%,病死率一般低于3%,僵鸭淘汰率高达80%[26]。GPV是小鹅瘟的病原,易感染4~20日龄的雏鹅和雏番鸭[1,27]。雏番鸭爆发典型GPV的发病率为50%~70%,病死率40%~65%。MDPV仅能感染番鸭并使之发病,并不能感染麻鸭、半番鸭、北京鸭、樱桃谷鸭、鹅等,三周龄内发病率40%~60%,死亡率20%~40%[4,28]。

表1 引起鸭细小病毒病的毒株比较Table 1 Comparison of virus strains that causing duck Parvovirus disease
通过表1可以看出,N-GPV不仅和经典GPV和MDPV在宿主方面有很大差别,并且发病率相对较低,死亡率更是远远低于GPV和MDPV引起的鸭细小病毒病。不过,这些毒株对鸭群的危害都集中在三周龄内的雏鸭。
4 培养特性
MDPV初代分离只能用番鸭胚,病毒适应鸭胚后,才可以在鹅胚中增值;GPV的分离培养能使用鹅胚和鸭胚,而N-GPV只能使用鸭胚分离,并不能在鹅胚中增值。GPV和MDPV接种鸭胚尿囊腔3~5 d后死亡,感染番鸭胚绒毛尿囊膜变厚,胚体充血,翅、头、趾等部位有出血点[29]。N-GPV毒性较弱,接种鸭胚后连续4代才会死亡,死亡鸭胚尿囊膜增厚和呈灰色[30]。
番鸭胚成纤维细胞(muscovy duck embryo fibroblast cell,MDEFC)和番鸭胚肾细胞(muscovy duck embryo kidney cell,MDEKC)可用来增值MDPV。MDPV适应细胞后,产生细胞病变和包涵体,形成蓝色小噬斑。鹅胚或鸭胚成纤维细胞感染GPV 3~5 d后,出现明显的细胞病变,表现为细胞变大、细变圆和脱落。连续DEF细胞传代N-GPV第4代才能发现明显的细胞病变,新型鸭源鹅细小病毒能在DEF中培养,而不能在鸡胚成纤维细胞中增值[16]。
5 免疫学实验
凝集实验(latex agglutination,LA)表明新型鸭源鹅细小病毒和GPV抗原反应阳性,与MDPV抗原反应阴性。凝集抑制实验(latex agglutination inhibition,LAI)表明患N-GPV病鸭对MDPV和GPV抗体都是血清反应阳性,不过GPV抗体滴度(25.0~29.6)明显高于MDPV抗体滴度(22.2~26.4)。N-GPV病毒回归实验发现雏鸭感染后7 d,部分对GPV抗体血清反应阳性,感染后14~42 d全部攻毒鸭对GPV抗体血清反应阳性[30-31]。
6 总结
目前,新型鹅细小病毒的感染范围已经扩散到了北京市、山东省、河南省、河北省、江苏省、浙江省、安徽省、湖北省、上海市、福建省、广东省和广西壮族自治区等12个省市区,而这些地区正是养鸭业的主产区。尽管N-GPV造成的死亡率不高,但耐过鸭由于生长障碍和畸形严重降低了其市场价值及经济效益,给养鸭业造成了巨大损失。
虽然我国2008年就出现了新型鹅细小病毒病,但2015年以前并未大区域爆发,分析可能原因是2015年该病毒发生了突变,导致其传播能力突然增强,但也不排除大规模养殖模式对该病毒传播的影响。目前典型的GPV疫苗仍可预防N-GPV的发生,但是该病毒仍在变异中,传统小鹅瘟疫苗和抗体可能面临失效的风险。
虽然该病自2015年爆发以来,国内科研工作者都在研究其病原体来源、致病性、与其他毒株的差异性,但是其致病机理及演化过程还不清楚,需要进一步研究。本研究旨在分析N-GPV的遗传变异和与经典GPV、MDPV的区别,为今后该病的研究及防控提供详尽的技术支撑。

