2016~2018年江苏省规模猪场PRRS血清学调查
蔡丙严,戴建华,田其真,郝福星,范红结
(1.南京农业大学,南京200241;2.江苏农牧科技职业学院,泰州225300)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的猪的一种高度传染性疾病,已在全世界范围内广泛传播,给养猪业生产带来严重的经济损失[1]。2006年4月,我国南方地区出现了以PRRSV变异株感染引起的PRRS大规模爆发,其发病率和死亡率高,迅速波及到全国大部分省份[2]。2014~2015年,我国华东和中原地区出现了与北美NADC30序列非常类似的PRRSV毒株,被命名为NADC30-Like毒株[3]。至今,PRRSV的毒株仍在变异,给该病的控制带来了挑战。市场上PRRS的疫苗种类较多,既有以ATCCVR-2332、CH-1R等为代表的经典毒株疫苗,也有以JXA1-R、TJM-F-92、GDr180等为代表的变异毒株疫苗,做好疫苗免疫工作是当前控制该病的有效手段之一[4],同时PRRSV容易变异,现有疫苗对变异毒株免疫效果不能提供完全的交叉保护[5]。因此,生产中对于疫苗的选择及是否要进行疫苗免疫存在诸多的困惑。本研究为了解江苏规模化猪场PRRS流行动态,对江苏省泰州、南通、常州等7个地区27家规模猪场送检的2062份未免疫PRRS血清样本进行了PRRSV抗体与核酸检测,并对结果进行统计分析。开展血清学调查,对江苏规模猪场PRRSV的感染状况进行深入了解,摸清当前PRRS的流行动态和规律,以期为规模猪场的PRRS防控提供参考。
1 材料和方法
1.1 样品与试剂样品为2016年1月~2018年12月,江苏省泰州、扬州、南通、盐城、宿迁、徐州、常州等7个地区的27家规模猪场,不同批次送检的未免疫PRRS疫苗血液样本,共计2062份。每批血液样品以3000×g离心10 min制备血清,集中检测。猪繁殖与呼吸综合征病毒抗体ELISA检测试剂盒,购自美国IDEXX 公司;病毒磁珠法血液总RNA快速提取试剂盒,购自北京百泰克生物技术有限公司;PRRSV 通用型RT-qPCR检测试剂盒,购自洛阳莱普生信息科技有限公司。
1.2 PRRSV抗体检测参照IDEXX猪繁殖与呼吸综合征病毒抗体ELISA检测试剂盒说明书,对送检样品进行PRRSV抗体检测。结果判定标准:S/P值< 0.4为阴性,S/P值≥0.4为阳性。
1.3 PRRSV RT-qPCR检测血清总RNA的提取,按照磁珠法血液病毒RNA提取试剂盒说明书进行加样,然后放进全自动核酸提取仪进行批量提取样本RNA。以提取好的血清总RAN为模板,按照PRRSV通用型RT-qPCR检测试剂盒说明书进行加样检测。Primer-F:5'-GGGTAAGATCATCGC TCAGC-3',Primer-R:5'-GGTCTGGATTGACGA CAGACA-3',引物P:FAM- CAGTCCAGAGGCA AGGGACCG-MGB,以上为试剂盒参考引物序列。反应体系:扩增反应液17 μL、混合酶反应液0.8 μL、模板2.5 μL。反应条件:42℃ 5min,95℃预变性10 s,95℃变性5 s,55℃退火40 s,共40个循环。结果判定标准:样本检测结果Ct值≤35,有明显指数增长,表明样本中检测出该病毒,判为阳性;35<Ct值≤38判为可疑,可疑样本如果为典型S型扩增曲线则为可疑阳性,否则为阴性,可疑样本需重复检测;样本检测结果Ct>38或无Ct值,表明样本中未检测出该病毒。
1.4 数据处理检测数据使用SPSS 17.0进行统计学分析,利用单变量方差分析比较,当P< 0.05 时表示差异显著,具有统计学意义。
2 结果与讨论
2.1 不同地区猪场PRRSV抗体检测结果不同地区猪场送检血清的PRRSV抗体检测结果,见表1。结果显示,江苏省7个地区未免疫猪场均表现出较高的PRRSV抗体阳性率,阳性率为58.82%~72.04%,抗体总阳性率为68.82%。其中高于抗体总阳性率的地区有泰州、南通、盐城和宿迁,最高为宿迁的72.04%,低于抗体总阳性率的地区分别为扬州、连云港和常州,最低为连云港58.82%。上述结果表明,江苏省未免疫PRRS疫苗的规模猪场普遍存在PRRSV 野毒感染。综合分析认为主要有以下几点原因:(1)不同地区的不同规模猪场对PRRS防控理念有所差异,尤其对于是否选用PRRS疫苗免疫与选用何种类型的疫苗免疫存在较大争议。这与市场上PRRS疫苗种类繁多,现有疫苗不能对PRRSV变异毒株提供完全的交叉保护有关[5];(2)多数规模猪场生物安全控制措施存在漏洞,尤其较小规模的猪场漏洞相对较多[6],具体表现在消毒意识淡薄,缺乏完备的消毒设施及消毒制度,如猪场只重视猪群生产,不愿在环控设备、防疫消毒等基础设施建设上增加投入。此外,不重视疫病风险点的控制[7],如人员流动与车辆进出消毒不彻底、病死猪与废弃物的无害化处理不到位等;(3)缺乏后备母猪引种与公猪精液定期检测机制,部分猪场对后备猪引种前后不检测或引进后不经隔离驯化直接与现有猪群混养是造成猪场PRRS发病的主要原因之一[8],同时种猪场忽视种公猪精液的定期检测,促使PRRSV在猪场持续循环感染[9];(4)近3年由于浙江省、上海市及江苏省南部地区猪场迫于环保压力,部分拆迁的猪场逐年向江苏中部及北部地区转移,猪群的频繁调动及饲养密度的大幅增加,而与之相配套的管理及防控措施不完善,是引发上述江苏省7个地区(苏中和苏北为主)规模猪场PRRSV野毒感染的重要原因之一。
2.2 不同年份猪场 PRRSV抗体检测结果不同年份PRRSV抗体检测结果显示,PRRSV抗体阳性率在2016~2018年呈现逐年下降趋势,从2016年的76.41%下降到2018年的57.72%,具体数据见表2。结果表明,江苏省猪群 PRRSV感染压力有所下降,分析原因有以下几个方面:(1)本次调查的规模猪场均未免疫PRRS疫苗,而生产中免疫PRRS疫苗的猪场占多数,科学选择PRRS疫苗和制定合理的免疫程序仍然是现阶段防控PRRS的主要措施,这也是江苏规模化猪场PRRSV感染压力下降的原因之一;(2)当前,部分小规模猪场和养殖户,受重要疫病流行、市场风险和环保压力的多重影响,正逐渐退出养猪行业,这对减少猪疫病的流行及科学防控上有一定的推进作用;(3)2018年下半年,受非洲猪瘟的影响,规模猪场对PRRS的关注度有所下降,因此,检测的样品数量有所下降且PRRSV抗体阴性样本占比较多,这对2018年的PRRSV抗体总阳性率可能会有所干扰。
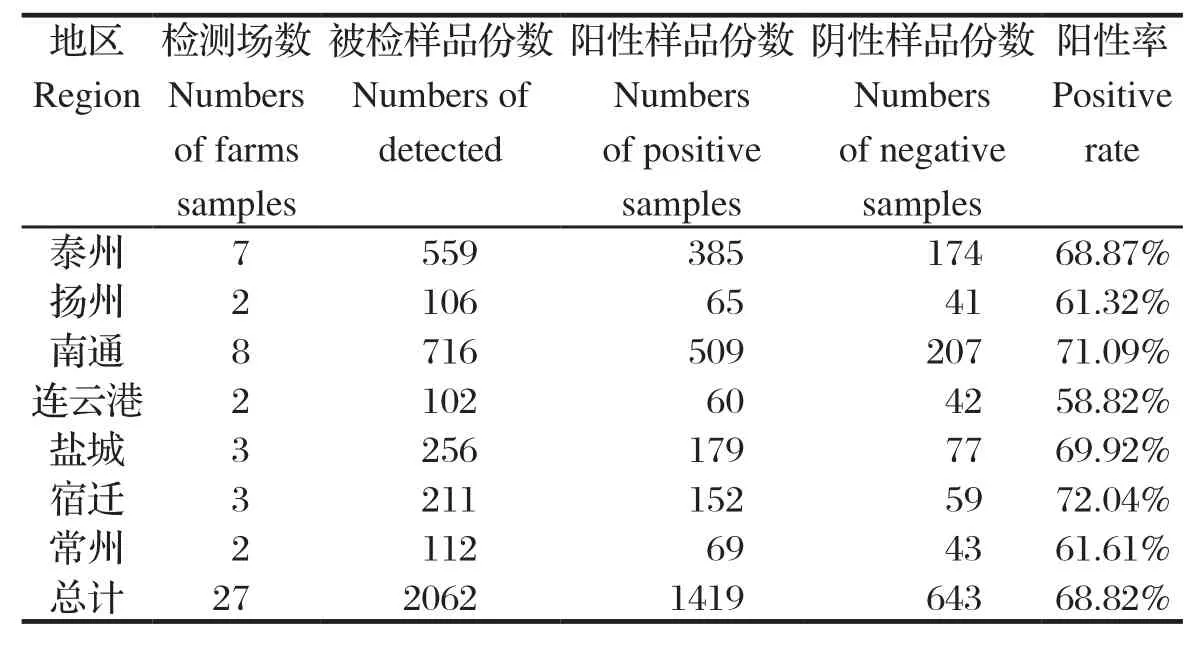
表1 不同地区猪场 PRRSV抗体检测结果Table 1 The results of PRRSV antibody in swine sera collected from different regions

表2 不同年份猪场 PRRSV抗体检测结果Table 2 The results of PRRSV antibody in swine sera collected on different year
2.3 不同规模猪场PRRSV抗体检测结果不同规模猪场PRRSV抗体检测结果,见表3。由表3可知,500≤母猪存栏≤1000的较大规模场,PRRSV抗体阳性率为61.73%,300 <母猪存栏<500的较小规模场,PRRSV 抗体阳性率为73.86%,两者感染比例相差12.13%,差异具有显著性统计学意义(P<0.05)。结果表明,规模较大一些的猪场对PRRS的防控效果相对较好,PRRSV感染率小于规模较小猪场的。虽然PRRS疫苗免疫有争议、防控有难度,但总体看来规模化猪场对PRRS的防控重视程度较高,尤其是规模较大的猪场,其在饲养管理、生物安全和药物预防控制继发感染等综合防控理念及生产中的运用优于较小规模的猪场,伴随集约化养猪业的发展,规模化猪场对生物安全与综合防控的重视程度呈现逐年升高的趋势。
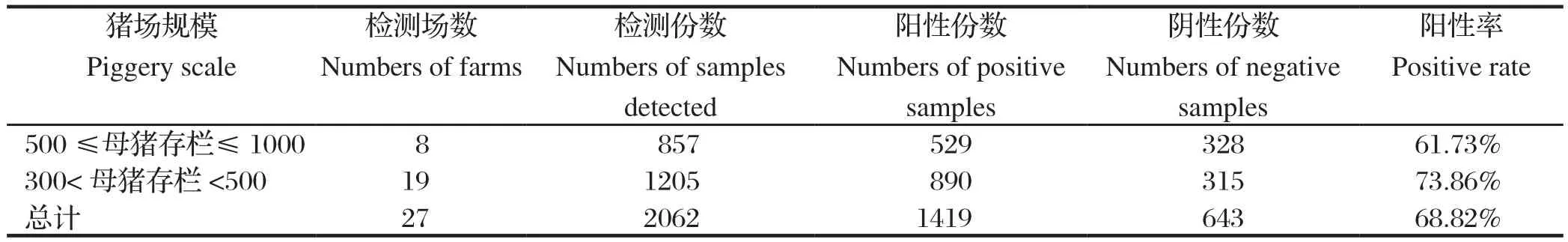
表3 不同规模猪场PRRSV抗体检测结果Table 3 The results of PRRSV antibody in swine sera collected from different scales
2.4 不同阶段猪群 PRRSV抗体检测结果不同阶段猪群PRRSV抗体检测结果发现,公猪、后备母猪、12~16周龄育肥猪和18~25周龄育肥猪抗体阳性率较高,分别为80.95%、92.86%、86.84%和98.09%,且种猪群中公猪、后备母猪与各胎次经产母猪、商品猪群中10周龄以内仔猪与12周龄以上育肥猪PRRSV抗体阳性率差异均具有显著统计学意义(P<0.05),具体数据见表4。上述结果表明,种猪群以公猪和后备母猪抗体阳性率较高,且抗体S/P值≥2.5比例偏高,分别为9.52%和11.9%,提示这些猪群PRRSV相对活跃,正处于野毒感染或感染后的高病毒血症期[10-11]。种猪群中公猪和后备猪对PRRSV易感性较高,公猪的精液传播和后备猪的引种是造成猪场PRRSV感染的重要因素[12-13]。建议规模化种猪场加强公猪的精液检测,做好后备母猪的引种检测、隔离、驯化及适时淘汰老龄经产母猪,不断引进PRRSV阴性后备母猪,加速猪场母猪更新,降低猪场PRRSV野毒阳性率是控制种猪群PRRS流行的重要措施。商品猪群中12周龄后的育肥猪PRRSV抗体阳性率急剧上升,且抗体S/P值≥2.5比例高达25.64%,提示大部分猪只已感染野毒,虽然育肥猪的抵抗力较强,PRRSV感染后不表现或仅表现轻微的呼吸道症状,但是育肥猪携带的病毒可以回传至经产母猪[14],尤其是1~2胎的经产母猪的易感性较高,造成PRRSV在猪群内进行循环感染。建议规模化猪场对商品猪PRRS的防控可从加强猪群饲养管理、减少应激因素、做好仔猪的疫苗接种、药物预防控制继发感染和适当降低育肥猪的饲养密度等方面开展。
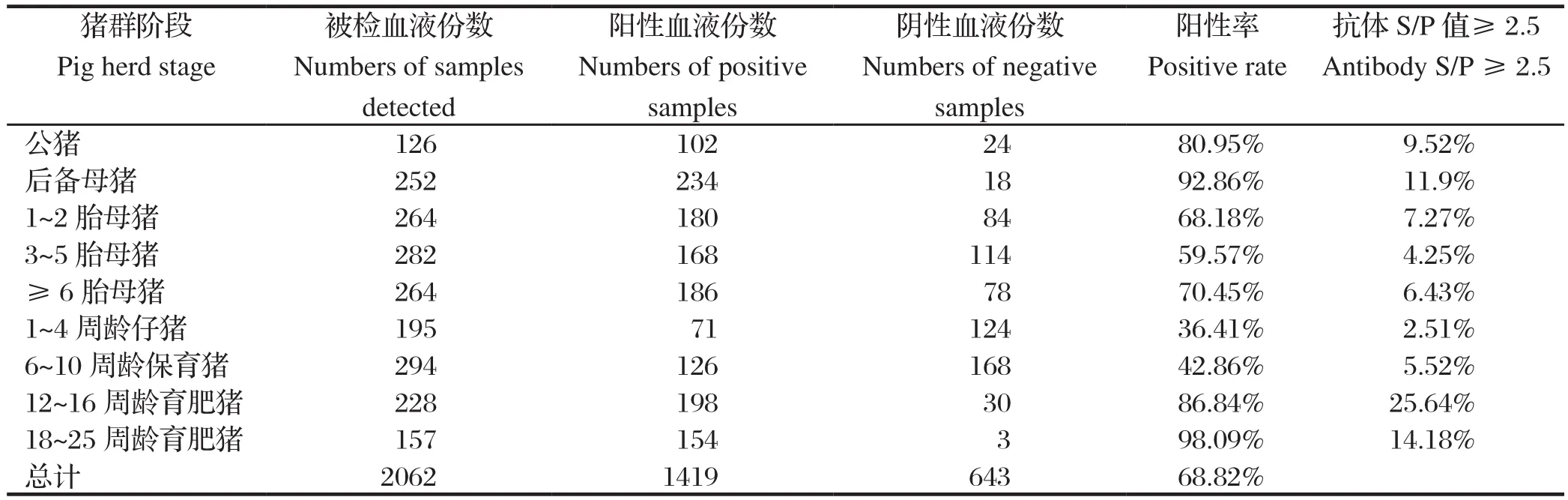
表4 不同阶段猪群 PRRSV抗体检测结果Table 4 The results of PRRSV antibody in swine sera at different stages
2.5 PRRSV RT-qPCR检测结果对PRRSV抗体阳性率≥80%的公猪、后备母猪、12~16周龄育肥猪和18~25周龄育肥猪4个阶段猪群,按照抗体S/P值<0.4、0.4≤S/P值<2.5 和S/P值≥2.5不同分布频段,选取135份血清进行RT-qPCR PRRSV检测,结果见表5。由表5可知,135份血清共计检出24份PRRSV核酸阳性样本,病毒Ct值与抗体S/P值高低无相关性。在上述4个抗体阳性率≥80%的猪群阶段,血清PRRSV阳性率以后备母猪最高,为20.58%,抗体S/P值<0.4和S/P值≥2.5异常分布频段,血清PRRSV阳性率均≥15.38%,而在0.4≤S/P值<2.5正常范围内,血清PRRSV阳性率均≤10%,抗体异常与正常分布频段血清PRRSV阳性率之间比较差异显著,具有统计学意义(P<0.05),见表6。吴静波等[15]采用ELISA和RT-qPCR方法检测PRRSV抗体水平与PRRS病毒血症之间的关系发现,抗体S/P值<0.4和S/P值>2.5 的猪群中PRRS病毒血症发生率为16.7%,S/P值在0.4~2.5之间的猪群中PRRS病毒血症发生率为7.3%。本研究结果表明,PRRSV抗体在0.4≤S/P值<2.5正常范围内,公猪、后备母猪、12~16周龄育肥猪和18~25周龄育肥猪,RT-qPCR检测,血清PRRSV阳性率分别为8.33%、9.09%、8.33%和10.00%,与吴静波等[15]报道的结果较为吻合,说明PRRSV抗体水平为0.4≤S/P值<2.5,PRRS病毒血症检出率相对较低,但血清中的PRRS病毒滴度与S/P 值的高低没有明显的相关性。

表5 24份PRRSV阳性样本RT-qPCR检测结果Table 5 The results of RT-qPCR from 24 positive PRRSV samples
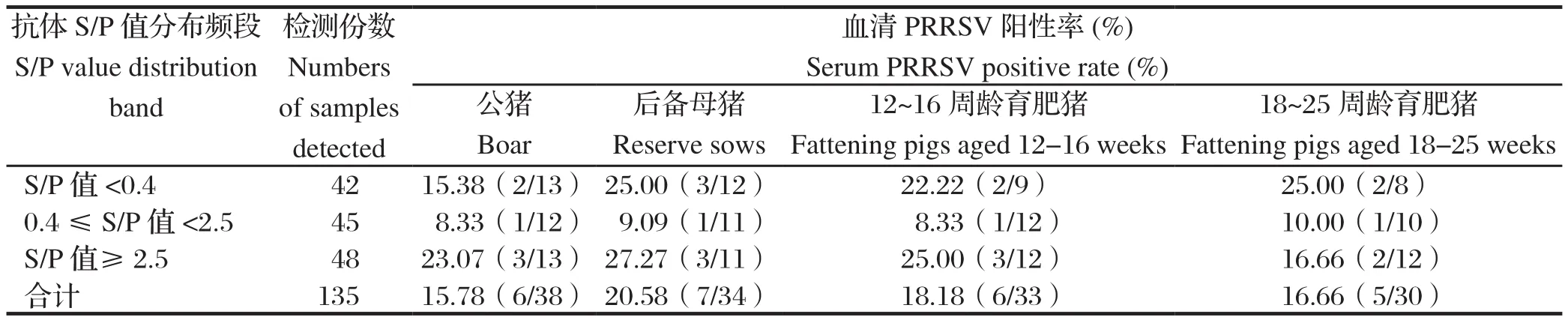
表6 PRRSV抗体阳性率≥80%猪群阶段血清PRRSV检测结果Table 6 The results of PRRSV in serum of pigs with positive rate of PRRSV antibody≥80%
PRRS的血清学调查由于受检测时机、采样数量及采样阶段等因素的影响,调查结果往往会有所差异[16]。本次调查所有送检样品均来自于300头以上母猪存栏的规模化场,这种规模占当前江苏省养猪业的主流。因此,本研究的调查结果比较接近江苏省规模猪场PRRS的流行动态。鉴于PRRSV变异的多样性与免疫机制的复杂性,当前规模化猪场对PRRS的防控仍然面临着压力与挑战,做好PRRS的免疫、检测、生物安全等是防控PRRSV感染的重要举措。

