单增李斯特菌srtA基因缺失株的构建及srtA基因对其毒力的影响研究
张奇文,凌 晨,吴学林,马 勋,薄新文
(1.石河子大学动物科技学院,石河子 832003;2.天康生物股份有限公司,乌鲁木齐 830010;3.新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子832003)
革兰氏阳性菌的细胞壁是由多层肽聚糖构成,表面分子磷壁酸及表面蛋白等均呈现在肽聚糖上,表面蛋白的种类不同,锚定机制也有所不同[1]。表面蛋白锚定到肽聚糖的过程由分选酶催化完成,这类蛋白在致病菌中发挥重要的毒力作用[2]。1999年Mazmanian等[3]以SPA为模型研究了表面蛋白的锚定过程,表明分选酶A(sortase A,SrtA)与SPA锚定到细胞壁表面过程密切相关,并且证实SrtA通过识别LPXTG保守基序,将蛋白共价结合到细胞壁肽聚糖上。Pallen等[4]对已测序的92个细菌基因组进行分析发现,大多数革兰氏阳性菌中都存在分选酶同源基因,只是在不同细菌基因组中存在的数量、种类、功能等存在一定差异。
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)是革兰氏阳性、胞内寄生菌,一种重要的食源性人兽共患病原菌,可以穿越宿主的肠道屏障,血脑屏障和血胎屏障,临床上引起肠胃炎、脑膜炎、脑炎、败血症、流产等症状,LM的致病过程涉及多种毒力因子及其相关的酶类。LM表面有多种前体分子中含有LPXTG基序的表面蛋白,对于LM致病性发挥重要作用,如InlA、InlJ、LapB和VIP等[5-10]。在LM中,srtA是由222个氨基酸组成的分选酶,参与一些含有LPXTG基序的表面蛋白与肽聚糖的结合过程[11]。目前已报道,srtA基因缺失以后,可以影响表面毒力蛋白锚定到细胞壁,从而影响细菌毒力[3,11-13]。
血脑屏障是LM引起脑膜炎、脑炎必须穿越的屏障[14],目前对于LM跨越血脑屏障的研究主要通过建立感染小鼠脑炎模型观察病变特征[15],体外血脑屏障研究则主要是脑微血管碎段模型、脑微血管内皮细胞模型、脑微血管内皮细胞和星形胶质细胞共同培养模型[16],而培养脑血管内皮细胞是目前国内外常用的血脑屏障模型。本研究以新疆发病绵羊脑内临床分离株LM90SB2为研究对象[17],利用同源重组的方法构建srtA基因缺失株(LM90SB2-ΔsrtA),与LM90SB2株比较在脑微血管内皮细胞(brain microvascular endothelial cells,BMEC)的粘附、侵袭及胞内和小鼠脑内增殖的差异,探讨srtA基因在LM90SB2穿越血脑屏障中的作用。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒、细胞 LM分离株LM90SB2是2000年石河子大学动物科技学院微生物免疫实验室从新疆发病绵羊脑内分离得到的单核细胞增生性李斯特菌,由本实验室鉴定后保存,血清型为4b型;自杀性质粒pKSV7由浙江大学动物科学学院分子微生物与食品安全实验室馈赠;大肠杆菌DH5α感受态细胞和pMD19-T(simple)购自大连宝生物(TaKaRa)公司。原代人脑微血管内皮细胞(human brain microvascular endothelial cell,HBMEC)购买自美国ScienCell Research Laboratories;鼠脑微血管内皮细胞(murine brain microvasular endothelial cell,MBMEC)购自广州吉妮欧生物科技有限公司;猪肠上皮细胞(swine intestinal epithelial cell,SIEC)和小鼠巨噬细胞RAW264.7由本实验室保存。
1.1.2 主要试剂TaqDNA聚合酶、PfuDNA高保真聚合酶、dNTP、PCR Mix、DNA Marker DL2000均购自广州东盛生物科技有限公司,限制性核酸内切酶(BamHⅠ、PstⅠ)、T4 DNA 连接酶购自宝生物工程(大连)有限公司,琼脂糖凝胶电泳回收试剂盒购自北京诺维森生物科技有限公司,质粒小提试剂盒购自天根生化科技有限公司,氨苄青霉素(Amp)、氯霉素、庆大霉素、青霉素G、溶菌酶、HEPES均购自北京博奥拓达科技有限公司,脑心浸液(brain heart infusion broth,BHI)培养基购自青岛高科技园海博生物技术有限公司。
1.1.3 实验小鼠 6~8周BALB/c小鼠购自石河子大学动物实验中心。
1.1.4 相关引物 扩增引物、缺失srtA基因的相关引物及缺失株的验证引物如表1所示。所有引物由北京华大基因公司合成。
1.2 方法
1.2.1srtA基因的克隆与分析 根据文献[18]中的煮沸法提取LM分离株LM90SB2的基因组。实验中所需要的引物见表1。引物srtAF/srtAR 扩增包含srtA基因及其上下游同源臂序列,PCR的反应体系:TaqDNA聚合酶(5 U/μL)1 μL,dNTP(25 mmol/L)1 μL,10×Buffer 3 μL,上下游引物(10 μmol/L)各1μL,模板1 μL,ddH2O补足30 μL。反应条件:95℃预变性5 min,95℃变性40 s、60℃退火30 s、72℃延伸100 s,30个循环,72℃延伸10 min,4℃保存。琼脂糖凝胶电泳检测目的基因,回收目的片段,连接到pMD19-T(simple)载体,转化到DH5α感受态细胞,送北京华大基因公司测序。测序结果与NCBI上已公布LM标准株的全基因序列进行比对分析。

表1 本研究引物Table 1 Primers used in this study
1.2.2 LM90SB2-ΔsrtA缺失株的构建 利用SOE-PCR(splice overlap extension PCR)的方法构建含有srtA基因上下游同源臂的重组质粒[18],将重组质粒电转化进入LM分离株LM90SB2中,与基因组中的同源臂进行重组,通过筛选鉴定得到LM90SB2srtA基因缺失株。反应条件:含有引物对srtA1/srtA2的体系退火温度为53.6℃;含有引物对srtA3/srtA4的退火温度为59.3℃,其他条件同1.2.1。纯化回收PCR产物,用SOE-PCR的方法融合形成886 bp的融合片段ΔsrtA,连接到pMD19-T(simple)载体,转化入DH5α,送北京华大基因公司测序,筛选出序列正确的阳性质粒pMD19-T-ΔsrtA。质粒pMD19-TΔsrtA和pKSV7经PstⅠ和BamHⅠ双酶切后,经连接构建重组质粒pKSV7-ΔsrtA。将获得的重组质粒pKSV7-ΔsrtA电转(2.5 kv, 5 ms)至LM90SB2感受细胞态中,并接种于含有10 μg/mL 氯霉素的BHI平板上进行阳性克隆的筛选。经PCR鉴定阳性的克隆接种到含有5 mL BHI培养基(含10 μg/mL 氯霉素)的试管,在41℃、100 r/min的条件下连续传代,以srtA1/srtA4、srtA5/srtA6两对引物来筛选srtA基因缺失株。将srtA基因缺失株接种于5 mL无抗性BHI培养基的试管中,在30℃、100 r/min的条件下连续传代,影印接种于BHI-Cl和BHI平板,筛选出不含抗性的LM90SB2srtA基因缺失阳性克隆,并连续传代无变化,送至北京华大基因公司测序。
1.2.3 细胞侵染实验
1.2.3.1 细胞和细菌的培养 采用含有10%胎牛血清(fetal bovine serum,FBS)和双抗(100 U/mL青霉素和10 μg/mL硫酸链霉素)的DMEM培养所有细胞。并接种于24孔细胞培养板,置于含37℃、5%CO2细胞培养箱中,培养24 h使细胞长成单层。挑取单个菌落接种于含有5 mLBHI的试管中,置于37℃、180 r/min的摇床中培养16 h,取培养物8000×g离心5 min收集菌体,PBS洗涤2遍,稀释细菌于DMEM培养液中,平板计数,使细菌数量大约为107CFU/mL,用于感染细胞。
1.2.3.2 细菌对细胞的粘附与侵袭 参考文献[19-20]中的方法来分析菌株对于细胞的粘附侵袭作用。按照一定的比例(细菌∶内皮细胞=50∶1,细菌∶巨噬细胞=5∶1)用细菌感染24孔细胞培养板中的细胞60 min,使得细菌粘附并侵入细胞。感染结束后,37℃预热的PBS洗涤细胞2次,去除未粘附细胞的细菌,用0.1 mL 0.25% TritonX-100裂解细胞10 min,用PBS洗涤混旋均匀后,10倍梯度稀释,平板计数,计算细菌对细胞的粘附率。细菌感染结束后,37℃预热的PBS洗涤2次后,加入含有100 μg/mL的庆大霉素的新鲜DMEM置于37℃、5%CO2的细胞培养箱中培养1 h,杀灭细胞外没有侵入细胞的细菌,弃培养液PBS洗涤1次,按上述方法裂解细胞、菌落计数,计算细菌对细胞的侵袭率。
1.2.3.3 细菌在细胞内的增殖 细菌感染细胞60 min后,PBS洗涤2次,加入含有100 μg/mL庆大霉素的DMEM,培养细胞40 min后,裂解细胞,平板计数,记做t=0。其余加入含有5%FBS和10 μg/mL庆大霉素的DMEM,培养于37℃、5%CO2细胞培养箱中,间隔一定的时间(t=2、4、6、8、10和12 h)按上述方法裂解细胞,菌落计数,绘制细菌在细胞内的生长曲线。
1.2.4 小鼠毒力实验 6~8周BALB/c小鼠饲养一周,观察其无异常变化,随机分组。挑取单菌落接种于BHI培养基中,在37℃、180 r/min的摇床中振荡培养16 h,菌液于5000×g离心5 min,收集菌体,PBS洗涤2次,悬浮菌体于PBS中,调整各菌株菌量至同一水平,约8×109CFU/mL。将细菌悬液10倍梯度稀释至8×105CFU/mL,平板计数确定实际接种量。各梯度的细菌悬液腹腔接种小鼠0.5 mL,每组接种6只小鼠,同时接种PBS为阴性对照组,统计接种后10 d内小鼠死亡数,用寇氏法计算LD50。将含有5×105CFU/mL的细菌悬液腹腔接种小鼠0.3 mL[21],每个菌株接种15只小鼠,分别在接种后1、2、3、4 d无菌剖取小鼠肝脏、脾脏和脑,加入1 mL PBS充分研磨制成均匀的组织悬液,用PBS进行10倍梯度稀释,涂布于亚碲酸钾平板计数,挑取菌落用引物对hlyF/hlyR进行PCR鉴定。
1.2.5 统计学分析 统计每组BHI平板计数结果,细菌粘附率计算公式:(胞内细菌数+胞外细菌数)÷加入孔内的细菌数×100%。侵袭率计算公式:胞内细菌数÷加入孔内的细菌数×100%,而细胞内增殖则用不同培养时间段(2、4、6、8 h等)细胞裂解计数结果取对数表示。用软件 SPSS17.0 采用t检验对数据进行统计学分析。
2 结果
2.1 LM分离株LM90SB2 srtA基因的扩增与分析扩增获得srtA基因的开放阅读框大小为669 bp(图1),编码222个氨基酸,LM90SB2的srtA基因与LM F2365 株(serovar 4b,NC_002973)的srtA基因的核苷酸同源性为100%,与LM EGD-e株所编码(serovar 1/2a,NC_003210)的srtA基因的核苷酸同源性为94.32%,氨基酸同源性为99.55%,只有第176位的氨基酸由天冬酰胺突变为天冬氨酸,不属于SrtA的活性中心和保守区域。
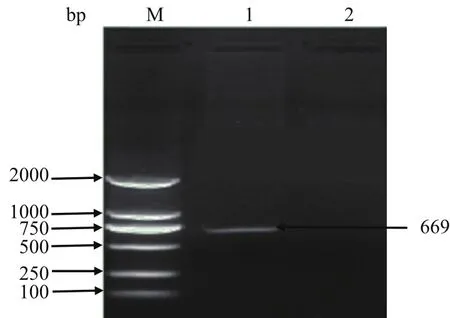
图1 LM分离株LM90SB srtA基因 PCR 扩增结果Fig.1 PCR products of srtA gene
2.2 LM90SB2 srtA基因缺失株的构建用SOE-PCR的方法扩增了1个886 bp的srtA基因上下游同源臂,连接到载体pKSV7上,构建pKSV7-ΔsrtA,并将其电转进入分离株LM90SB2中,含有重组质粒pKSV7-ΔsrtA的LM90SB2菌随机同源重组形成srtA基因缺失株LM90SB2-ΔsrtA,用引物对srtA5/srtA6进行PCR鉴定。结果显示,分离株目的条带为1747 bp,见图2。缺失株目的条带为1078 bp,测序结果证实srtA基因缺失。与分离株LM90SB2相比,LM90SB2-ΔsrtA在BHI培养基中37℃条件下生长无差异,连续传代后PCR检测无变化,表明缺失片段具有遗传稳定性。
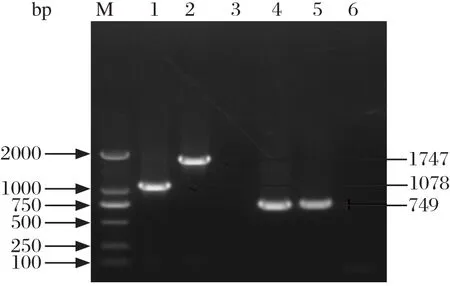
图2 LM缺失株LM90SB2-ΔsrtA PCR鉴定Fig.2 Identi fication of recombinant LM90SB2-ΔsrtA by PCR
2.3 LM分离株LM90SB2和缺失株LM90SB2-ΔsrtA对不同种类细胞的感染能力分析LM对细胞的粘附和侵袭与细胞类型有关。分离株LM90SB2对MBMEC、HBMEC、RAW264.7、SIEC的粘附率和侵袭率均不同,粘附率分别为1.2952、0.9740、7.3470、1.4343;侵袭率分别为0.3264、0.4718、3.3610、0.8267(表2)。分离株LM90SB2在不同细胞内的增殖趋势不同,在MBMEC、RAW264.7中,细菌数目随时间呈现一个先下降后上升的趋势(图3A和3C);HBMEC中,不同时间细菌数目保持相对平稳(图3B);在SIEC细胞中,细菌数目随时间不断下降(图3D)。缺失株LM90SB2-ΔsrtA对细胞的粘附和侵袭均较分离株LM90SB2下降(表2)。统计学分析,与分离株LM90SB2相比,缺失株LM90SB2-ΔsrtA对HBMEC、RAW264.7、SIEC的粘附和对MBMEC、RAW264.7、SIEC的侵袭差异具有显著统计学意义(P<0.05)(表2)。
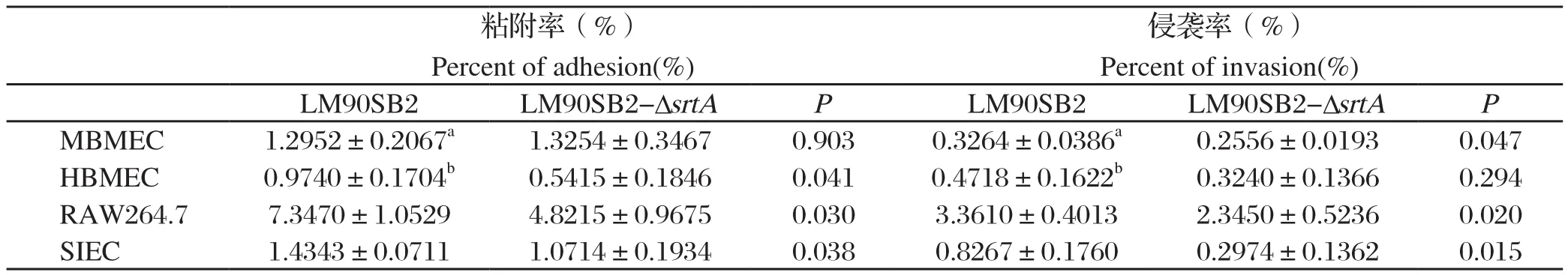
表2 LM分离株LM90SB2和缺失株LM90SB2-ΔsrtA对细胞的粘附和侵袭效率Table 2 Percent of adhesion and invasion results of LM90SB2 strain and LM90SB2-ΔsrtA strain

图3 LM分离株LM90SB2 (◇WT)和LM缺失株LM90SB2-ΔsrtA (■ΔsrtA)在不同时间点细胞内的细菌数Fig.3 Numbers of LM90SB2 (◇WT) and LM90SB2-ΔsrtA(■ΔsrtA) in the cells after infection at various time
2.4 srtA基因的缺失对小鼠致病能力的影响小鼠腹腔注射不同浓度的菌液,24 h后小鼠出现死亡,统计小鼠死亡数,用寇氏法计算LD50,测得LM90SB2-ΔsrtALD50为107.73,分离株LM90SB2的LD50为106.1。结果表明srtA基因缺失后的LM对小鼠的毒力下降了1.63 个对数级。
与分离株LM90SB2相比,缺失株LM90SB2-ΔsrtA在小鼠肝脏、脾脏中载菌量均显著减少,具有统计学意义(P<0.05)(图4A和4B),但脑载菌量在感染后第1~3 d的缺失株LM90SB2-ΔsrtA明显高于分离株LM90SB2,具有极显著统计学意义(P<0.01),分离株LM90SB2感染3 d后,脑中细菌数量出现快速增长,在第4 d分离株LM90SB2高于缺失株LM90SB2-ΔsrtA,具有统计学意义(P<0.05)(图4C)。结果表明,srtA基因缺失后细菌仍然可以感染小鼠并在靶器官中生长繁殖,但是含菌数量相对分离株发生了变化,特别是在脑中呈现先升高后下降的趋势,说明缺失株仍然能穿越血脑屏障,但是srtA基因缺失后影响LM90SB2在脑中的增殖。
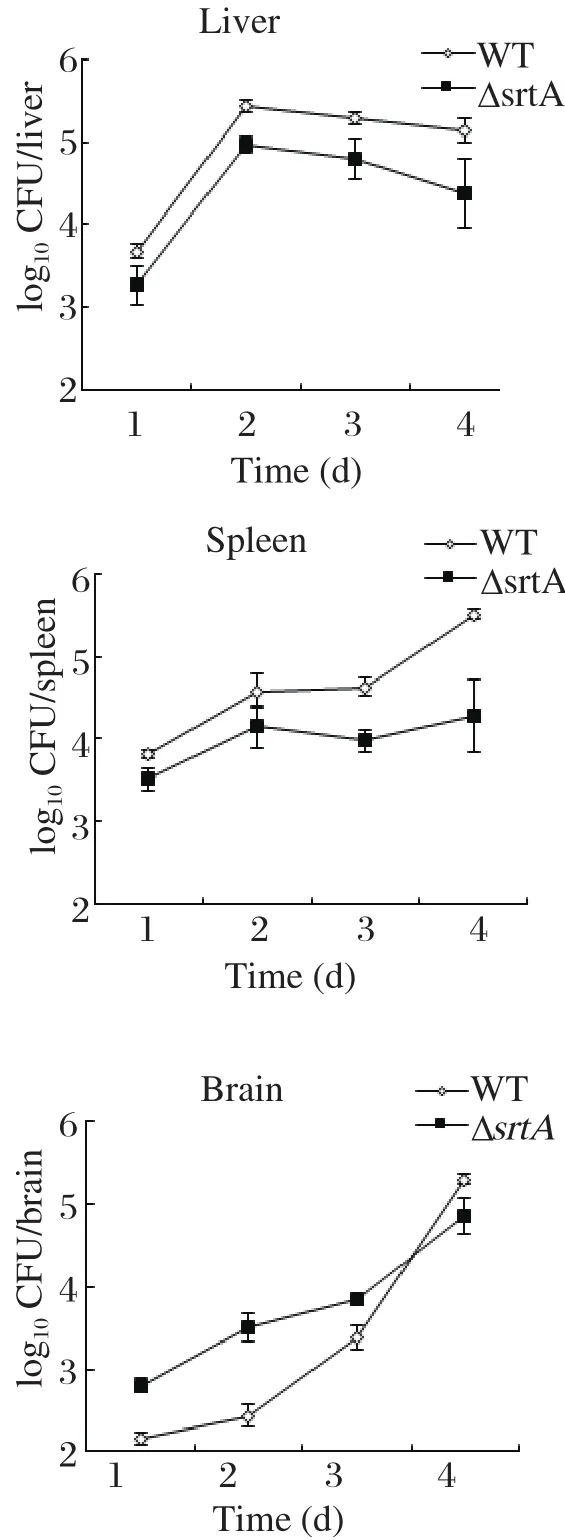
图4 分离株LM90SB2 (◇WT)和缺失株LM90SB2-ΔsrtA (■ΔsrtA)在感染小鼠4 d内肝脏、脾脏、脑中载菌量的变化Fig. 4 Numbers of LM90SB2 (◇WT)and LM90SB2-ΔsrtA (■ΔsrtA) in mice liver, spleen, brain during 4 days
3 讨论
LM感染一般经胃肠道开始,侵入肠上皮细胞跨越肠道屏障,被单核巨噬细胞吞噬,随淋巴系统和血液循环系统到达肝脏和脾脏,并在肝细胞中繁殖,最后通过血液扩散到脑和胎盘,引起全身性感染;LM通过内化、逃离吞噬泡、利用在宿主细胞内的极向运动实现细胞间直接传播等方式逃逸宿主的体液免疫应答;这些过程涉及LM的多种毒力因子[22-24]。srtA基因编码的分选酶,可以识别表面蛋白C端分选信号所含的保守氨基酸基序LPXTG,把蛋白锚定到肽聚糖上,呈现在细菌表面,发挥毒力作用。
自1996年以来,中国新疆维吾尔自治区某些地区的羊群陆续爆发一种以神经症状为主要特征的疾病,死亡率高达70%以上,结合临床表现,经病原分离鉴定,确诊为单核细胞增多性李斯特菌引起的绵羊脑炎[17]。构建srtA基因缺失株是研究其基因功能的基础,我们通过构建LM90SB2-ΔsrtA缺失株,分别在细胞水平和小鼠水平探讨srtA基因在LM分离株LM90SB2毒力发挥中的作用。通过对不同类型细胞的粘附、侵袭及胞内增殖试验表明,srtA基因缺失可以降低LM90SB2对MBMEC、HBMEC、RAW264.7、SIEC细胞的粘附、侵袭和胞内增殖能力。
SIEC是猪源肠道上皮细胞,缺失株LM90SB2-ΔsrtA对SIEC的粘附和侵袭的能力下降,与Garandeau等[25]报道LM的srtA基因缺失后,对于Caco-2细胞和HepG-2细胞的侵袭力降低相一致,表明LM分离株LM90SB2的srtA基因参与细胞表面蛋白的锚定,但是在SIEC中细菌数随时间不断下降,究其原因:可能是细菌在胞内增殖后,造成SEIC的脱落死亡,裂解计数前随细胞培养液一起弃掉;细菌在胞内增殖后,从细胞内释放出来被培养液中的庆大霉素抑制;或者是细菌还没有在细胞内增殖和细胞间传递,被侵染的细胞随时间逐渐死亡。

表3 LM分离株LM90SB2和缺失株LM90SB2-ΔsrtA对小鼠LD50测定Table 3 LD50 measurement results of LM90SB2 and LM90SB2-ΔsrtA
LM分离株粘附和侵袭RAW264.7的能力均高于粘附和侵袭SIEC、MBMEC和HBMEC,这可能与RAW264.7为免疫细胞,可以通过其表面的PRR受体和TOLL样受体等增强对LM90SB2细菌吞噬。LM分离株和缺失株进入RAW264.7后均有一定程度的增殖,表明他们具有一定的抗吞噬细胞消化能力,但是缺失株LM90SB2-ΔsrtA在胞内增殖数量低于分离株LM90SB2,可能与srtA缺失后,一些抗吞噬细胞消化的蛋白不能表达在细胞表面有关。
LM能引起脑膜炎和脑炎,其中一种方式是穿越血脑屏障(blood brain barrier,BBB),LM穿越血脑屏障的机制目前尚不清楚。BBB主要由内皮细胞间紧密连接、星形胶质细胞、周皮细胞和血管周围的小胶质细胞以及基膜等结构构成。体外血脑屏障研究主要是脑微血管碎段模型、脑微血管内皮细胞模型、脑微血管内皮细胞和星形胶质细胞共同培养模型,而培养脑血管内皮细胞是目前国内外常用的血脑屏障模型之一[26-27]。LM90SB2能够粘附、侵袭脑微血管内皮细胞(brain microvascular endothellal cell,BMEC),并在其中增殖,可能是LM穿越BBB的方式,srtA基因缺失可以降低LM90SB2对BMEC的粘附、侵袭和胞内增殖,可见SrtA分选的蛋白参与了对BMEC细胞的作用。本次试验也发现LM90SB2对HBMEC和MBMEC的粘附有差异,表明细菌对脑细胞的侵染存在种属特异性,这可能与不同种属来源细胞其表面受体不同有关[26,28-32]。
LM90SB2-ΔsrtA对小鼠LD50比LM90SB2降低了21.38倍,说明LM90SB2-ΔsrtA的毒力明显下降,并且在感染后4 d内,肝脏、脾脏和脑中的载菌量始终低于LM90SB2,表明srtA基因的缺失会影响LM90SB2在各脏器中的增殖。
本研究结果表明,srtA基因缺失并没有使LM90SB2丧失对小鼠的致病性和毒力,可见SrtA分选的蛋白只部分参与了细菌的致病力。尽管SrtA参与了众多C端含有分选信号的表面毒力蛋白锚定到细胞表面的过程,可能细菌本身还存在其他类似蛋白分担SrtA的作用,或是srtA基因缺失后激活了相似蛋白发挥补偿作用,保证其生长,或者是srtA基因缺失后,使得某些蛋白的分泌特点发生了变化,一些由SrtA转运的蛋白,通过其他方式呈现在细菌表面发挥了毒力作用。这方面的研究需要我们进一步去探索。
——一道江苏高考题的奥秘解读和拓展

