UL46基因移码突变对PRV毒力的影响
程雪飞,徐晶晶,武吉强,童 武,刘宇婷,朱豪杰,郑 浩,童光志,2,李国新,2
(1.中国农业科学院上海兽医研究所,上海200241;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种危害多种野生动物和家畜的急性传染病。自2011年以来,PRV变异毒株的出现使我国许多疫苗免疫猪场发生了伪狂犬病[1]。本实验室把PRV变异株(JS-2012株)在Vero细胞上40℃传代培养120代后,获得了1株高度适应Vero细胞的毒株(JS-2012-F120株),该毒株病毒滴度明显提高,对猪和小鼠的毒力减弱[2]。测序结果显示,在传代过程中病毒基因组有多处基因缺失和突变[3]。gE是PRV主要的毒力基因,高温传代弱毒株(JS-2012-F120株)的gE至US2基因区域2307个碱基缺失被认为是PRV毒力减弱的主要因素[2]。另外,UL46基因在1796位有29个碱基插入导致基因移码突变,使3'端130个氨基酸突变[2-3]。
伪狂犬病病毒UL46为被膜蛋白,具体功能尚不清楚。在单纯疱疹病毒I型中,UL46可与UL47被膜蛋白形成复合体,共同调控UL48(VP16)的表达[4-6]。缺失UL46的HSV-1可降低病毒的复制水平,噬斑变小[6-7]。UL46也可与UL48形成复合体,促进病毒的释放[8]。高温传代毒株(JS-2012-F120株)生物学特性的改变可能与UL46基因移码突变相关[2-3]。为了研究UL46基因移码突变对PRV体外复制和病毒毒力的影响,本研究通过同源重组技术用JS-2012-F120的UL46基因替换了JS-2012的UL46基因,构建了重组病毒JS-2012-ΔUL46,并对该重组病毒、高温传代病毒株(JS-2012-F120株)及其亲本强毒株(JS-2012株)在细胞上的生长特性及对小鼠毒力进行了比较分析。
1 材料与方法
1.1 病毒与细胞伪狂犬病病毒变异株(JS-2012株)及其高温传代毒株(JS-2012-F120株)和Vero细胞均由本实验室保存。
1.2 质粒和实验试剂质粒pBluescript SK(+)和pEGFP-C3由本实验室保存;LATaqwith GC Buffer购自宝生物(大连)有限公司;细胞培养液DMEM、2×MEM、胎牛血清(fatal bovine serum,FBS)和磷酸盐缓冲液(phosphate buffer saline,PBS)购自Gibco公司;病毒基因组提取试剂盒购自天根生化科技(北京)有限公司;Fugene HD 转染试剂和低熔点琼脂购自Promega公司;EcoR I限制性内切酶购自NEB公司;同源重组酶clonExpress购自上海诺唯赞公司。
1.3 引物根据PRV JS-2012株(GeneBank登录号:KP257591.1)和JS-2012-F120株(GeneBank登录号:MG589642.1)基因组序列设计了扩增UL46基因及其上游和下游同源臂的引物,同时设计了UL46替换之后的鉴定引物以及扩增pEGFP-C3中表达的绿色荧光蛋白基因引物(表1)。
1.4 转移载体的构建利用UL46上游臂-F/R、UL46-EGFP-F/R和UL46下游臂-F/R引物,扩增JS-2012和JS-2012-F120 UL46基因的上游臂和下游臂的片段以及EGFP基因,利用UL46-EGFP-F120的上游和下游引物扩增JS-2012 UL46基因的上游臂和下游臂及F120 UL46基因,将扩增的片段与pBluescript SK(+)载体通过同源重组的方法连接,构建转移载体pBluescript(SK+)-UL46-EGFP和pBluescript(SK+)-UL46-F120。构建策略见图1。

图1 重组病毒构建示意图Fig.1 The schematic representation of recombinant virus
1.5 病毒基因组的提取将PRV接种于铺有单层Vero细胞的T75细胞培养瓶中,待细胞出现50%~60%病变时,弃去细胞上清,用PBS清洗1遍,刮取细胞收集于1.5 mL的离心管中,利用酚-氯仿异戊醇对病毒基因组进行抽提,提取之后用RNAase-free water溶解,-20℃保存。
1.6 表达EGFP的重组载体JS-2012-EGFP的构建将构建好的转移供体质粒pBluescript(SK+)-UL46-EGFP和PRV(JS-2012)基因组共转染铺有单层Vero细胞的6孔板中,待2~3 d后细胞产生病变,收取细胞上清。将上清液稀释到10-6,接种Vero细胞后1 h,弃去上清,然后铺上含有2%FBS的低熔点琼脂的培养基,室外放置30 min,再放置于37℃、5%CO2细胞培养箱培养。2~3 d后挑取带有绿色荧光的噬斑,置于无血清的DMEM中,于-20℃冻融1次后,再次接种Vero进行下一轮噬斑纯化,直至所有病变细胞都产生绿色荧光。
1.7 重组病毒vJS-2012-ΔUL46的构建将获得的表达EGFP的重组病毒vJS-2012-EGFP接种Vero细胞,按照1.5中的步骤提取病毒基因组,然后与构建好的转移供体质粒pBluescript(SK+)-UL46-F120共转染Vero细胞,待2~3 d后产生细胞病变,收取细胞上清,进行梯度稀释铺胶,挑取不含绿色荧光的病毒噬斑,置于DMEM中,冻融1次后再次接种于Vero细胞,进行下一轮噬斑纯化,每次纯化之后需用PCR鉴定,将获得的重组病毒命名为vJS-2012-ΔUL46。
1.8 重组病毒vJS-2012-EGFP和vJS-2012-ΔUL46的PCR鉴定将每轮挑取的噬斑接种于铺满Vero细胞的12孔板中,待细胞完全病变时,取250μL的上清液,按照天根生化科技(北京)有限公司病毒基因组提取试剂盒说明书提取DNA。以提取的DNA为模板,用46-EGFP鉴定-F/46-EGFP鉴定-R引物进行PCR鉴定,PCR反应体系:2×GC Buffer 10μL、LATaq0.25 μL、dNTP 2 μL、DNA模板1 μL、F/R(10 pmol/μL)0.5 μL、ddH2O 5.75 μL。反应程序:95℃预变性5 min;95℃变性30 s,62℃退火30 s,72℃延伸5 min,共35个循环;最后72℃延伸7 min,4℃保存。PCR产物进行1%的琼脂凝胶电泳,用凝胶成像仪观察条带大小。
1.9 病毒滴度的测定将PRV不同毒株接种于铺满Vero细胞的T75培养瓶中,待细胞完全病变时,将细胞和培养液冻于-80℃,然后溶解,将细胞上清于15 mL离心管500×g离心10 min,吸取上清分装于1.5 mL离心管中。将收取的病毒上清液10倍倍比稀释(10-1至10-9),接种于铺满Vero细胞的96孔板中,每个稀释度接种8孔,最后留一列作为阴性和阳性对照,接种后48 h时,记录细胞病变,按照Reed-Muench法计算TCID50。
1.10 病毒的噬斑和一步生长曲线将PRV不同毒株以1 MOI的病毒量接种于铺满Vero细胞的T25培养皿中,分别在接种后6、12、18、24、30、36、42和48 h时收取细胞上清,测定TCID50。将病毒以103.0TCID50/mL的量接种于铺满Vero细胞的6孔板中,感作1 h时弃去细胞上清,然后进行铺胶,待2~3 d后,噬斑形态大小适中时采用龙胆紫溶液进行染色,观察噬斑形态。
1.11 病毒对小鼠的毒力40只6周龄雌性BALB/c小鼠随机均分为4组,每组10只。第1~3组分别皮下接种100 μL的JS-2012、JS-2012-F120和JS-2012-ΔUL46,剂量为104.0TCID50/mL,第4组接种100 μL DMEM作为对照。攻毒后每天观察小鼠的发病和死亡情况。
2 结果
2.1 供体转移载体的构建分别对UL46基因的上游臂、下游臂和EGFP基因进行扩增,均获得了相应大小的目的条带(图略)。将回收片段连接至pBluescript SK (+)上,PCR鉴定结果显示获得了目的质粒pBluescript (SK+)-UL46-EGFP(图略)。
2.2 表达EGFP的重组病毒的构建将2.1获得的供体载体pBluescript (SK+)-UL46-EGFP与JS-2012的基因组共转染铺满单层Vero细胞的6孔板中,待病变后挑取带有荧光的噬斑。经过5轮纯化,获得了缺失UL46 并含有EGFP 的重组病毒vJS-2012-EGFP(图2A、2B)。经PCR鉴定以及测序结果证实重组病毒构建成功(图2D)。

图2 PRV vJS-2012-EGFP株和vJS-2012-ΔUL46株的噬斑纯化及鉴定Fig.2 Plaque puri fication and identi fication of recombinant virus(vJS-2012-EGFP and vJS-2012-ΔUL46)
2.3 重组病毒株vJS-2012-ΔUL46的构建将2.2中获得的含有EGFP的vJS-2012-EGFP基因组与供体质粒pBluescript (SK+)-UL46-F120共转染于铺有单层Vero细胞的6孔板中,按照1.7中所述方法筛选重组病毒,5轮纯化后获得无绿色荧光的重组病毒vJS-2012-ΔUL46(图2C)。PCR鉴定结果显示获得的重组病毒均含有相对应的目的片段(图2E)。
2.4 重组病毒在细胞上的生长特性与强毒株JS-2012相比,高温传代弱毒株JS-2012-F120的噬斑减小(图3A),在细胞上的复制较快,第18 h和48 h病毒滴度分别达到3.9×107.0/mL和7.3×107.0TCID50/mL,远高于其亲本株JS-2012的7.3×105.0/mL和5.1×106.0TCID50/mL(图3B)。重组病毒株vJS-2012-ΔUL46的噬斑大小介于强毒株JS-2012和弱毒株JS-2012-F120间(图3A),其生长趋势与亲本强毒株JS-2012无明显差别,但病毒滴度远低于高温传代弱毒株JS-2012-F120(图3B)。
2.5 重组病毒对小鼠的毒力PRV变异强毒株JS-2012接种后第3、4 d分别有6只、4只小鼠死亡,死亡率100%,平均死亡时间为3.4 d(图4);高温传代毒株JS-2012-F120接种后第6、7 d分别有8只、1只小鼠死亡,死亡率为90%,9只小鼠的平均死亡时间为6.1 d(图4);高温传代毒株的UL46基因替换JS-2012的UL46基因获得的重组病毒株vJS-2012-ΔUL46接种后第3、4、5 d分别有5、4、1只小鼠死亡,死亡率为100%,平均死亡时间为3.6 d(图4)。
3 讨论
PRV UL46蛋白为被膜蛋白,位于病毒衣壳蛋白和囊膜蛋白之间,关于其功能性的研究很少有报道。有报道发现UL46蛋白可以刺激ERK1/2的磷酸化进而调控细胞的核膜降解(nuclear envelope break down,NEBD),从而使病毒从核隔室逃脱,进入细胞质最终成熟[9]。同属于α疱疹病毒亚科的HSV-1 UL46功能研究相比较多,其中缺失UL46会使病毒的增殖能力下降;同时它可与细胞中的干扰素基因刺激蛋白相互作用,抑制I型干扰素的产生,促进病毒的免疫逃逸[10];当细胞处于氨基酸缺乏以及UL46缺失的情况下,病毒本身不能复制增殖。当恢复UL46基因时,它可以激活mTORC1受体,代偿细胞氨基酸的缺损使病毒再次增殖[11],可见UL46在病毒HSV-1复制和免疫逃逸过程中发挥着重要作用。

图3 重组病毒及其亲本毒株噬斑形态和一步生长曲线Fig.3 Plaque morphology and one step growth curve of the recombination virus and its parental virus in Vero
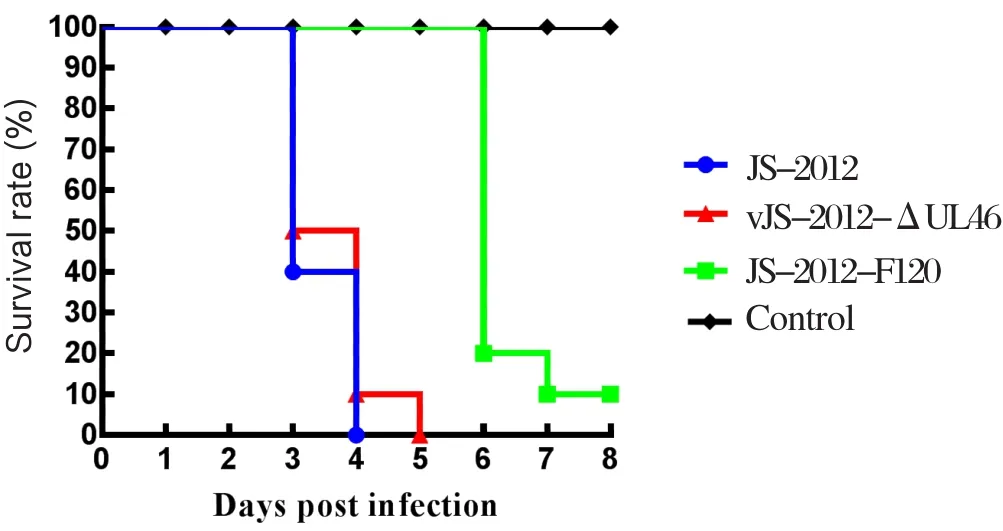
图4 攻毒后小鼠的死亡情况Fig.4 Mortality of mice post infection with PRV
在前期的研究中发现高温传代细胞适应毒株JS-2012-F120在细胞上的生长特性以及对小鼠的毒力的改变可能与UL46基因的移码突变有关[3]。为了探讨PRV UL46基因移码突变对病毒在体内外复制的影响,本研究用高温传代弱毒株JS-2012-F120的UL46基因替换了强毒株JS-2012的UL46基因构建了重组病毒vJS-2012-ΔUL46株,并通过病毒噬斑和一步生长曲线观察重组病毒的生长特性,通过小鼠感染试验观察病毒毒力。与强毒株JS-2012相比,高温传代毒株JS-2012-F120病毒滴度明显提高。这提示PRV强毒株经Vero细胞传代培养后,高度适应细胞,在细胞上的复制能力明显增强。当JS-2012的UL46基因被高温传代毒株JS-2012-F120的UL46基因替换后,重组病毒株vJS-2012-ΔUL46在细胞上的生长特性没有出现明显差别,只是噬斑略有减小,这提示单一的UL46移码突变对野生变异毒株JS-2012在细胞中的生长影响不大,高温传代毒株JS-2012-F120在Vero细胞上复制能力增强可能是其他基因突变引起的或者是包括UL46在内的多基因协同作用的结果。另一方面,高温传代毒株JS-2012-F120对小鼠的致死率为90%,低于强毒株JS-2012,小鼠的平均死亡时间(6.1 d)也远低于强毒株JS-2012(3.4 d)。这表明,PRV经一系列高温传代后,对小鼠的毒力明显减弱了。当强毒株JS-2012的UL46基因被传代毒株JS-2012-F120的UL46基因替换后,重组病毒vJS-2012-ΔUL46对小鼠的致死率依然为100%,但小鼠的平均死亡时间(3.6 d)低于强毒株JS-2012(3.4 d)。重组病毒株JS-2012-ΔUL46对小鼠的毒力介于强毒株JS-2012和传代毒株JS-2012-F120之间,这提示UL46基因移码突变使PRV对小鼠的毒力减弱了。小鼠对PRV的感染特别敏感,104.0TCID50/mL强毒株可以使小鼠在感染后第3~4 d全部死亡,同样剂量的重组病毒株vJS-2012-ΔUL46使小鼠在感染后第3~5 d死亡,其毒力更接近强毒株,而远强于传代毒株。这提示UL46移码突变对于传代毒株毒力减弱只是起到了次要的作用。

