骨髓间充质干细胞与内皮祖细胞对大鼠大部分肝切除合并缺血再灌注后损伤影响
雷振,林芷伊,于云宝,杨雄峰,郭炜,张宏伟,吴向未,彭心宇*
(1 石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832002;2 石河子大学医学院第一附属医院肿瘤科,新疆 石河子 832002)
肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是一种复杂的病理生理过程,也是引起术后早期肝功能不全或肝衰竭的主要原因,是肝脏外科手术、休克、创伤和器官移植或急性大量失血常见的并发症[1]。缺血再灌注损伤不但不能使组织器官功能得到恢复,反而加重组织器官的功能障碍及结构损伤,甚至直接影响到疾病的预后、手术的成功率以及病人的存活。HIRI的发生机制目前正处于积极的探究阶段,可能与氧化应激反应、细胞凋亡、炎症、钙通道超载等因素有关,但也有学者认为炎症反应是引起肝缺血再灌注损伤的关键因素[2-3]。如何对大部分肝切除合并肝脏缺血再灌注损伤进行修复,已成为广大肝脏外科医生迫切希望解决的问题。目前对肝脏缺血再灌注损伤的研究动物模型大部分局限于只建立肝脏缺血再灌注损伤动物模型,然而临床上肝缺血再灌注的同时常常伴有部分肝切除,所以建立肝缺血再灌注损伤后合并大部分肝切除模型更符合研究目的[4]。近几年来,国内外学者已提出间充质干细胞(mesenchymal stem cell,MSC)对 HIRI 具有治疗作用,但至于BM-MSCs治疗HIRI 的相关机制目前仍未完全阐明。BM-MSCs与BM-EPCs联合移植对肝缺血再灌注后合并大部分肝切除的肝功能水平及肝细胞凋亡情况目前亦尚未见相关报道。本研究拟通过建立大鼠肝缺血再灌注损伤联合大范围肝切除模型,并将两种细胞移植于模型体内,探讨BM-MSCs和BM-EPCs对大鼠肝缺血再灌注损伤联合大范围肝切除是否发挥保护作用,以及这两种细胞联合移植是否存在协同作用降低肝损伤。
1 材料与方法
1.1 实验动物及主要试剂
大鼠(SD)购自新医科大学动物饲养中心,选用12-14周龄雄性大鼠48只,造模大鼠体重为230-310 g。给予标准鼠料喂养、12 h昼夜节律、正常饮水、术前8~12 h 禁食、饲养在SPF级实验动物房(动物合格证号为SCXK(新)2016-0003)。细胞因子TNF-ɑ ELISA 试剂盒购自武汉博士德生物工程公司,TRYPLEEXPRESS购自Gibco公司,青链霉素、胎牛血清均购自Hyclong公司,0.1%GelatinSolution明胶、鼠尾胶原、枸橼酸钠均购自北京索莱宝生物公司。实验仪器:低速离心机(Bio-Rad公司)、超净工作台(Thermo公司)、荧光倒置显微镜、病理切片机(Leica公司)、冰箱(海尔公司)、盖玻片和载玻片(中国江苏世泰实验器材公司)。
1.2 细胞分离、培养及标记
鼠骨髓来源BM-MSCs和BM-EPCs的分离、培养及鉴定按本实验室前期的方法进行,将细胞培养至第3代备用。使用慢病毒感染GFP标记BM-MSCs,按照MOI为20的比例将第三代BM-MSCs消化并加入GFP慢病毒浓缩液进行细胞标记,同法使用慢病毒感染RFP标记BM-EPCs。
1.3 动物实验模型建立及分组
将48只雄性SD大鼠随机分为4组每组各12只,各组分别为:(1)缺血再灌注合并大部分肝切除组(HIRI):腹腔注射戊巴比妥麻醉后阻断第一肝门入肝血流25 min并行大部分肝切除术,再灌注后的第1天、第2天、第3天分别处死4只大鼠取肝组织及下腔静脉血。
(2)缺血再灌注合并大部分肝切除+BM-MSCs (HIRI+BM-MSCs)组:腹腔注射戊巴比妥麻醉后阻断第一肝门血流25 min并行大部分肝切除术,随之门静脉内注射200ulGFP标记的2×106BM-MSCs,再灌注余下操作同HIRI组。
(3)缺血再灌注合并大部分肝切除+BM-EPCs(HIRI+BM-EPCs)组,腹腔注射戊巴比妥麻醉后阻断第一肝门血流25 min并行大部分肝切除术,随之门静脉内注射200μLRFP标记的2×106BM-EPCs,再灌注余下操作同HIRI组。
(4)缺血再灌注合并大部分肝切除+BM-MSCs+BM-EPCs (HIRI+BM-MSCs+BM-EPCs)组:腹腔注射戊巴比妥麻醉后阻断第一肝门血流25 min并行大部分肝切除术,随之门静脉内注射200 μL GFP和RFP标记的2×106BM-MSCs+BM-EPCs(BM-MSCs∶BM-EPCs=1∶1),再灌注余下操作同HIRI组。所有动物实验前12 h禁食、自由饮水。
1.4 标本采集
再灌注1 d、2 d、3 d后各组大鼠分别行腹腔注射戊巴比妥麻醉并取下腔静脉血及肝组织,取标本后处死大鼠。将从下腔静脉内取出的2 mL血液标本放入试管,室温静置1 h后离心10 min(凯达水平离心机Td5z,由石河子大学医学院转化医学实验室提供,4 ℃,4000 r/min),将上清液取出注入离心管内,保存于-80 ℃冰箱中待测 ALT、AST、TNF-ɑ。取适量肝组织分别放入已标记好的标本瓶中,甲醛固定肝组织标本进行HE染色。部分肝组织立即行冰冻切片用于后续免疫荧光染色实验。部分肝组织置于-20 ℃冰箱保存用于后续肝脏的凋亡实验。
1.5 血液检测方法
(1)血清ALT、AST 检测:采用全自动生化分析仪测定(由石河子大学医学院附属医院检验科完成)。(2)血清TNF-ɑ检测:采用双抗体夹心ABC-ELISA 法测定。
1.6 标记细胞移植后的追踪
取术后第1天、第2天、第3天的肝组织立即行冰冻切片并用免疫荧光的方法观察GFP标记的BM-MSCs和RFP标记的BM-EPCs在肝内的分布及表达情况。
1.7 肝脏常规HE染色
取甲醛固定保存的肝组织标本,石蜡包埋切片HE染色,最后用普通光学显微镜观察各组肝脏组织病理学改变。并分别随机选取5个视野行病理学评分,评分标准为Suzuki法进行分类评分,其中由肝脏缺血再灌注损伤由3个参数组成:窦状充血、肝细胞细胞质空泡化、实质坏死。每个参数的数值分级如下∶充血∶0=无、1=轻微、2=轻度、3=中度、4=严重。同样的标准用于空泡化和坏死的分级如下∶0=无坏死细胞、1=单细胞坏死、2<30%坏死、3<60%坏死、4=>60%坏死[5]。
1.8 TUNEL法检测肝内细胞凋亡
按照凋亡试剂盒说明书进行操作,光镜下观察凋亡细胞呈棕黄色。每张切片在200倍镜下随机选择10个视野进行观察,计数凋亡指数(AI),AI=凋亡细胞个数/细胞总数×100%。
1.9 统计学方法
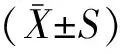
2 结果
2.1 BM-MSCs和BM-EPCs的分离及培养
BM-MSCs光镜下观察(图1)可见所提细胞贴壁生长,形态上表现为典型的纺锥形,BM-EPCs为典型的铺路石样改变。此外,结合光镜及鉴定结果可知所提细胞为高纯度间充质干细胞和内皮祖细胞(图1)。
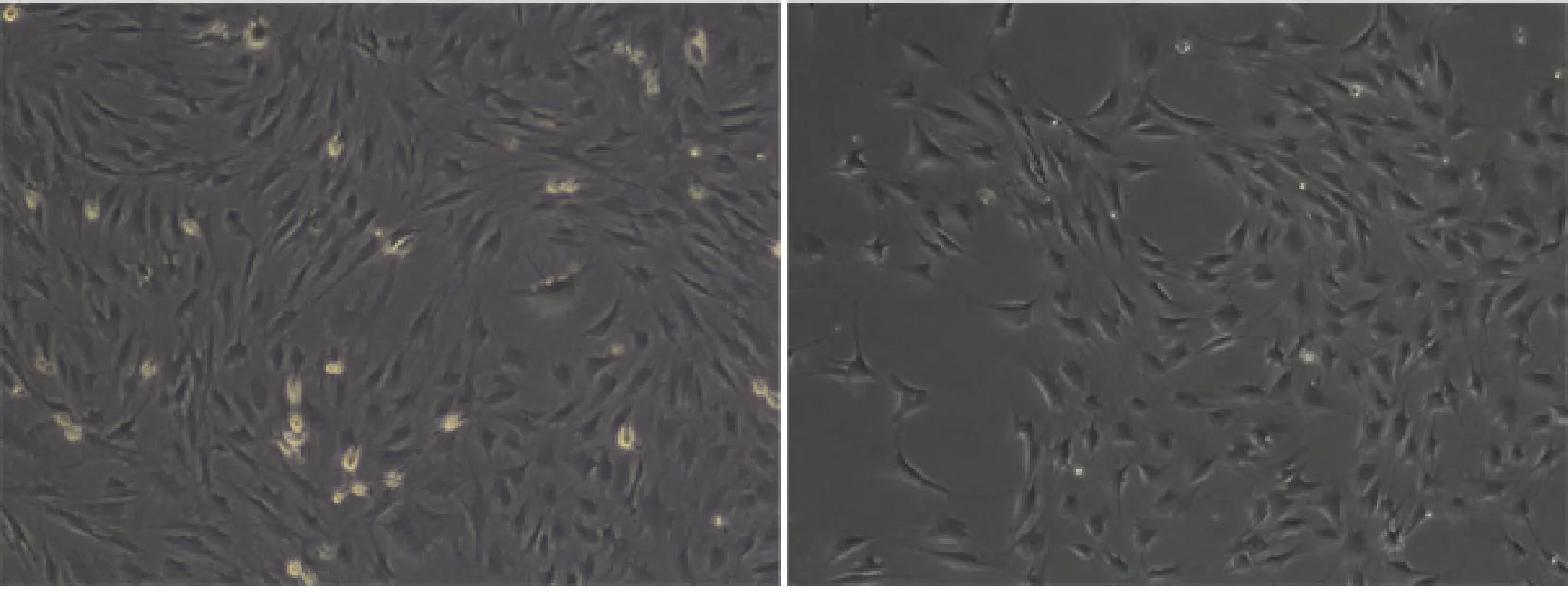
图1 间充质干细胞和内皮祖细胞 (×100)Fig.1 Mesenchymal stem cells and endothelial progenitor cells (×100)
2.2 细胞标记
BM-MSCs通过病毒转染标记GFP见图2a(标记前)、图2b(标记后)。BM-EPCs通过病毒转染标记RFP见图2c(标记前)、图2 d(标记后)。
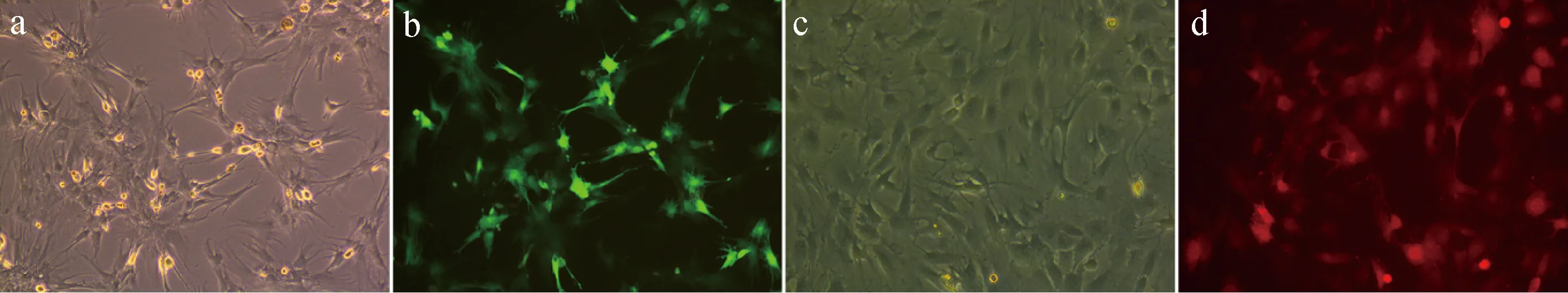
图2 慢病毒携带荧光蛋白转染细胞Fig.2 lentivirus carrying fluorescent protein transfected cells
2.3 急性肝缺血再灌注损伤合并大部分肝切除模型建立及观察
在本研究中我们提供了理想的动物模型,研究大部分肝切除术后的I/R损伤,在应用过程中避免了肠道充血,通过高选择性的夹紧肝中叶和肝左叶的门静脉肝动脉和胆管,造成70%肝缺血模型,再灌注后通过Pringle手法立即行肝脏左外叶、左侧叶、肝右叶、尾状叶、盘状乳突切除保留肝脏中间叶,以模拟临床肝移植术及大范围肝切除术,最后行门静脉注射移植被标记的干细胞(图3)。
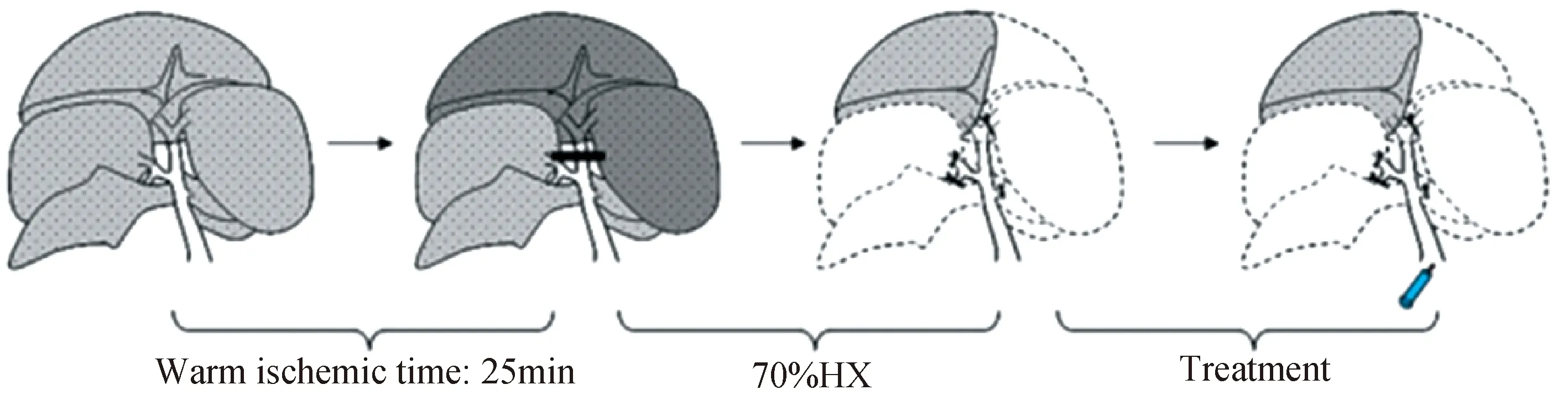
图3 SD大鼠70%肝缺血再灌注损伤模型、肝脏大范围切除和细胞门静脉移植操作示意图Fig.3 Schematic diagram of 70% hepatic ischemia-reperfusion injury model, extensive hepatectomy and cell portal vein transplantation in SD rats
具体手术步骤:(1)高选择性夹紧肝中叶的门静脉、肝动脉和胆管(图4a)。 (2)70%肝缺血模型(图4b)。 (3)再灌注后行肝脏左外叶、左侧叶、肝右叶、尾状叶、盘状乳突切除、保留肝脏中间叶(图4c)。(4)门静脉注射干细胞(图4 d)。最后逐层关腹并精心饲养模型大鼠。
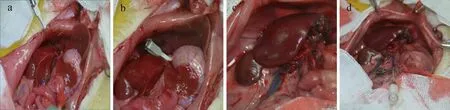
图4 SD大鼠70%肝缺血再灌注损伤模型、肝脏大范围切除和细胞门静脉移植实验Fig.4 70 % hepatic ischemia-reperfusion injury model, extensive hepatectomy and cell portal vein transplantation in SD rats
2.4 干细胞移植对大鼠生存状况的影响
与空白组相比,3组干细胞移植组大鼠毛发略凌乱,光泽度降低,精神尚可,活动量稍减少,对外界刺激反应较敏捷,切口愈合良好,无感染渗血等并发症,活动及食欲恢复良好,3 d存活率为90%。
2.5 干细胞移植对鼠HIRI后血清AST、ALT水平的影响
与对照组比较,BM-MSCs组、BM-EPCs组及BM-MSCs+BM-EPCs组在再灌注后第1天、第2天、第3天大鼠血清AST及ALT水平均明显降低(P<0.05),与BM-MSCs+BM-EPCs组相比较,BM-MSCs组与BM-EPCs组血清AST和ALT含量也显著降低(P<0.05),BM-MSCs组AST及ALT水平低于BM-EPCs组(P<0.05)。针对AST、ALT肝脏功能恢复情况,推测对于肝功能的保护作用BM-MSCs组优于BM-EPCs组,BM-EPCs组优于BM-MSCs+BM-EPCs组,BM-MSCs+BM-EPCs组优于空白组(图5a、5b)。
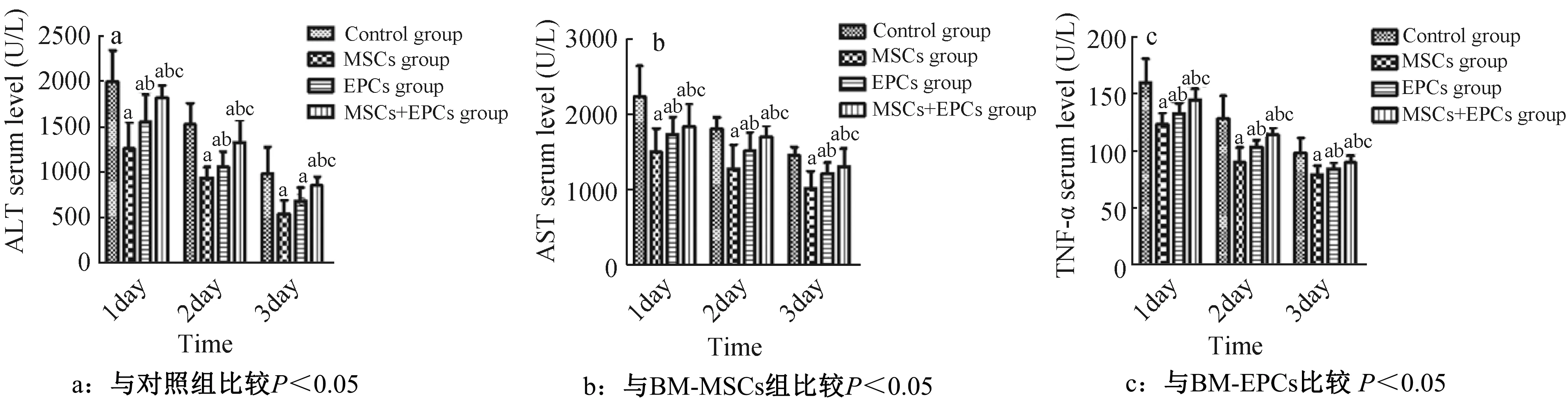
图5 不同时间段经鼠腔静脉取血测得血清ALT、AST、TNF-ɑ水平变化及各组间的比较Fig.5 changes of serum ALT, AST and TNF-ɑ levels measured by vena cava in rats at different time points and comparison among groups
2.6 干细胞移植对大鼠HIRI后血清炎症因子TNF-ɑ水平的影响
与对照组比较,BM-MSCs组、BM-EPCs组及BM-MSCs+BM-EPCs组在再灌注后第1天、第2天、第3天大鼠血清TNF-ɑ水平均明显降低(P<0.05),与BM-MSCs+BM-EPCs组相比较,BM-MSCs组和BM-EPCs组血清TNF-ɑ含量显著降低(P<0.05),BM-MSCs组TNF-ɑ水平也低于BM-EPCs组(P<0.05)(图5c)。
用转染成功的细胞分别经门静脉注射移植入到不同分组模型大鼠体内,取第3天的肝组织标本利用免疫荧光方法观察被移植的干细胞在损伤肝脏中的分布(图6)。
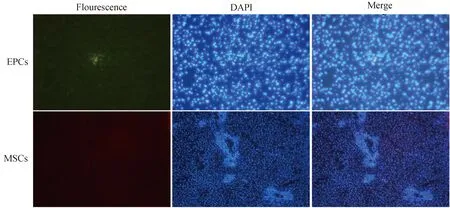
图6 免疫荧光方法观察到被移植的干细胞在损伤的肝内分布情况Fig.6 The distribution of transplanted stem cell in the injured liver was observed by immunofluorescence
2.7 HE染色观察大鼠肝脏病理学改变
细胞移植后第3天,HE染色在显微镜下观察可见对照组肝组织结构轮廓不清、肝细胞肿胀、变性坏死程度和范围大、出现大量的炎性细胞甚至在镜下难以看到完整的肝小叶结构。BM-MSCs组和BM-EPCs组镜下可见细胞索排列有序,肝组织结构破坏轻微,仅见部分肝细胞轻度肿胀坏死,肝窦间隙少量红细胞淤积,肝小叶的结构细胞形态尚可。BM-MSCs+BM-EPCs组肝细胞条索结构破坏,肝细胞的细胞核消失,胞浆均质化,细胞间隙增大,出现较多的炎性细胞,周围可见明显的坏死灶(图7)。
Suzuki法进行分类评分:与对照组比较,BM-MSCs组、BM-EPCs组及BM-MSCs+BM-EPCs组在细胞移植3 d后大鼠肝脏HE染色充血程度、空泡化及坏死明显减轻(P<0.05)。且与BM-MSCs+BM-EPCs组相比较,BM-MSCs组与BM-EPCs组肝细胞充血程度、空泡化及局部坏死也显著降低(P<0.05)(图8a)。
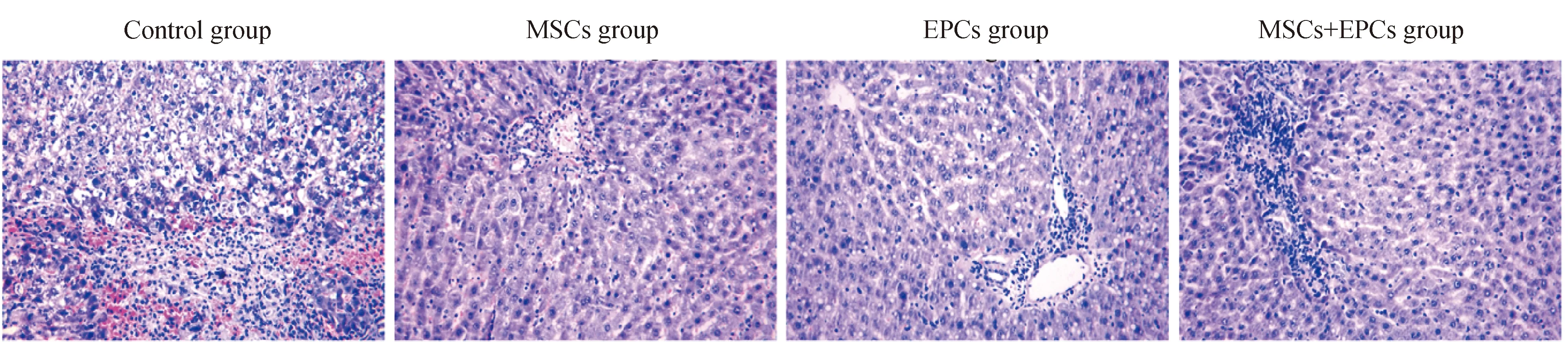
图7 各组大鼠肝脏病理组织学改变HE (×200)Fig.7 histopathological changes of liver in rats in each group HE (×200)
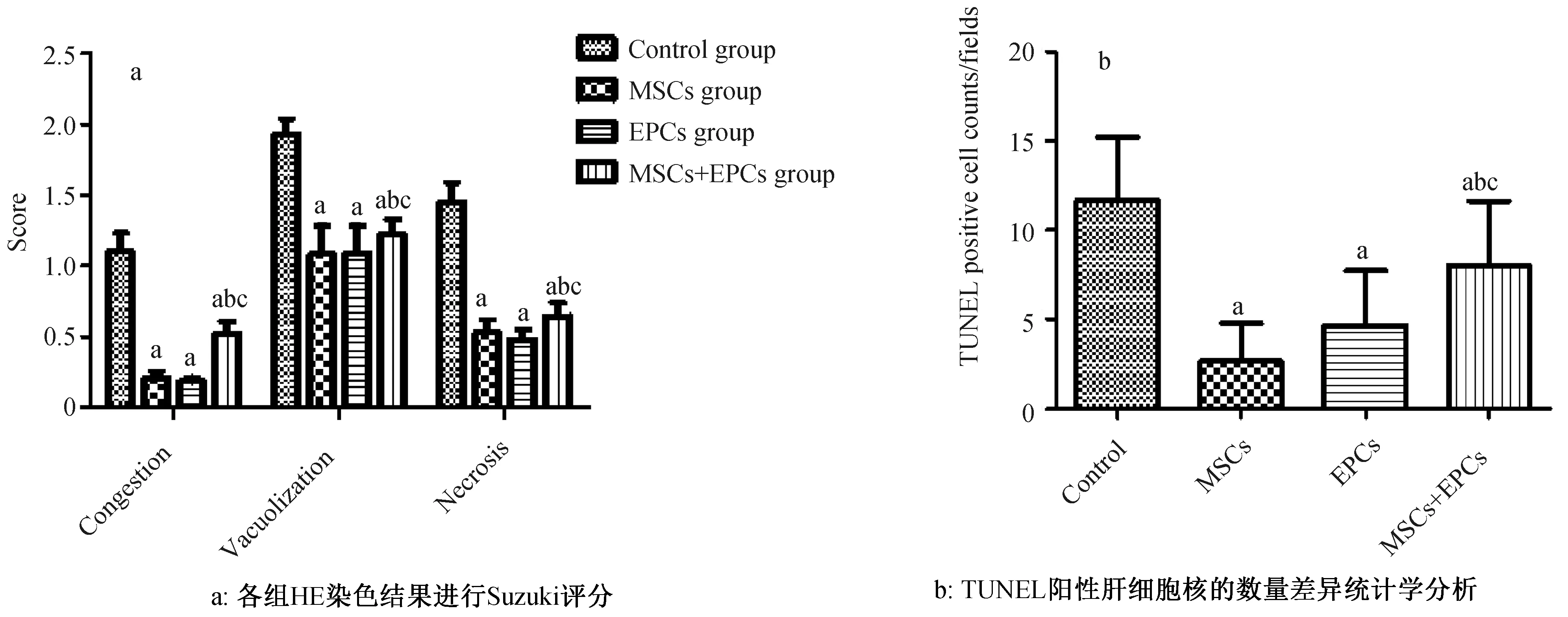
图8 各组HE染色评分及TUNEL法检测差异统计学分析Fig.8 HE staining score and TUNEL assay were statisticully analyzed
2.8 TUNEL检测各组大鼠肝组织细胞凋亡情况
与对照组比较移植3 d后BM-MSCs组、BM-EPCs组及BM-MSCs+BM-EPCs肝内细胞凋亡明显降低(P<0.05)。且与BM-MSCs+ BM-EPCs组相比较,BM-MSCs组与BM-EPCs肝内细胞凋亡程度明显降低(P<0.05)。BM-MSCs组肝内细胞凋亡水平也显著低于BM-EPCs组(P<0.05)(图8b、图9)。
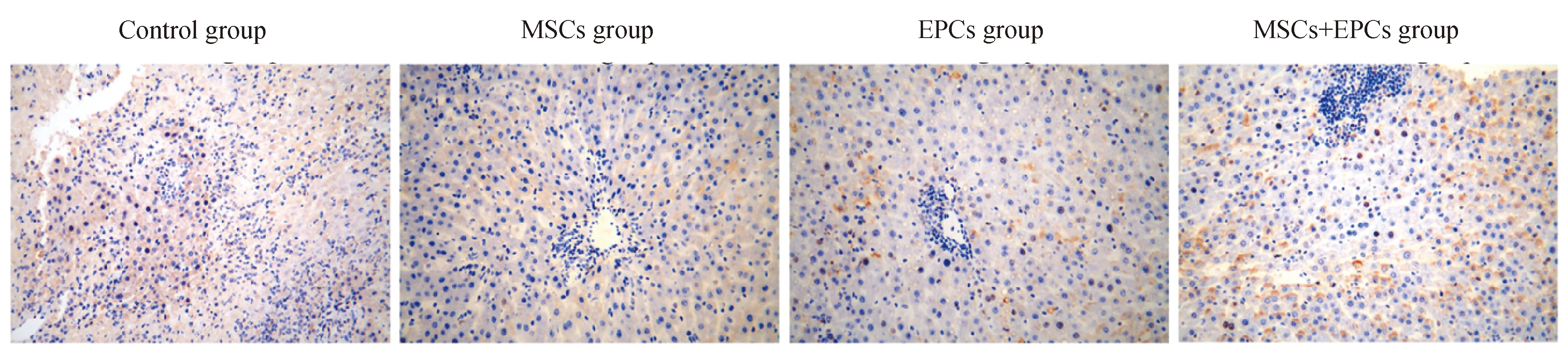
图9 TUNEL检测各组大鼠肝细胞凋亡情况Fig.9 TUNEL was used to detect the apaptosis of hepatocytes in each group of rats
3 讨论
HIRI是由缺血的组织或器官恢复血流灌注后导致的结构、功能及代谢的紊乱,其中是以肝损害为突出表现的全身炎症反应失调的过程。在大范围肝切除以及肝移植手术过程中常常伴有缺血再灌注损伤,很多病人因为考虑大范围肝切除后缺血再灌注损伤而丧失手术机会。但是到目前为止针对缺血再灌注损伤尚无完全有效的治疗方法。随着细胞分子生物学技术的发展,细胞移植治疗缺血再灌注损伤目前备受关注,通过干细胞移植治疗能否让这些的原本丧失手术时机的人再次获得手术机会挽救生命是本次实验目的。BM-MSCs具有分化潜力、增殖能力、低免疫源性、取材方便等特点,被广泛应用于器官损伤的治疗研究,同时BM-MSCs来源丰富,在合适的体外培养条件下迅速扩增、功能稳定,而且骨髓、脐带、脂肪等多种不同来源的 MSC均具有明显的实验效果[6-7]。另一种干细胞内皮祖细胞(Endothelial progenitor cells, EPCs)来源于中胚层,是一群主要存在于骨髓中具有内皮细胞特异性表面标志的细胞,拥有较强的增殖、自我更新和使缺血部位组织血管再生的能力。近年来,BM-MSCs和BM-EPCs移植已广泛应用于脑梗死、心肌梗死等动物模型使受损组织再生,国内外有研究表明BM-MSCs移植可以减轻肝缺血再灌注后肝功能的损伤程度。不过另一方面有学者表明动物实验中针对单一因素的干预治疗虽显现出一定的效果,但绝大多数临床作用有限或临床转化困难,我们之前的实验研究已经发现共培养BM-MSCs 和BM-EPCs可以相互促进增殖,有利于血管生成进而参与机体组织修复和再生[8],然而将BM-MSCs联合BM-EPCs移植对肝缺血再灌注后肝功能保护疗效尚不清楚,在实验前期本课题组查阅相关文献发现有关BM-MSCs和BM-EPCs 联合移植治疗HIRI研究报道罕见,本研究也是首次采用二种组织工程的种子细胞作为研究对象探讨治疗大部分肝切除合并肝缺血再灌注后肝脏损伤。
肝脏缺血再灌注损伤会导致肝脏一系列病理改变,包括肝组织充血、空泡化、细胞凋亡最终导致肝衰竭。在本研究中,我们采用大鼠大部分肝切除合并肝缺血再灌注损伤模型,此动物模型更加符合临床病理生理学改变,有利于后期向临床转化。目前有关大鼠骨髓间充质干细胞通过尾静脉移植修复肝缺血再灌注的研究较多见,这种移植操作简单、不需要手术、对设备仪器要求低,但存在肺栓塞、肺脏定植细胞较多等问题,同时有文献报道门静脉注射脂肪间充质干细胞治疗大鼠肝纤维化的效果要优于尾静脉注射[9],由于肝脏供血主要来自门静脉,课题组在制造肝缺血再灌注模型过程中充分暴露门静脉,为干细胞经门静脉移植治疗肝缺血再灌注损伤提供了便利的条件。此外BM-MSCs及BM-EPCs的大小和粘连潜力导致经尾静脉注射细胞进入体循环后,大部分被困在肺微血管系统中,无法检测到I/R损伤肝脏中的荧光标记,因此经过肺部再循环后BM-MSCs与BM-EPCs难以迁移到受I/ R伤害的肝脏,故与传统的移植途径相比,我们选取了经门静脉进行干细胞移植治疗肝缺血再灌注损伤。
在肺缺血再灌注损伤的治疗中,BM-MSCs通过减少肺内的炎症水平发挥其降低损伤的作用[10]。此外也有研究者将其应用于肾脏的缺血再灌注损伤,发现BM-MSCs可以降低肾脏内氧化应激水平从而缓解缺血再灌注损伤,以上研究说明BM-MSCs可以减轻器官的缺血再灌注损伤。ALT、AST活力可以作为肝细胞损伤的指标,ALT、AST的升高表明经肝缺血再灌注处理后大鼠肝细胞损伤严重,本实验中与对照组比较三个移植组肝细胞损伤程度明显降低,提示BM-MSCs和BM-EPCs可能对大鼠肝缺血再灌注后肝细胞产生保护作用。肝脏病理HE染色切片和三项病理评分显示:三个移植组肝细胞病变程度明显轻于对照组, 肝细胞坏死较少,脂肪变性和炎症程度明显减轻,与ALT、AST结果保持一致,张等研究发现在肝功能及组织学检查方面,间充质干细胞经门静脉移植治疗大鼠肝纤维化模型的效果优于对照组,表明间充质干细胞对肝缺血再灌注后损伤起到了保护作用,与此次研究结果一致[11-13]。另一方面与BM-MSCs组和BM-EPCs相比较,BM-MSCs+BM-EPCs组对肝功能保护作用较弱,根据Wu等研究表明在小鼠骨髓腔损伤模型中联合BM-MSCs+BM-EPCs移植组对小鼠骨髓腔修复能力优于单独移植组,骨髓血管重建需要BM-EPCs和BM-MSCs共同来实现,EPCs和MSCs相互间可能存在协同作用[14],然而本研究联合移植组对肝功能保护作用并非优于单独细胞移植组,我们认为造成这种差异的原因可能是这两种细胞配伍的比例、以及肝脏与骨髓腔解剖结构差异等原因所致。
目前已有许多研究应用干细胞移植对HIRI进行治疗已取得较好的治疗效果,但BM-MSCs与BM-EPCs对于HIRI的治疗机制目前仍未完全阐明[15]。有研究表明BM-MSCs发挥器官保护作用的机制多样,其调控炎症反应作用参与了肝缺血再灌注后肝细胞的修复[16-17],又研究表明BM-MSCs 在炎症环境内对于中性粒细胞的趋化募集具有一定的抑制作用[18-19],提示BM-MSCs可通过减少中性粒细胞在肝脏内的募集从而缓解肝脏缺血再灌注损伤。有学者指出TNF-ɑ对触发炎症反应起着非常重要的作用,其通过肝细胞表面受体诱导产生大量中性粒细胞趋化因子,活化NF-KB从而直接造成肝损伤[20-21],此外TNF-ɑ还可上调细胞间黏附分子1、血管细胞黏附分子1等黏附分子的表达,最后这些黏附分子聚集并激活中性粒细胞进入缺血后的肝脏损伤肝细胞。本实验中,对照组血清TNF-ɑ高水平表达,说明在缺血再灌注后肝脏内存在强烈的炎症反应,然而在三个细胞移植组中血清TNF-ɑ水平明显降低,说明 BM-MSCs和BM-EPCs可能通过减少血清TNF-ɑ水平发挥其抗缺血再灌注损伤的作用。
综上所述,单独细胞移植组与联合移植组均对肝脏大部分切除合并缺血再灌注损伤起保护作用。BM-MSCs和BM-EPCs可能通过降低血清TNF-ɑ表达抑制炎症反应从而在大部分肝切除合并肝缺血再灌注损伤后保护肝内细胞,但两种细胞联合移植对肝功能保护并未体现出协同作用,其原因及机制需要进一步研究,在后续的实验中我们将继续探究BM-MSCs和BM-EPCs对肝缺血再灌注损伤保护的具体信号传导及其确切作用机制。

