过量表达SlOPA3-like基因对烟草叶片叶绿体发育的影响
柏鸽,邵东南,刘丽娜,崔百明
(石河子大学生命科学学院,新疆 石河子 832003)
3型视神经萎缩(Opticatrophytype3,OPA3)[1],又被称为视神经萎缩综合征或3-甲基戊二酸尿症III型,是一种常染色体隐性神经眼病综合征[2],表现为早发性双侧视神经萎缩和晚期发育痉挛[3]。目前,已经报道了6个与OPA3相关的显性视神经有关的家族[4]。其中OPA3相关的3-甲基戊二酸尿症是由于位于19q13.2-13.3的OPA3基因突变引起的[3]。
3型视神经萎缩是由OPA3蛋白功能缺失导致的,动物的OPA3是核基因组编码的线粒体蛋白,定位于19号染色体上[5-6]。OPA3蛋白由3个外显子组成,通过外显子2和外显子2b的可变性剪接的方法,产生2个转录变体(OPA3V1,OPA3V2)[1]。其中外显子2的隐性突变与Costeff综合征相关,而外显子2的显性突变与常染色体显性视神经萎缩和白内障(ADOAC)相关。OPA3蛋白在线粒体内膜含量较高,并具有线粒体靶向信号[7]。OPA3亚型在过度表达和沉默的条件下会影响线粒体形态,在人视网膜上皮细胞(ARPE-19)中强制表达OPA3抑制了F-肌动蛋白的重排,诱导了线粒体片段化[8]。然而,这种蛋白质的确切功能和导致这些疾病的致病机制尚未明确。
OPA3的同源基因广泛存在于人、动物、真菌、和植物中[9-11]。植物OPA3同源基因的功能可能与动物OPA3不同,相关的报道极少。荧光蛋白标记实验表明,SlOPA3L蛋白可能定位于叶绿体,而不是线粒体中[12]。双分子荧光互补(bimolecular fluorescence complementation,BiFC)和酵母双杂实验结果表明SlOPA3L蛋白可能与马铃薯Y病毒(Potato virus Y,PVY)的辅助成分——蛋白酶(Helper component-proteinase,HC-pro)存在相互作用[11,13]。
本研究在前期获得SlOPA3L基因的基础上,构建了植物过量表达载体35S∶∶SlOPA3L并遗传转化烟草,转基因烟草的子叶表现出花叶状和组织失绿,表明SlOPA3L基因可能参与叶片的叶绿体发育和影响叶片细胞分裂。
1 材料与方法
1.1 研究材料
受体植物:普通烟草Nt (NicotianatabacumL.);表达载体:pBP35S。
1.2 实验方法
1.2.1 番茄OPA3-like过表达载体的构建
利用HindⅢ/EcoRI双酶切质粒pBI221和质粒pCAMBIA2300,通过凝胶电泳分别回收pBI221质粒上的GUS表达框片段和pCAMBIA2300质粒的骨架片段,将这2个片段过夜连接,得到植物表达载体pBp-35S。利用PCR的方法,在SlOPA3-like基因的ORF两端加上XbaI/SacI的酶切位点,得到的片段命名为eSlOPA3-like。然后用XbaI/SacI双酶切片段eSlOPA3-like和植物表达载体pBp-35S,通过凝胶电泳分别回收eSlOPA3-like的带酶切位点的片段和pBp-35S的骨架片段,将这2个片段过夜连接(替换载体上原有的GUS基因序列),即构建成SlOPA3-like基因的过量表达载体35S∶∶SlOPA3L。
1.2.2 烟草的转化及鉴定
通过电击转化的方法,将构建好的表达载体35S∶∶SlOPA3L转入农杆菌GV3101中。通过PCR扩增检测阳性克隆菌落,将阳性菌落保存干油管。将剪好的烟草叶片用含有表达载体35S∶∶SlOPA3L的农杆菌侵染转化。浸染后,在黑暗条件下共培养2 d,然后在含有50 mg/L卡那霉素的筛选培养基中光照培养。培养30 d后,掰取T1代烟草幼芽,通过PCR检测T1代转基因烟草。将检测为阳性的烟草幼苗移入土壤中,收取T2代烟草种子(T0代为野生型烟草,T1代为通过组织培养得到的烟草,T2代为T1代烟草自交、接出种子后种植长出的烟草)。
1.2.3 T2代转基因烟草植株的筛选
将T1代转基因烟草种子在1/2 MS培养基上进行播种,并利用培养基上的卡那霉素(50 mg/L)进行筛选,28 ℃,每天光照12 h,长出的幼苗为T2代烟草幼苗。30 d后,统计长有真叶(转基因)和不长真叶只长子叶(野生型)的幼苗的数量。
1.2.4 烟草组织观察
分别选取野生型和转基因型烟草真叶叶片,将烟草叶片夹在马铃薯块中间,徒手切片,用普通光学显微镜观察烟草叶片的横切面。
2 结果分析
2.1 烟草T2代转基因植株的获得
获得的T2代烟草幼苗由T1代自交产生,在获得的T2代转基因烟草株系中,L3有108株抗性植株,L4有40株抗性植株,L9有93株抗性植株,L18有85株抗性植株。L3、L4、L9和L18的转基因植株和非转基因植株分离比分别约为21.6∶1、6.6∶1、3.3∶1和2.6∶1(表1)。其中L9、L18分离比接近3∶1,L3分离比接近理论比例15∶1(表1)。说明L3染色体上可能是双插入位点,而L9与L18是单插入位点。
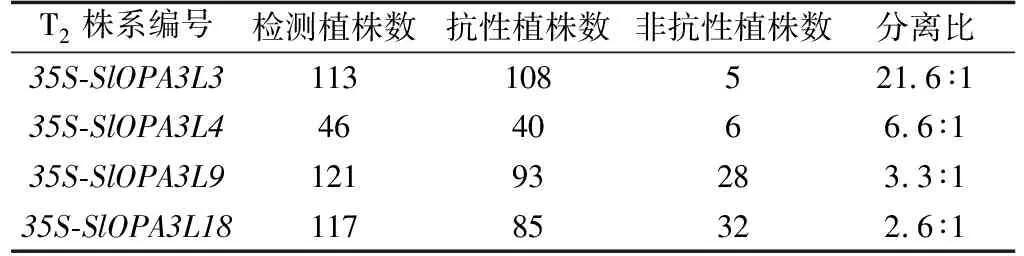
表1 烟草T2代转基因株系的分离情况统计Tab.1 Segregation statistics analysis of tobacco T2 transgenic lines
2.2 转基因烟草的子叶表型分析
T2代转基因烟草种子在1/2 MS培养基上培养15 d后进行表型观察分析。结果显示,过量表达SlOPA3L基因的转基因烟草植株的子叶上深绿与浅绿交错,呈花叶现象(图1B和1C)。野生型烟草子叶上完全为深绿色(图1 A)。转基因烟草与野生型植株的真叶颜色一致为深绿色(图1 A和1C)。结果表明,SlOPA3L基因参与植物子叶叶色的形成。
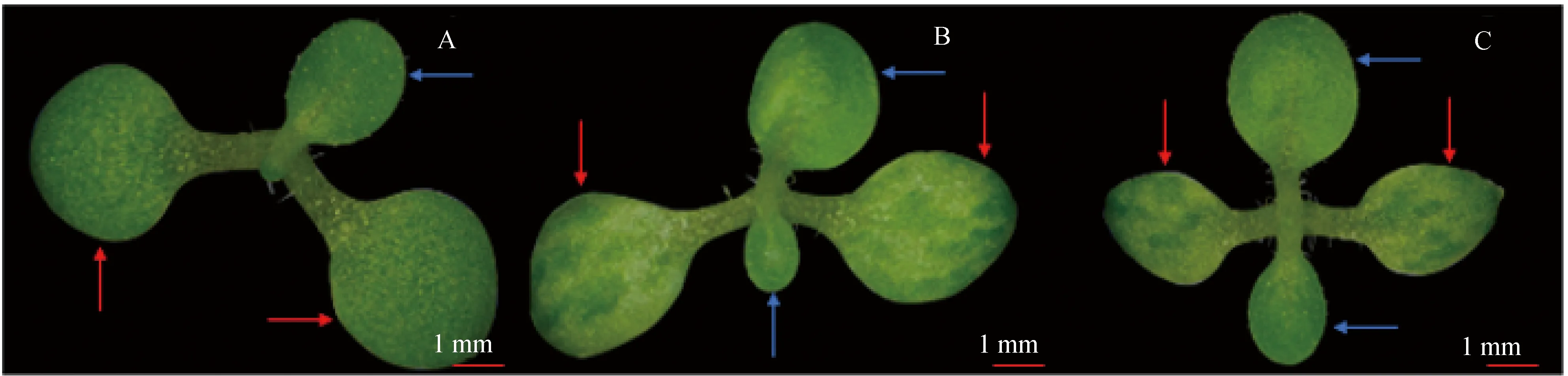
A—WT;B—35S∶∶SlOPA3L3;C—35S∶∶SlOPA3L9;红色箭头—烟草子叶;蓝色箭头—烟草真叶。图1 过表达35S∶∶SlOPA3L 基因的烟草表型分析Fig.1 Phenotype analysis of transgenic tobacco leaves overexpressing 35S∶∶SlOPA3L
2.3 转基因烟草子叶花叶现象统计分析
对转基因烟草植株的子叶花叶现象进行统计发现,在L3、L4、L9和L18中拥花叶现象的植株占转基因植株总数的百分比分别为:83.3%、97.5%、96.6%和95.5%(表2)。与L4、L9和L18相比,L3出现花叶表型的植株少,可能由于在烟草子叶的生长的过程中,花叶现象恢复为正常颜色(表2)。表2的数据表明,烟草子叶花叶在大多数植株中出现,不是单一现象。初步猜测SlOPA3-like基因可能对子叶时期的叶绿体合成与降解有关。
2.4 转基因烟草真叶表型分析
将筛选获得的100株转基因烟草幼苗移植到土壤里,培养30 d后发现:其中1个株系(L3)的真叶上也出现了深绿与浅绿交错的花叶现象(图2B),且表面凹凸不平。继续培养15 d后,该植株的新生叶片与野生型叶片颜色一致,没有花叶现象(图2C)。这种现象的出现可能与烟草L3植株的染色体为双插入位点、导致了SlOPA3L基因的表达量有关。
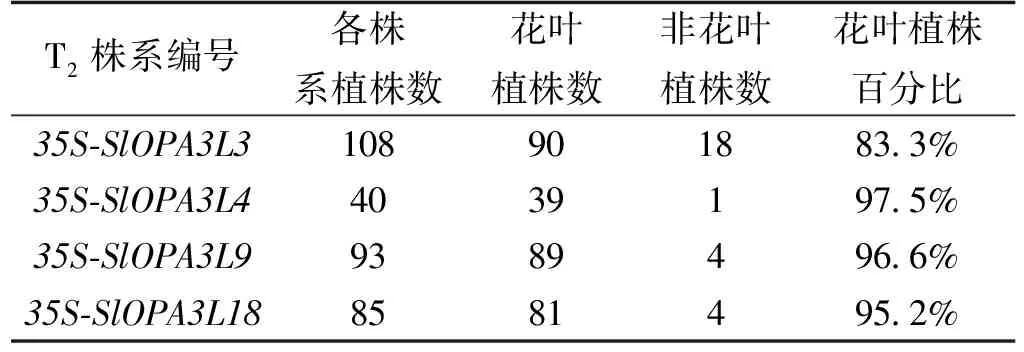
表2 子叶花叶表型统计分析Tab.2 Statistics analysis of cotyledon mosaic phenotype

A—WT;B—35S∶∶SlOPA3L3;C—35S∶∶SlOPA3L3恢复型。图2 转基因烟草真叶表型分析Fig.2 The true leaf phenotype of transgenic tobacco was analyzed
2.5 烟草真叶横截面的显微观察
转基因烟草T2代植株中,有极少数烟草真叶出现花叶现象,但在培养后期新长出的真叶又恢复为正常的深绿色。为了进一步探究真叶花叶现象形成的原因,通过光学显微镜对野生型烟草、有花叶现象的转基因烟草和无花叶现象的转基因烟草叶片的横截面进行观察分析。结果发现:野生型烟草的叶片组织中拥有完整的海绵组织和栅栏组织(图3A),无花叶现象的转基因烟草栅栏组织明显,海绵组织部分缺失(图3B),有花叶现象的转基因烟草的海绵组织和栅栏组织模糊、细胞较少(图3C)。结果表明:SlOPA3L基因影响烟草叶片细胞的发育。

A—野生型烟草;B—转基因烟草(无花叶现象烟草叶片);C—转基因烟草(有花叶现象烟草叶片)。图3 烟草真叶叶片细胞形态分析Fig.3 Morphology analysis of tobacco leaf cells
3 讨论
Pei等[8]发现斑马鱼OPA3 mRNA在视神经和视网膜层中表达,并证明了OPA3功能的系统发育保守性[7]。OPA3蛋白包含特定的线粒体前导序列,线粒体分选信号和过氧化物酶体分选信号,发现其绿色荧光蛋白标记的OPA3表达定位主要是在线粒体。进一步研究[14]发现,OPA3被鉴定为线粒体外膜(mitochondrial outer membrane,MOM)的整合蛋白,过表达的OPA3基因可以诱导线粒体断裂,并在调节线粒体动力学和对凋亡细胞死亡中具有重要作用[15-16]。
在植物中,通过动物OPA3的氨基酸序列和植物OPA3-like氨基酸对比[12]发现,植物OPA3L氨基酸与动物OPA3氨基酸的线粒体定位序列差异较大。通过在线工具预测[12]发现SlOPA3L作为一个不稳定蛋白,分析其定位在叶绿体上。通过SlOPA3L蛋白的亚细胞定位实验[17]发现,该蛋白在烟草表皮细胞中定位于叶绿体。因此,我们推测SlOPA3L基因功能可能与叶绿体有关。
本研究通过对SlOPA3L基因的过量表达实验发现,T2代转基因烟草子叶上出现了花叶现象。这种花叶现象体现在子叶颜色的变化方面。这种颜色变化可能与叶绿体的发育有关。在自然条件下,种子萌发首先要经历土壤中的黄化时期和出土后的去黄化时期,子叶、叶鞘和真叶细胞中的无色的原质体(Proplastids)相继分化为叶绿体[18]。在无光照的土壤中,前质体发育会停止在黄色质体(Etioplast)阶段或者转向另一种通路,直至光照开始时才会发育成叶绿体[19]。黄色质体是黄色的,包含有层状体(prolamellar body,PLB)、叶绿素前体(protochlorophyllide,Pchlide)和类胡萝卜素,无叶绿素分子[20-21]。在退黄化过程中,光会启动黄色质体叶绿体(Etio-chloroplast)分化为叶绿体的程序,类囊体膜与光合复合物(light -harvesting complex,LHC)单独形成,LHC蛋白调节叶绿体发育[22]。同时,Pchlide会产生活性氧(ROS),正在发育的幼苗会通过原叶绿素氧化还原酶(PORs)的作用获得光合能力,PORs将Pchlide转化为叶绿素,减少ROS产生,防止诱导细胞损伤和叶绿素漂白[23]。如果过量表达SlOPA3L基因对叶绿体发育过程有影响,包括原质体的分化、Pchlide与类胡萝卜素的合成、去黄化反应的调控等,均可能产生子叶花叶现象[24]。
花叶现象大多在转基因烟草子叶时期出现,少数出现在烟草真叶上,我们对花叶现象的真叶进行细胞形态观察发现,真叶花叶表面凹凸不平,其海绵组织和栅栏组织模糊、细胞较少。我们猜测这种现象的产生可能与植物的程序性细胞死亡(Programmed cell death,PCD)有关[25-26]。在PCD过程中,线粒体和叶绿体可以协同执行PCD的2种工作模型:线粒体启动委托步骤并招募叶绿体用于快速执行,或者线粒体和叶绿体一起运行[27]。根据对SlOPA3L蛋白在烟草表皮细胞中定位于叶绿体[23],该现象可能是叶绿体缺陷导致的细胞死亡。通过光学显微镜观察发现,有花叶现象的转基因烟草叶片的栅栏组织与海绵组织大面积缺失,发育不完全。这种现象的产生可能是由于烟草早期叶片发育不完全所致。表明SlOPA3L基因可能调控烟草细胞早期发育阶段,直接或间接影响细胞的分裂或细胞的凋亡与衰老。
在酵母双杂实验中,以PVY的HC-pro作为诱饵载体,在番茄cDNA文库中筛选出SlOPA3L蛋白[13,23],利用BiFC实验证明SlOPA3L蛋白与HC-Pro在洋葱表皮互作[11]。叶绿体分裂的第1步是形成FtsZ环(Z环),Z环的位置由细菌和植物中的Min系统协调确定的[28]。HC-pro和NtMinD之间的相互作用干扰了NtMinD在叶绿体分裂中的功能,并导致PVY感染植物后形成异常的叶绿体[29]。在病毒感染的过程中,植物会产生超敏反应(hypersensitive response,HR)[30]。所以推测SlOPA3L基因可能与HC-pro导致的超敏反应有关,或者说与叶绿体分裂有关。
综上所述,在烟草植株中过量表达SlOPA3L基因,转基因烟草出现子叶花叶现象,表明OPA3L基因可能会影响叶绿体发育、叶绿素的合成过程。SlOPA3L基因也可能影响烟草的细胞发育、凋亡及衰老。其具体机制及影响还需要进一步的探究。

