陆地棉热激转录因子GhHSFA6b的表达分析及亚细胞定位
李执朴,李鸿彬
(石河子大学生命科学学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832003)
植物在漫长的进化过程中形成了相应的分子机制来应对各种胁迫,以减少生物胁迫及非生物胁迫对于植物生长发育的不利影响[1-4]。在非生物胁迫中,热激胁迫是影响陆生植物生长、产量和分布的主要因素之一[5],其可降低植物光合效率、提高蒸腾速率、损害细胞功能甚至导致植物死亡。植物热激转录因子(Heat shock transcription factor,HSF)广泛存在于各种植物中的抵御逆境胁迫和逆境胁迫信号转导途径中[6]。HSF可与下游靶基因启动子区域的热激响应元件(Heat responsive element,HSE)结合从而直接调控下游靶基因的表达,进而启动热激反应。因此,HSF成为生物体在热激胁迫和其他逆境胁迫下基因转录激活及信号转导途径中的重要调节因子,在逆境信号转导及提高植物抗逆性方面发挥重要的调控作用[2,7-8]。
根据结构的不同,植物HSF可分为A、B和C 3类[9]。其主要包含以下结构域:①DNA结合域(DNA binding domain,DBD),集中在HSF的N端,是一段高度保守的区域,可特异性的识别并结合高度保守的热激响应元件HSE的保守基序;②寡聚结构(Oligomerization domain,OD),由2个疏水七肽重复区域HR-A/B构成[10],植物遭受热激胁迫时,HSF可通过HR-A/B构成的卷曲螺旋结构形成同源三聚体,促使HSF与下游靶基因启动子上的HSE结合;③核定位信号(Nuclear localization signal,NLS)和核输出信号(Nuclear export signal,NES),NLS由一簇碱性氨基酸组成,它与HSF亚细胞定位和进出细胞核有关,而NLS与NES协同作用可控制HSF在细胞核及细胞质中的自由分布[11];④C端转录激活结构域(C-transcriptional activation domain,CTD),CTD结构域是HSF序列上最不保守的区域,含有短肽AHA(aromatics,hydrophobic and acidic amino acid residues)基序。AHA基序是HSF转录活动所必需的条件,只有A类HSF含有AHA结构,因此,通常认为B、C两类HSF不具有转录激活功能[12]。
棉花是全球性的重要经济作物之一,也是全球主要的农产品和纺织原料之一,是关系国计民生的重要物资,在国民经济中占有十分重要的地位[13]。近年来,随着全球变暖加剧,我国西北地区也经历着同样的变暖趋势,尤其是作为棉花主要种植区的新疆,棉花生长发育面临巨大挑战。目前,关于棉花GhHSFA6b基因的研究鲜有报道。本研究通过分析棉花GhHSFA6b基因在热激与氧化胁迫及棉花纤维发育时期的表达特征、对GhHSFA6b进行亚细胞定位及蛋白的体外原核表达,为深入探索GhHSFA6b参与棉花发育的功能及其响应热激的机理奠定基础。
1 材料与方法
1.1 材料
陆地棉徐州142以及野生型本氏烟草种子由本实验室提供。以栽培于石河子大学试验田的陆地棉徐州142为材料,采取开花后0、5、10、15、20、25和30 d的棉桃,剥取纤维和胚珠存于-80 ℃备用。大肠杆菌DH5α、根癌农杆菌GV3101、植物表达载体pCAMBIA2300-eGFP、pET32a为本实验室保存。多糖多酚植物总RNA提取试剂盒、DNA分子量标准、蛋白质分子量标准购买于天根公司。pMD19-T克隆载体,EcoR I、XhoI、KpnI、XbaI等限制性内切酶,T4DNA连接酶,RNA反转录试剂盒购买于大连宝生物公司。氨苄青霉素、庆大霉素、卡那霉素和利福平等均购于北京索莱宝公司,其余相关试剂均为国产分析纯。
1.2 方法
1.2.1 GhHSFA6b氨基酸序列比对及保守结构域分析
选择陆地棉(Gossypiumhirsutum)、杨树(Populustrichocarpa)、榴莲(Duriozibethinus)、麻风树(Jatrophacurcas)和柑桔(Citrusclementina)的HSFA6b序列,利用BioEdit软件进行多重比对分析,使用EXPASY在线软件进行 (http://www.expasy.org/tools)保守结构域分析。
1.2.2 热激处理棉花幼苗
选取在实验室培养箱(28 ℃,16 h光照/8 h黑暗)中正常生长6周左右的棉花幼苗,分别用42 ℃和1 mmol/L H2O2进行处理,分别在0、1、2、4 h收取处理过的棉花幼苗叶片,液氮速冻,存于-80 ℃待用。
1.2.3 RNA提取与cDNA的合成
利用多糖多酚植物总RNA提取试剂盒根据其说明书提取上述收集的棉花组织的总RNA。1.0%琼脂糖凝胶电泳检测其完整性并测定RNA浓度。取约2 μg RNA进行反转录,参照RNA反转录试剂盒说明书进行反转录合成cDNA作为基因克隆的模板。
1.2.4GhHSFA6b基因的表达分析
以获得的cDNA为模板,GhUBQ7(序列登录号:DQ116441.1)为内参基因,利用荧光实时定量PCR技术检测GhHSFA6b基因在热激与过氧化氢处理下及棉花纤维发育时期的表达情况,引物由生工生物工程(上海)股份有限公司合成,序列如表1所示。

表1 本研究中使用的基因引物序列Tab.1 Primers used in this study
1.2.5GhHSFA6b基因扩增与原核表达载体pET32a-GhHSFA6b的构建
按照表1中设计的引物,以上述得到cDNA为模板进行PCR扩增,回收PCR产物,经连接、转化和测序鉴定后,选测序正确的克隆提取质粒与pET32a空质粒分别用EcoR I、XhoI进行双酶切,回收目的片段进行连接并转化大肠杆菌DH5α。经菌液PCR和双酶切鉴定后,将鉴定正确的pET32a-GhHSFA6b质粒和pET32a空质粒分别转化到大肠杆菌BL21(DE3)中。
1.2.6 GhHSFA6b蛋白的原核表达
将含有重组质粒pET32a-GhHSFA6b和pET32a空质粒的大肠杆菌BL21(DE3)进行扩大培养,当OD600约为0.6左右时,各取1 mL菌液作为对照记为0 h,加入IPTG至终浓度为1 mmol/L,继续振荡培养6 h。分别在2、4、6 h收取菌液10 mL,5000 r/min离心8 min后收集沉淀,分别添加1 mL经4 ℃预冷的1×PBS缓冲液充分悬浮,然后向悬浮液中加入1 mL 5×SDS缓冲液,混匀后100 ℃水浴8 min,12000 r/min离心5 min。取上清15、5 μL 4×蛋白上样缓冲液充分混匀后进行SDS-PAGE电泳检测(5%积层胶,12%分离胶)。
1.2.7GhHSFA6b-GFP瞬时表达载体的构建及转化
根据表1中设计的引物,以合成的cDNA为模板扩增GhHSFA6b,回收PCR产物经连接、转化和测序鉴定后,选测序正确的菌液提取质粒与pCAMBIA2300-GFP空质粒分别进行双酶切并回收目的片段和载体大片段,连接并转化至大肠杆菌DH5α中。经菌液PCR和双酶切鉴定后,将鉴定正确的阳性克隆质粒转化到GV3101中。挑取阳性克隆进行菌液PCR鉴定,将鉴定正确的菌液培养至OD600约为0.8左右,6000 r/min离心5 min后收集沉淀。用含10 mmol/L MgCl2、100 μmol/L AS、10 mol/L ES的MS液体培养基充分悬浮制成侵染液后室温避光静置2~5 h。选生长状况良好的本氏烟草,将侵染液注射在本氏烟草叶片背面并做好标记。转化完成后制作临时装片并用激光共聚焦显微镜检测其荧光。
2 结果与分析
2.1 GhHSFA6b氨基酸序列比对及保守结构域分析
棉花GhHSFA6b蛋白具有A类HSF的典型结构:靠近N端的DBD结构域,两段疏水氨基酸残基HR-A和HR-B构成的OD结构域,核定位信号NLS,核输出信号NES及靠近C端最不保守的AHA模序(图1)。
2.2 GhHSFA6b基因响应热激和氧化胁迫的表达分析
利用实时荧光定量PCR(qRT-PCR),以GhUBQ7基因作为内参,分析GhHSFA6b基因在热激与过氧化氢处理下的表达情况。结果如图2所示,GhHSFA6b基因经热激和过氧化氢处理后表达量显著增加,表明GhHSFA6b基因的表达明显受热激与过氧化氢的诱导,暗示GhHSFA6b基因可能在逆境胁迫响应信号转导与抵抗逆境胁迫过程中发挥重要的作用。
2.3 GhHSFA6b基因参与棉花纤维发育的表达分析
为研究GhHSFA6b基因在棉花纤维发育过程中的功能,利用qRT-PCR技术,以GhUBQ7基因作为内参,分析纤维发育不同时期GhHSFA6b基因表达量的变化。如图3所示,GhHSFA6b基因在纤维发育起始时期(开花当天)的胚珠中、以及纤维发育次生壁加厚时期(开花后25和30天)的纤维中的表达量显著增加,表明GhHSFA6b可能在棉花纤维发育过程中发挥重要作用。
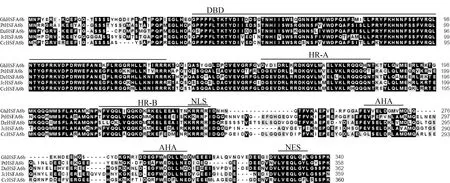
图1 GhHSFA6b序列比对与保守结构域分析Fig.1 Multiple sequence alignment and conserved domain analysis of GhHSFA6b and other proteins
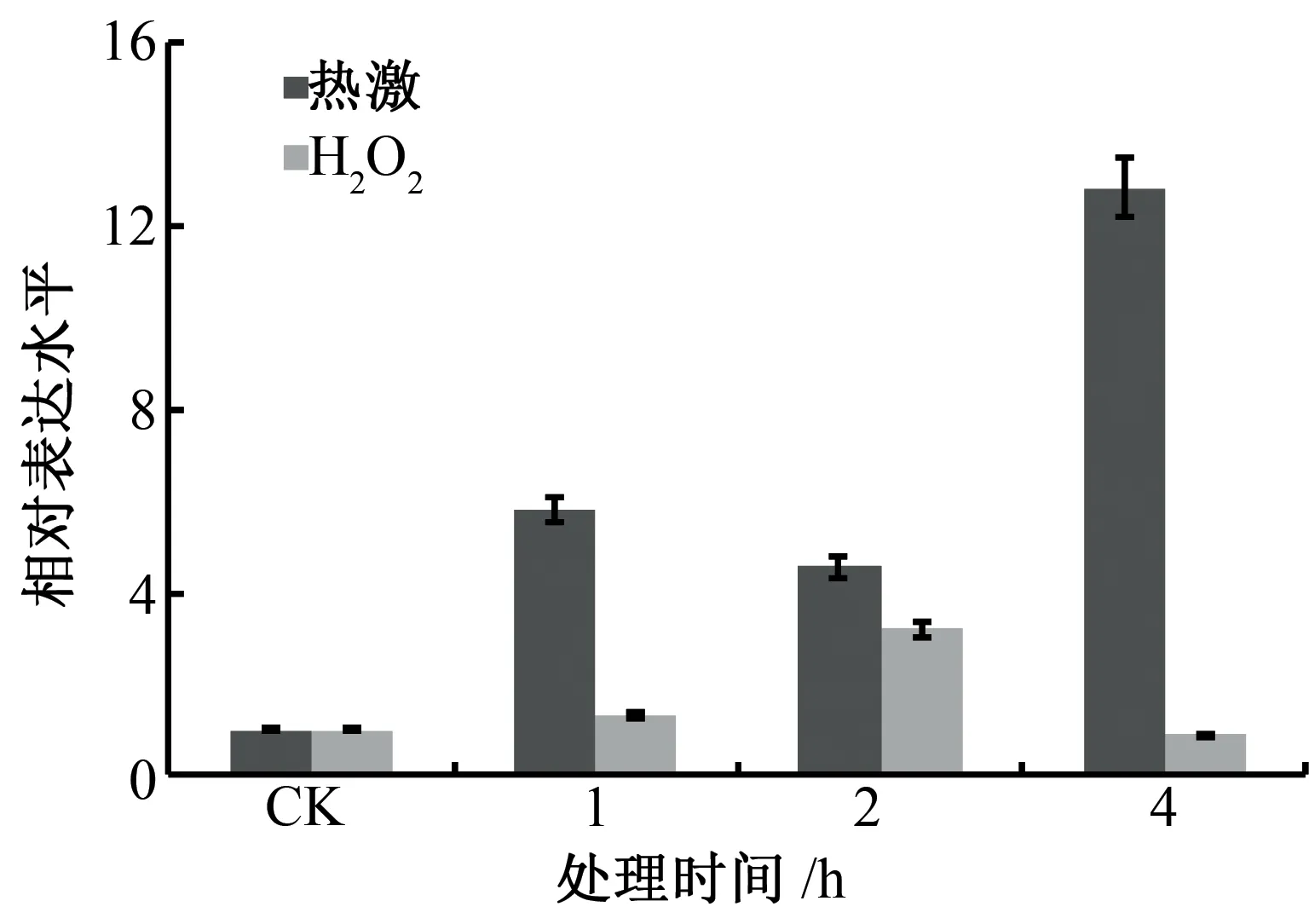
图2 GhHSFA6b基因响应热激和氧化胁迫的表达分析Fig.2 Expression analysis of GhHSFA6b gene in response to heart shock and oxidative stress
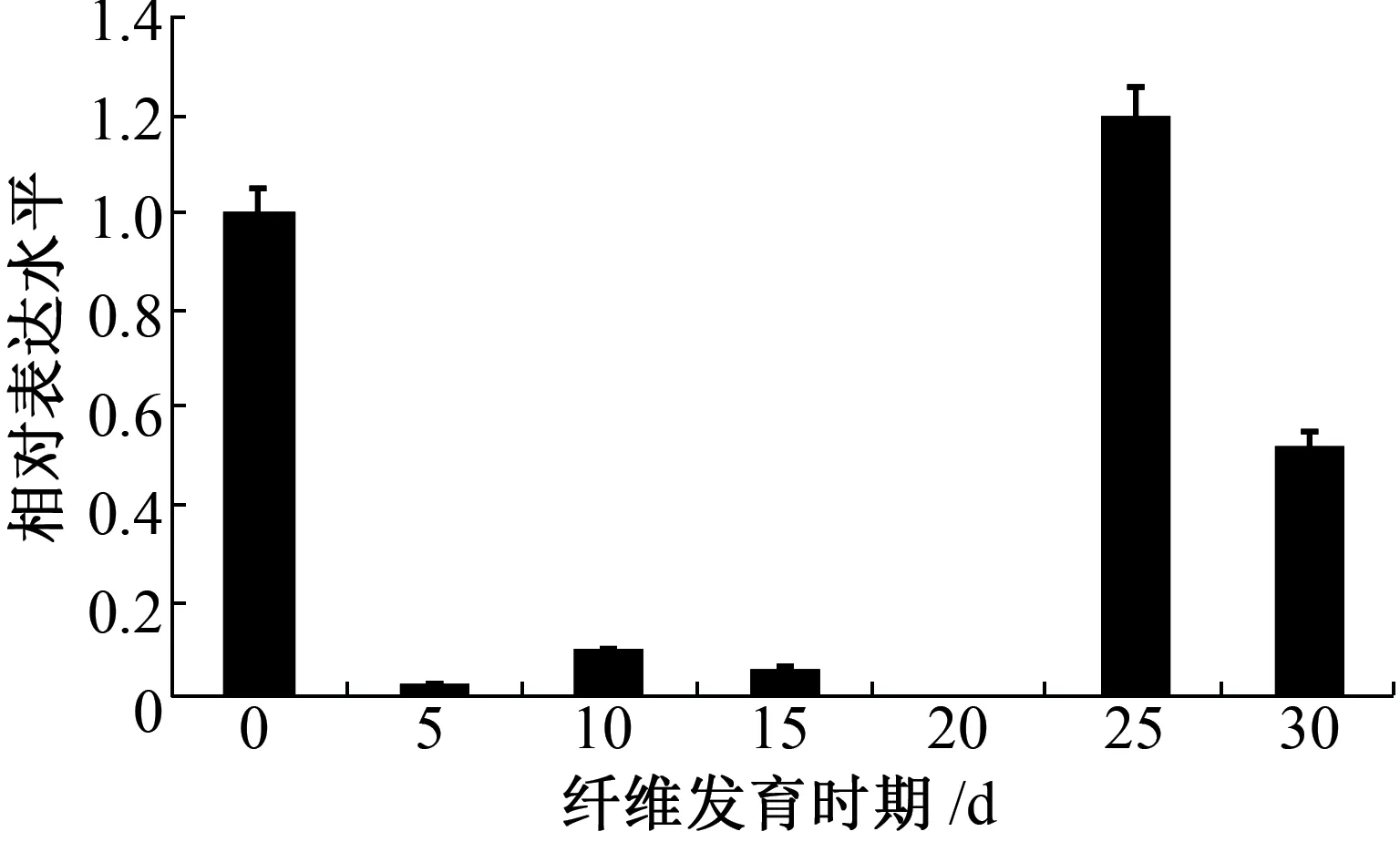
图3 GhHSFA6b基因参与棉花纤维发育的表达分析Fig.3 Expression analysis of GhHSFA6b involving in cotton fiber development
2.4 GhHSFA6b重组蛋白的诱导表达
将构建正确的pET32a-GhHSFA6b原核表达载体和pET32a空载体分别转化大肠杆菌,用终浓度为1 mmol/L的IPTG进行诱导表达。如图4所示,含有pET32a载体的菌液在诱导前后均中未发现重组蛋白的表达,在含有pET32a-GhHSFA6b重组载体的菌液中产生了重组蛋白,相对分子量大小约为62×103,该重组蛋白的累积随着诱导时间的延长而显著增加。
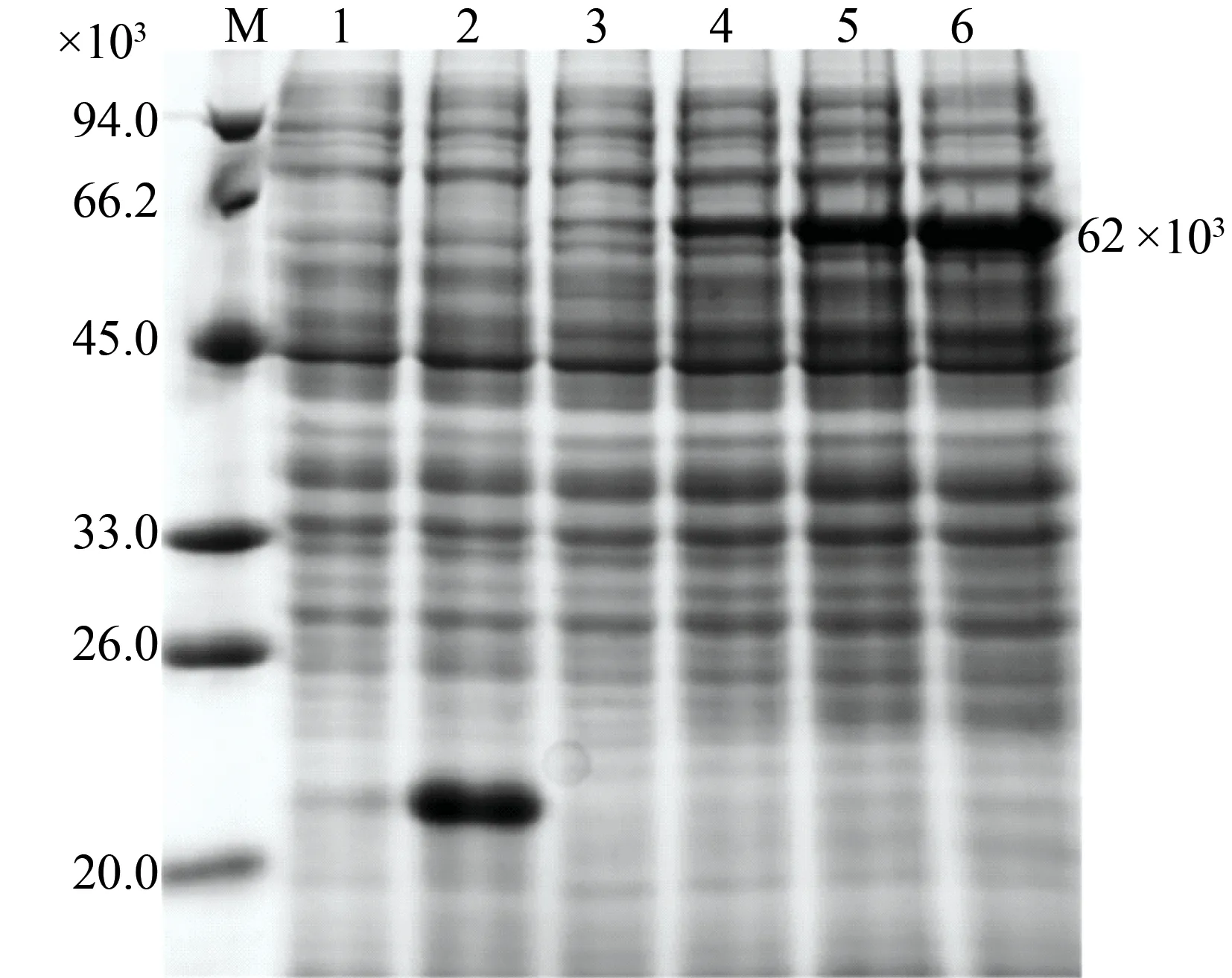
M—标准蛋白;1—pET32a空质粒对照;2—pET32a空质粒对照(IPTG诱导2 h);3—IPTG诱导0 h后的重组蛋白;4—IPTG诱导2 h后的重组蛋白;5—IPTG诱导4 h后的重组蛋白;6—IPTG诱导6 h后的重组蛋白。图4 重组蛋白pET32a-GhHSFA6b诱导表达与SDS-PAGE分析Fig.4 Induced expression and SDS-PAGE analysis of recombinant pET32a-GhHSFA6b
2.5 GhHSFA6b的亚细胞定位分析
将构建的GhHSFA6b-GFP表达载体瞬时转化烟草叶片,在激光共聚焦显微镜下检测荧光信号。结果如图5所示,在细胞核和质膜中均检测到较强的绿色荧光,表明棉花GhHSFA6b主要定位在细胞核中和质膜。
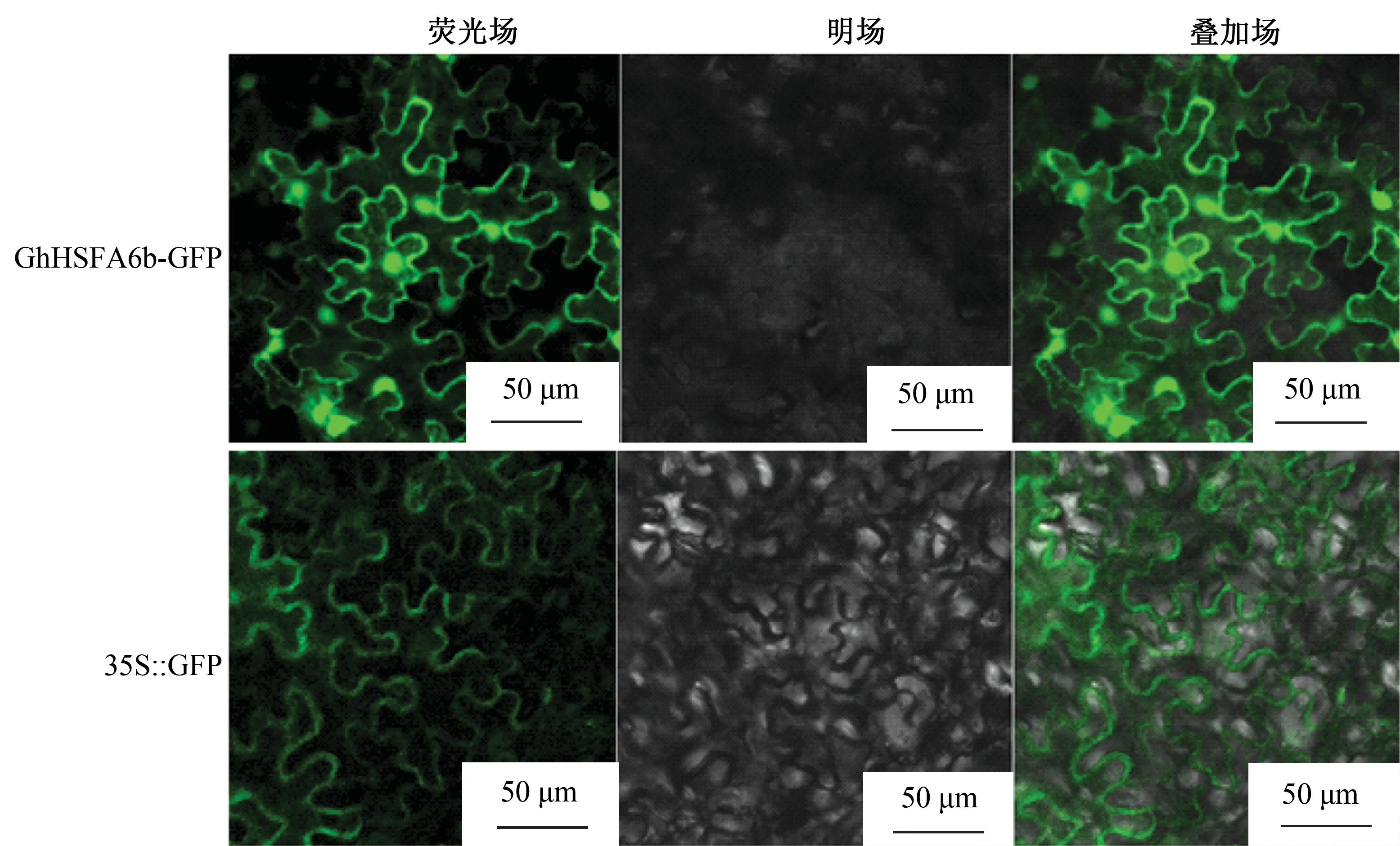
图5 GhHSFA6b亚细胞定位分析Fig.5 Analysis of subcellular localization of GhHSFA6b
3 讨论
棉花HSFA6b属于典型的A类HSF,具有典型的保守结构域(图1),其特殊的蛋白结构与功能密不可分,N端的DBD负责识别并结合HSE,HR-A/B与逆境胁迫下形成有活性的同源三聚体有关,NLS与NES负责调控其在细胞核内的进出,AHA模序与转录激活有关。热激转录因子作为调控热激响应的关键因子在植物中被广泛研究和关注[4-6,14-17]。在模式植物拟南芥中,AtHsfA1a被证实在逆境响应中发挥重要的调控作用[18-19];拟南芥AtHSFA1e可在高温胁迫下通过三聚化、核转位以及磷酸化等方式被激活,与AtHSFA2中5'端的热激响应元件结合并诱导AtHSFA2等下游转录因子的表达进而调控植物的抗逆性[20]。本研究分析了棉花GhHSFA6b基因在热激和氧化胁迫处理下的表达特征,其在胁迫处理后表达量显著提高(图2),表明GhHSFA6b可能在逆境胁迫响应及信号转导过程中发挥重要的作用。
棉花纤维发育经历原始纤维起始、纤维伸长、次生壁加厚和脱水成熟4个阶段,GhHSFA6b基因在棉花纤维发育过程中主要在起始时期(开花当天)的胚珠中和次生壁加厚时期(开花后25和30天)的纤维中表达量较高(图3)。活性氧的产生对于棉花纤维发育具有重要的作用:纤维起始时期的活性氧爆发、次生壁加厚时期的活性氧含量升高对于纤维发育的起始和成熟至关重要[21-22]。胁迫过程往往伴随着细胞内活性氧的升高,棉花GhHSFA6b基因的高表达可能与活性氧的大量产生密切相关并进一步参与纤维发育过程。
目前大肠杆菌表达系统已经比较完善,其遗传背景清楚、培养操作简单、转化效率高、生长繁殖快、成本低廉,且具有可以快速产生大量目的蛋白的优点,因此作为宿主细胞被广泛的用于外源蛋白的诱导表达[23]。本实验首次对棉花热激转录因子GhHSFA6b进行原核表达。选用pET32a原核表达载体,诱导表达的蛋白可通过载体上带有的His标签进行纯化,可为进一步研究其蛋白体外功能及蛋白之间的相互作用奠定基础。经SDS-PAGE检测,重组GhHSFA6b蛋白的相对分子质量约为62×103(图4)。亚细胞定位分析表明GhHSFA6b-GFP融合蛋白主要在细胞核和质膜表达(图5),可能通过其自身包含的NLS与NES协同作用控制其进出细胞核从而调控下游基因的表达。
4 结论
热激转录因子是调控逆境胁迫响应的关键因子,本研究中,棉花热激转录因子GhHSFA6b具有A类热激转录因子的典型结构域,GhHSFA6b基因的表达显著受热激胁迫的诱导并参与棉花纤维发育;亚细胞定位结果显示GhHSFA6b主要定位于细胞核及质膜;获得相对分子质量约为62×103的重组GhHSFA6b蛋白。研究结果表明GhHSFA6b可能在棉花发育和响应热激过程中发挥重要作用,为深入理解HSF的的重要功能及调控机制解析提供了良好参考。

