一株猪链球菌的分离鉴定及其生物学特性研究
邹伟斌 梁秋燕 蔡东伶 陈汉锶 李仕新 齐冬梅*
(1广东永顺生物制药股份有限公司,广东广州 511356;2仲恺农业工程学院,广东广州 510225)
猪链球菌(Streptococcus suis,SS)普遍存在于健康猪只体内,其中具有致病性的菌株可引起猪、人类和其他动物感染猪链球菌病[1]。该病是养猪生产中的常见病,给我国乃至全球生猪养殖业带来巨大的经济损失,影响食品安全及公共卫生,给人类的健康甚至生命安全带来重大威胁,已被我国列为二类动物疾病[2]。本文通过从广东省某养殖场分离鉴定猪链球菌,结合该菌株的生长特点、生化特征和抗生素敏感性,分析猪链球菌的病原学特性,为猪链球菌的培养、疫苗的制备筛选奠定基础,为完善猪链球菌病的防控防治措施提供参考。
1 试验材料与方法
1.1 试验材料
1.1.1 试验试剂
胰蛋白胨大豆琼脂(TSA)培养基、胰蛋白胨大豆肉汤(TSB)培养基、革兰氏细菌染色试剂盒、猪链球菌生化鉴定盒、血琼脂平板,均购自广东环凯微生物科技有限公司;抗菌药物药敏纸片,购自杭州天和微生物试剂有限公司;r-Taq DNA聚合酶、DNA分子量标准DL 2 000,购自宝生物工程(大连)有限公司;胰蛋白胨、酵母提取物,购自英国OXOID公司;PCR引物,购自生工生物工程(上海)股份有限公司;氯化钠,购自上海市博微生物科技有限公司。
1.1.2 试验菌株
所用菌株均从广东省某养殖场牛奶样品中分离得到。
1.2 试验方法
1.2.1 细菌的分离及形态鉴定
从样品中分离出来的可疑菌株(Ⅰ、Ⅱ、Ⅲ)分别接种在血琼脂平板(Ⅰ、Ⅱ、Ⅲ)上,37℃恒温培养箱中培养24 h,根据菌落的生长形态,从平板上长出的菌落中挑选具有代表性的菌落,进行革兰氏染色,在光学显微镜下观察。
1.2.2 分离菌株的PCR鉴定
将含有混合菌液的离心管(Ⅰ、Ⅱ、Ⅲ)100℃水浴5 min,提取DNA作为PCR反应的模板;然后以16S rDNA通用引物进行扩增,引物序列为27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GG TTACCTTGTTACGACTT-3’。
PCR反应体系(50 μL)为:上、下游引物各2 μL,r-Taq DNA聚合酶25 μL,模板4 μL,灭菌去离子水17 μL。PCR反应条件为:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸45 s,然后进入35个循环,72℃延伸10 min。PCR产物用琼脂糖凝胶电泳检测,对应的PCR产物送生工生物工程(上海)股份有限公司测序。
1.2.3 分离菌株的生化鉴定
将分离出的猪链球菌新鲜菌苔置于无菌生理盐水中,配制成菌悬液(约5×108CFU/mL),分别接种于12支微量生化管内,35~37℃恒温培养箱中培养24 h,观察各生化管的颜色变化[3]。
1.2.4 液体培养基的优化试验
采用单因素法,以10 g/L蛋白胨、5 g/L酵母提取物、10 g/L氯化钠作为基础液体培养基(A),通过调整培养基配方中3种组分的含量,配制营养组分不同的试验组和对照组。将基因测序确定为猪链球菌的菌株经过纯培养得到的二级种子液分别转接到不同营养组分的液体培养基中,置于37℃恒温摇床中振荡培养18 h,用无菌水稀释至10-6、10-7、10-83个浓度梯度,进行平板活菌计数测定,并对计数结果进行统计分析。
1.2.5 生长曲线测定
将基因测序确定为猪链球菌的菌株经纯培养得到的二级种子液转接到扩大培养基中,置于37℃恒温摇床中振荡培养24 h,从第8个小时起每隔2 h取样,进行平板活菌计数测定,记录数据并绘制生长曲线。
1.2.6 药敏试验
采用纸片法进行药敏试验。取分离得到的猪链球菌纯培养物接种到TSA培养基平板上,接种量为每平板菌液100 μL,均匀涂布,用无菌镊子以“十”字贴法将30种抗生素药敏片平贴于平板表面,倒置放入37℃培养箱中培养24 h,观察并测定抑菌圈的大小[4]。
2 试验结果
2.1 细菌的分离及形态鉴定
3个血琼脂平板的菌落均呈灰白色,表面光滑,边缘整齐,周围无明显溶血环,应为非溶血性或γ-溶血性链球菌;3个菌株的革兰氏染色均呈紫色,说明均为革兰氏阳性菌;血琼脂平板Ⅰ的菌落直径在0.1~1.0 mm,镜下可见以长链存在的小球菌,血琼脂平板Ⅱ和Ⅲ的菌落直径在1~2 mm,镜下可见菌体成对或中长链存在。
2.2 链球菌的PCR鉴定
3个菌株的粗提取DNA用16S rDNA通用引物进行PCR扩增,产物进行核酸琼脂糖凝胶电泳,结果见图1,均成功扩增出目的条带,约1 500 bp。将对应菌株的PCR产物送生工生物工程(上海)股份有限公司测序,测序结果与NCBI数据库进行比对,确定菌株Ⅰ为无乳链球菌,菌株Ⅱ为乳房链球菌,菌株Ⅲ为猪链球菌。
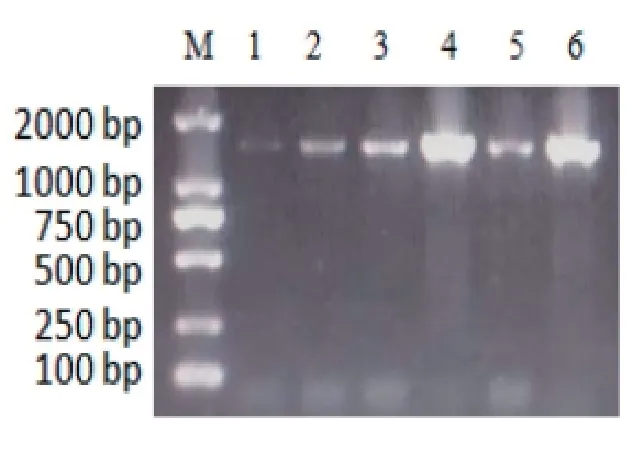
图13 株可疑菌的16S rDNA的PCR扩增结果
2.3 猪链球菌的生化鉴定
猪链球菌与12支生化鉴定管的反应结果见表1,与山梨醇、七叶苷、甘露醇、乳糖、甘露糖反应为阳性,与pH值9.6的肉汤、D-核糖反应为弱阳性,与菊糖、松三糖、阿拉伯糖、甘油、棉子糖均不反应。
2.4 液体培养基筛选
LB液体培养基单因素筛选设计见表2,不同液体培养基的活菌计数结果见图2。氯化钠的主要作用是提供无机盐、调节渗透压,由图2可知,在蛋白胨和酵母提取物含量相同的情况下,氯化钠含量低于10 g/L时,氯化钠含量减少,活菌数减少,而氯化钠含量高于10 g/L,可抑制菌株的生长;仅改变酵母提取物含量对猪链球菌的生长没有明显影响;蛋白胨对该菌生长具有明显的促进作用,但达到一定含量以后,活菌数量趋于稳定。要有效提高猪链球菌的活菌数量,应综合考虑培养基中营养组分的配比,使营养成分充分有效利用,实现产能最大化。

表1 生化鉴定结果

表2 LB液体培养基单因素筛选设计

图2 不同营养组分的液体培养基培养菌落活菌计数结果
2.5 猪链球菌生长曲线测定
从图3可知,猪链球菌活菌数在16~18 h达到顶峰,为2.15×108CFU/mL,18 h后活菌数呈快速下降趋势,至20 h时活菌数趋于稳定,20~24 h活菌数稳定在1.60×108CFU/mL左右,34 h时活菌数又升高至1.80×108CFU/mL。在实际生产应用中,可以结合生长曲线,在合适的时间挑选菌种、菌龄,控制细菌培养时间,选择最佳的补料时间,从而减少时间成本投入。

图3 猪链球菌生长曲线测定结果
2.6 药敏试验
猪链球菌对30种常规药物的药敏试验测定结果表明(见表3),试验分离的猪链球菌对青霉素、羧苄西林、哌拉西林、头孢氨苄、头孢唑林、头孢拉定、头孢曲松等β-内酰胺类抗菌药物具有极高的敏感度;而对庆大霉素、卡那霉素、丁胺卡那霉素、四环素、多粘菌素B、克林霉素等则表现出一定的耐药性。在临床治疗过程中,应科学合理地使用β-内酰胺类抗生素,建议交叉用药或联合用药,从而降低抗生素耐药的发生概率。

表3 猪链球菌抗菌药敏纸片试验结果
3 讨论与结论
本文分离得到的猪链球菌的生化鉴定结果与甘露醇反应呈阳性,临床上在甘露醇发酵试验中,17、19、21这3种血清型中能分离出70%的阳性菌株[5],可通过多种方法综合分析,进一步鉴定此菌株是否为17、19、21血清型中的一种。本文猪链球菌在培养34 h时活菌数升高,可能是因为培养过程中随着部分细菌死亡,细菌间养分竞争减少,为细菌的繁殖提供了条件。蛋白胨作为猪链球菌生长所需的重要成分,活菌数随蛋白胨含量的增加而增加,但达到一定含量后,活菌数变化不明显,可能是由于氯化钠和酵母提取物的含量固定,各营养组分的配比不平衡,没有达到利用率最大化。药敏试验结果显示,该株猪链球菌对青霉素、羧苄西林、哌拉西林、头孢氨苄、头孢唑林、头孢拉定、头孢曲松等β-内酰胺类抗菌药物具有极高的敏感度,在临床上用于治疗和防控猪链球菌病具有重大意义,但应科学合理使用此类抗生素,建议交叉用药或联合用药,从而降低抗生素耐药的发生概率。猪链球菌的分型繁多,生化特性、生长特点多样,对其生长特性变化、各分型对药物的敏感性仍需要开展进一步的研究。

