甲状腺癌患者血清抗甲状腺球蛋白抗体、白细胞介素-35及促甲状腺激素水平及意义
赵敏
(河南省三门峡市中心医院 检验科,河南 三门峡 472000)
甲状腺结节是最常见的一种肿块性疾病,常见于老年人、碘缺乏地区、女性及头颈部接受放射治疗人群,每年发病率在0.1%左右,其中甲状腺癌占比15% 左右[1-2]。甲状腺癌生物学特征多变,发病较为隐匿,同时其临床特征、细胞学及影像学表现与良性病变存在交叉,因此误诊率较高,而对于误诊患者实行手术将增加患者痛苦及经济负担[3-4]。近年来,研究患者甲状腺癌相关实验室指标辅助诊断的价值成为新的方向。促甲状腺激素(thyroid stimulating hormone, TSH)是人体垂体前叶分泌的糖蛋白,其水平升高是发生甲状腺癌的独立危险因素;抗甲状腺球蛋白抗体(anti-thyroglobulin antibodies,TgAb)是自身甲状腺产生的抗体,其水平异常上升提示存在自身免疫性甲状腺疾病;白细胞介素-35(interleukin-35,IL-35)可激活淋巴细胞,提升细胞免疫力,从而保护甲状腺组织[5]。基于此,本研究通过分析甲状腺癌患者血清TgAb、IL-35 及TSH 水平,旨在探究其临床意义。
1 资料与方法
1.1 一般资料
2014年12月至2017年12月到本院就诊的甲状腺癌患者90 例为病例组,其中乳头状癌患者39例,滤泡状癌患者28 例,未分化癌患者23 例;另选同期就诊的甲状腺良性病变患者90 例为良性组,体检健康者90 例为对照组。病例组男24 例,女66 例;年龄22~63 岁,平均(46.79±4.68)岁;体重指数(body mass index,BMI)19~24 kg/m2,平均(22.03±1.11)kg/m2;良性组男27 例,女63 例;年龄24~65 岁,平均(46.58±4.66)岁;BMI 指数19~24 kg/m2,平均(22.09±1.06)kg/m2;对照组男25 例,女65 例;年龄23~65 岁,平均(46.43±4.64) 岁; BMI 19~24 kg/m2, 平均(22.12±1.02)kg/m2。3组一般资料差异无统计学意义(P>0.05),具有可比性。该研究经本院伦理委员会的审批同意。
纳入标准:①根据病理学检查结果确诊为甲状腺癌患者;②临床资料完整;③患者知情并签署知情同意书。排除标准:①免疫系统疾病患者;②甲状腺功能亢进(甲亢)疾病、甲状腺结节、甲状腺毒性自立性结节等疾病患者;③全身感染患者;④严重贫血、营养不良者;⑤精神疾病者;⑥合并其他部位恶性肿瘤患者:⑦有颈部手术史、放射治疗史者;⑧妊娠、哺乳期女性;⑨有甲状腺相关治疗药物使用史者。
1.2 方法
所有人员抽取空腹静脉血,并在3 500 r/min条件下离心10 min 后分离血清检测,采用全自动化学发光分析仪检测TSH,仪器购于美国贝克曼公司;采用放射免疫分析法检测TgAb,试剂盒购于上海常斤生物公司;采用酶联免疫吸附法检测IL-35;试剂盒购于深圳新产业生物公司。
1.3 观察指标
①统计3组人员血清TgAb、IL-35 及TSH 水平;②统计甲状腺癌患者中不同病理分型的血清TgAb、IL-35 及TSH 水平。
1.4 统计学方法
本文数据采取统计学软件SPSS 17.0 进行处理,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 3组人员血清TgAb、IL-35 及TSH 水平比较
病例组TgAb、TSH 水平高于良性组及对照组,IL-35 低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 3组血清TgAb、IL-35 及TSH 水平比较(±s)

表1 3组血清TgAb、IL-35 及TSH 水平比较(±s)
组别病例组良性组对照组F值P值例数90 90 90 TgAb/(IU/ml)1 058.64±105.86 602.48±60.25 113.05±11.32 7.970 0.000 IL-35/(pg/ml)51.38±5.14 60.52±6.05 68.79±6.88 3.691 0.000 TSH/(mIU/L)51.76±5.18 12.33±1.23 4.86±0.49 8.800 0.000
2.2 不同病理类型甲状腺癌患者TgAb、IL-35 及TSH 水平比较
乳头状癌TgAb、TSH 水平低于未分化癌及滤泡状癌,IL-35 高于未分化癌及滤泡状癌,差异有统计学意义(P<0.05)。见表2。
3 讨论
甲状腺是人体内主要内分泌器官,可吸收、合成及分泌碘元素,其分泌的甲状腺激素对生理代谢、骨骼发育等有重要作用。当患者体内甲状腺细胞出现结构变化时,可能导致甲状腺结节,通常临床无明显症状,在体检时可能被检出。恶性甲状腺结节中80%左右为分化型甲状腺癌,分化型甲状腺癌也是颈部常见的恶性肿瘤。分化型甲状腺癌由于病情发展缓慢、恶性程度不同及生物学特殊性,与良性结节鉴别有较大困难;临床上细针穿刺细胞学检测是诊断分化型甲状腺癌的重要方式,但误诊率仍达到20% 左右[3]。因此,早期准确诊断甲状腺癌,避免过度诊断及过度治疗十分关键。
表2 不同病理类型TgAb、IL-35 及TSH 水平比较(±s)
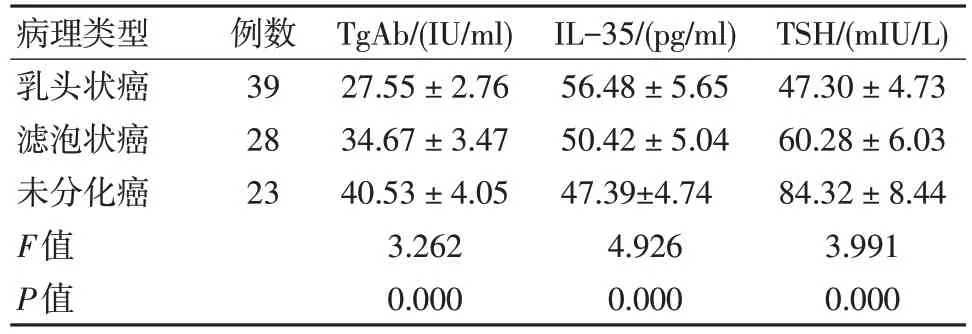
表2 不同病理类型TgAb、IL-35 及TSH 水平比较(±s)
病理类型乳头状癌滤泡状癌未分化癌F值P值例数39 28 23 TgAb/(IU/ml)27.55±2.76 34.67±3.47 40.53±4.05 3.262 0.000 IL-35/(pg/ml)56.48±5.65 50.42±5.04 47.39±4.74 4.926 0.000 TSH/(mIU/L)47.30±4.73 60.28±6.03 84.32±8.44 3.991 0.000
血清甲状腺球蛋白(Tg)是一种糖蛋白,源自甲状腺滤泡上皮细胞,是分化型甲状腺癌的肿瘤标志物,临床上常用于评估疗效及预后。正常人群的血液循环中含有少量Tg,当甲状腺组织受损时,其上皮细胞将释放大量Tg,引起血液中Tg水平上升。TgAb 是Tg 的抗体,其水平随着Tg 上升而升高[6]。本研究中病例组TgAb 水平明显高于甲状腺良性病变组及健康人群,可能原因为甲状腺癌组织生长、浸润破坏正常甲状腺组织结构及功能,导致甲状腺细胞坏死,引起炎症反应,刺激上皮细胞释放Tg,造成血清TgAb 水平上升,与张雷等[7]研究结果一致。
TSH 是一种促进甲状腺组织分化增殖的生长因子,血清中水平上升将促进癌症病情发展,有研究显示TSH 水平与甲状腺癌发生率有线性关系[8]。目前,TSH 与分化型甲状腺癌的关联机制被认为有如下几种途径:TSH 受体与滤泡性上皮组织中细胞结合,促进甲状腺细胞分泌促生长的蛋白质等物质,促进癌细胞及肿瘤性血管生长;TSH 的高水平状态将改变甲状腺组织基因结构,诱导发生甲状腺癌;TSH 与受体结合后将导致受体的基因结构改变,并影响分子信号正常传导,从而导致发生甲状腺癌。本研究中病例组TSH 水平最高,可能原因为TSH 可促进癌细胞增殖分化,罗艳等[9]研究发现分化型甲状腺癌患者血清TSH水平显著高于对照组。
IL-35 是一种保护甲状腺组织的因素,可激活CD8+、CD4+等淋巴细胞,改善细胞免疫功能,从而起到抑制癌细胞作用。本研究中病例组IL-35水平明显降低,可能原因为IL-35 水平降低则无法调控淋巴细胞进行细胞免疫,无法抑制癌细胞增殖。本研究中不同病理类型甲状腺癌患者TgAb、IL-35 及TSH 水平有差异,说明在不同病理类型中TgAb、IL-35 及TSH 水平不同。
综上所述,本研究分析甲状腺癌、甲状腺良性病变及健康人群实验室指标水平,发现甲状腺癌患者TgAb、TSH 水平明显上升,而IL-35 水平明显降低;不同病理类型的甲状腺癌患者中TgAb、IL-35 及TSH 水平有明显差异。

