基因1型戊型肝炎病毒 ORF3对人外周血来源的树突状细胞成熟和活化功能的影响*
彭文举 田德英 吴 亮
华中科技大学同济医学院附属同济医院消化内科 (湖北 武汉, 430030)
戊型肝炎病毒(HEV)是全球范围内引起急性肝炎的最常见的病原体之一,HEV是无包膜单股正链的RNA病毒,分为基因1~4型,病毒RNA全长约7.2kb,编码三个开放读码框(ORF)。ORF1编码病毒的非结构蛋白;ORF2编码病毒的衣壳蛋白;ORF3编码一个多功能小分子磷酸蛋白,其具体功能尚不十分清楚,可能与病毒的装配,释放,诱导宿主炎症反应以及信号转导有关[1~4]。传统观点认为,戊型肝炎是一种急性、自限性的疾病,但是近十年来,发展为慢性化的戊型肝炎病人开始被人们识别且较多的被报道。然而目前关于戊肝发生慢性化的机制尚不十分清楚。有研究提示,HEV ORF3可能在HEV逃避宿主免疫反应[5,6],进而实现感染慢性化的过程中发挥着关键作用。树突状细胞(DC)是人体功能最强大的抗原提呈细胞(APC),不仅可以识别并提呈抗原,并且能直接激活初始T淋巴细胞,是机体免疫反应的始动者,也是联系天然免疫反应和适应性免疫反应的纽带。本研究通过构建ORF3慢病毒载体,感染人外周血来源的树突状细胞,来探讨基因1型HEV ORF3对树突状细胞成熟和活化功能的影响,以阐明HEV感染慢性化的可能机制。
1 材料与方法
1.1 材料及试剂 人淋巴细胞分离液Ficoll(天津灏阳),重组人白细胞介素4(rhIL-4)、重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、人TNF-α(美国 peprotech),RMPI-1640培养基(美国 hyclone),PE标记的鼠抗人CD单抗、FITC标记的鼠抗人CD80、CD86(美国 ebioscience),人IFN-β、IL-4、IL-10、IL-12 ELISA试剂盒(上海西唐)。实验所需的外周血均来源于健康志愿者。基因1型ORF3序列由厦门大学国家传染病诊断试剂与疫苗工程技术研究中心(NIDVD,中国)提供,慢病毒载体的构建由武汉金开瑞生物工程公司完成。
1.2 实验方法
1.2.1 DC的诱导培养 抽取健康男性志愿者肘静脉血30ml,肝素抗凝。将全血用RMPI-1640培养基1∶1稀释,将稀释血以2∶1的比例缓缓加入淋巴细胞分离液的表面,采用密度梯度离心法分离外周血单个核细胞(PBMC),800g离心30min。小心吸取单个核细胞层,加入5倍的RMPI-1640培养基洗涤细胞3次,1200rpm离心10min,即得到PBMC细胞沉淀。调整PBMC密度到1×106个/ml后,种植到6孔板中,放入37°、5%CO2培养箱培养4h后轻吸去非黏附细胞,即获得贴壁的单个核细胞。贴壁细胞以RMPI-1640培养液轻柔洗涤一次,每孔加3ml培养液,添加细胞生长因子rhGM-CSF(终浓度100ng/ml)、rhIL-4(终浓度50ng/ml)。培养大约6~7天分化成DCs细胞。
1.2.2 ORF3慢病毒载体感染DC 诱导的DC分为A、B、C组,A组作为对照,B组以MOI=0.1加入病毒浓缩液,C组加入不含ORF3的慢病毒对照,并加入6 μg/ml polybrene,感染12h后改用正常培养基换液,荧光显微镜观察ORF3(GFP标记)转染DC。向DC细胞中加入TNF-α(终浓度20ng/ml),促进DC细胞成熟。
1.2.3 ELISA检测细胞上清中细胞因子 分别于ORF3慢病毒载体感染DC 48h后、TNF-α刺激48h后,用双抗夹心法ELISA试剂盒检测培养上清中细胞因子IFN-β、IL-4、IL-10和IL-12的含量,按照试剂盒说明书进行操作。
1.2.4 流式细胞术检测细胞表面标志 分别于ORF3慢病毒载体感染DC 48h后、TNF-α刺激48h后,收集细胞,离心后用100μl PBS重悬细胞,对应管分别加5μl CD80、CD83、CD86荧光一抗,室温避光孵育15min。PBS洗涤3次后,用分析型流式细胞仪(Beckman Cytoflex)检测。
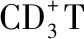
1.2.6 DCs对T细胞增殖的影响 将上述各组DC细胞和T细胞共培养48h,CCK8法检测T细胞增殖情况。
2 结果
2.1 体外培养不同时间DC形态观察 显微镜下观察可见,分离的PBMC贴壁生长、形态单一;rhGM-CSF、rhIL-4刺激2天后,部分细胞呈悬浮状态,细胞颜色有所加深,细胞体积有所增大,但细胞表面仍无明显的树突样突起;第6天时,细胞体积明显增大,细胞大小不一,部分细胞表面有树突样突起,但突起数量较少,密度较小,大部分细胞表面突起不明显,说明此时的DC成熟度不高,大部分处于不成熟状态。见图1。

A.外周血单个核细胞 (100×) B.诱导后2天后的DC (100×) C.诱导后6天的DC (100×)
2.2 ORF3慢病毒成功感染DC GFP标记的ORF3慢病毒感染DC 48h后,荧光显微镜下观察到绿色荧光,说明ORF3慢病毒载体已经成功感染DC细胞。见插页图2。
2.3 ORF3感染影响DC分泌细胞因子 ORF3慢病毒感染DC 48h后,和空载组相比,ORF3组DC细胞上清中IFN-β、IL-4、IL-10和IL-12浓度均降低(P<0.001)。见图3。

图3 ORF3对DC分泌细胞因子的影响
2.4 ORF3抑制DC细胞成熟 ORF3慢病毒感染DC 48h时,和空载组相比,ORF3组DC细胞CD80、CD83和CD86表达均显著下降(P<0.005)。见图4。
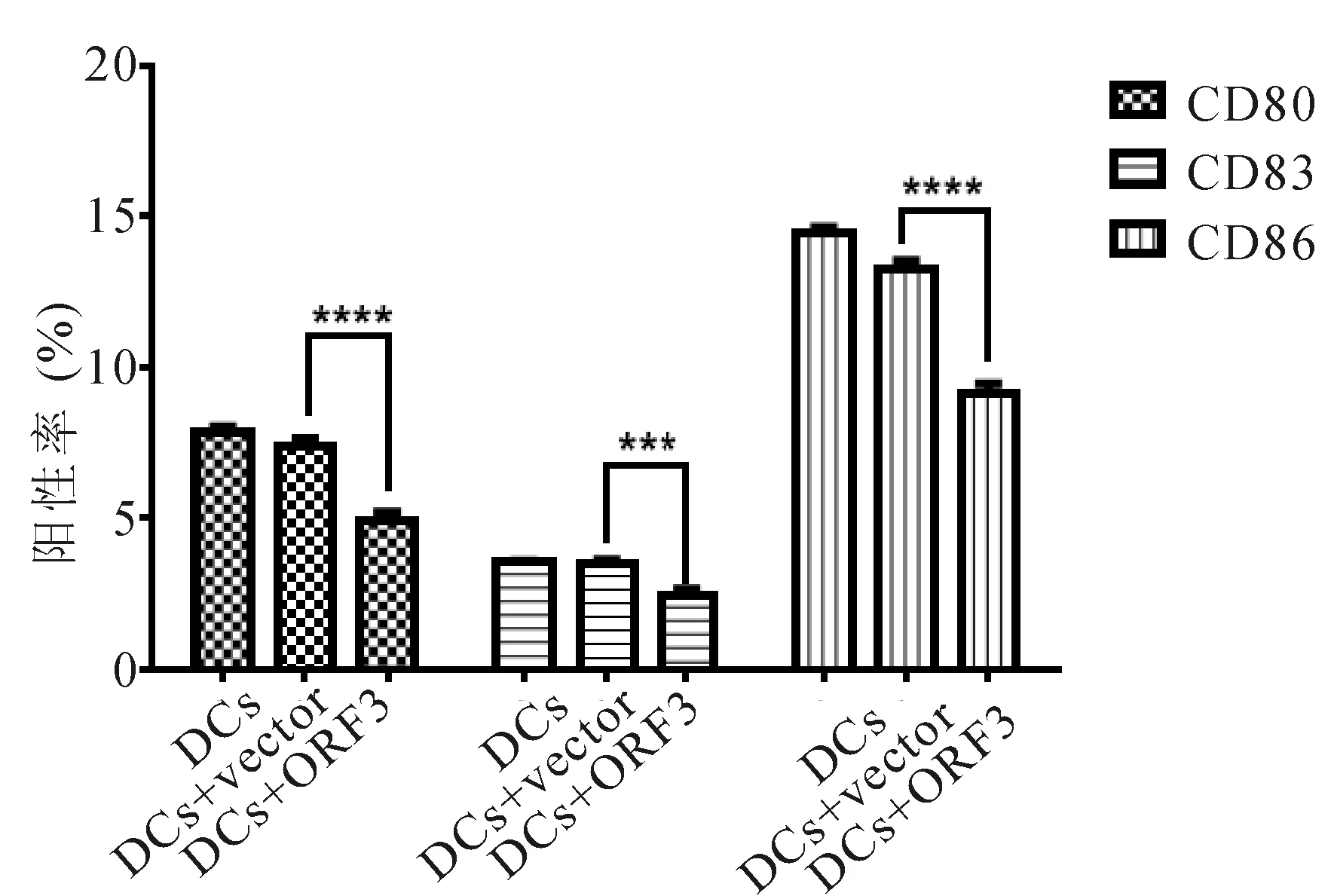
图4 ORF3对DC细胞表面分子表达的影响
2.5 ORF3对加入TNF刺激DC成熟的影响 经TNF-α刺激,DC细胞进一步成熟,与未加TNF相比,IFN-β、IL-4、IL-10和IL-12浓度明显上升(P<0.001),DC表面CD80、CD83和CD86表达也明显增多(P<0.05)。ORF3组DC与空载组相比,IFN-β、IL-4、IL-10和IL-12分泌减少(P<0.05),DC表面CD80、CD83和CD86的表达也减少(P<0.05)。见图5、图6。
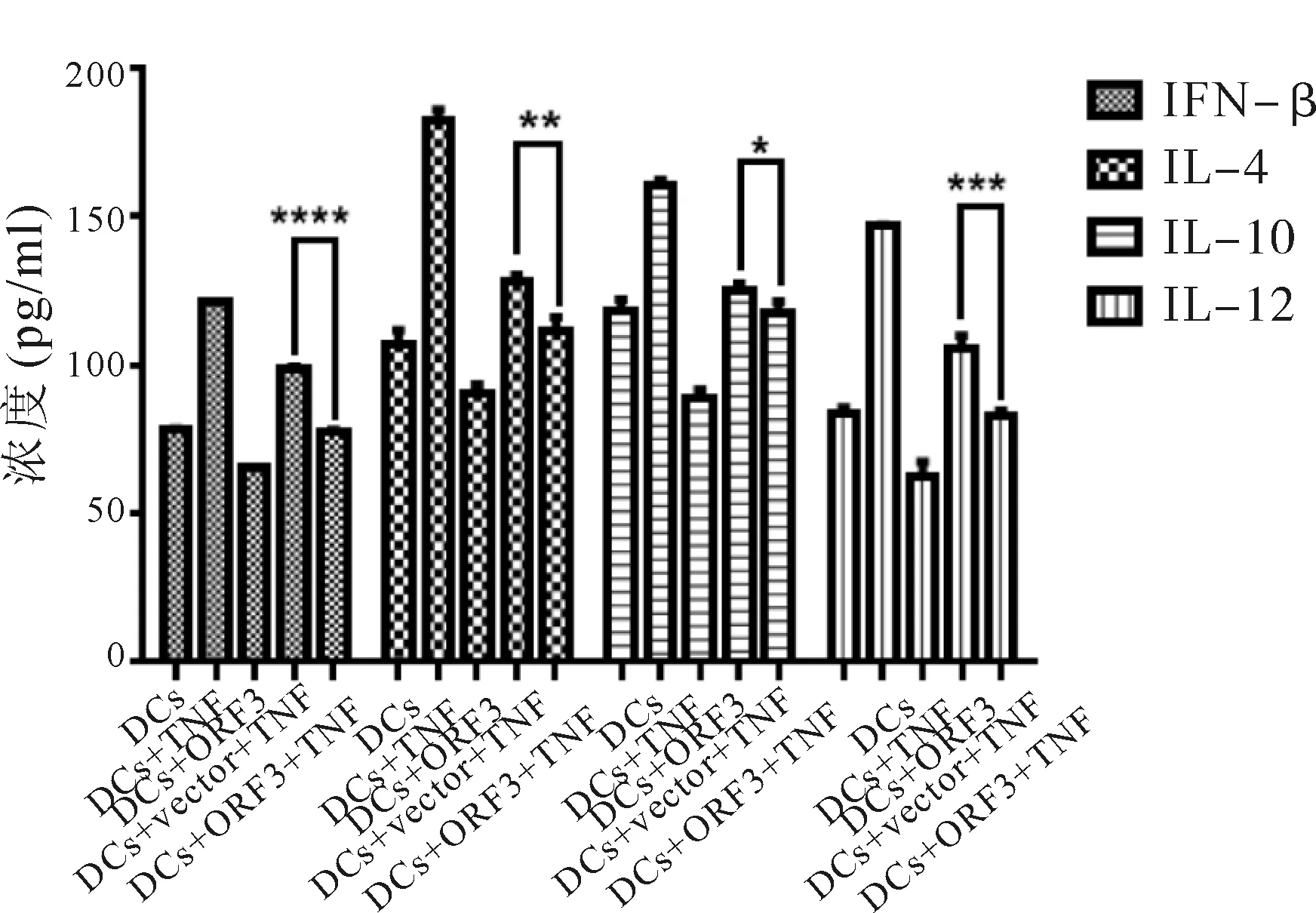
图5 加入TNF后DC上清细胞因子分泌情况
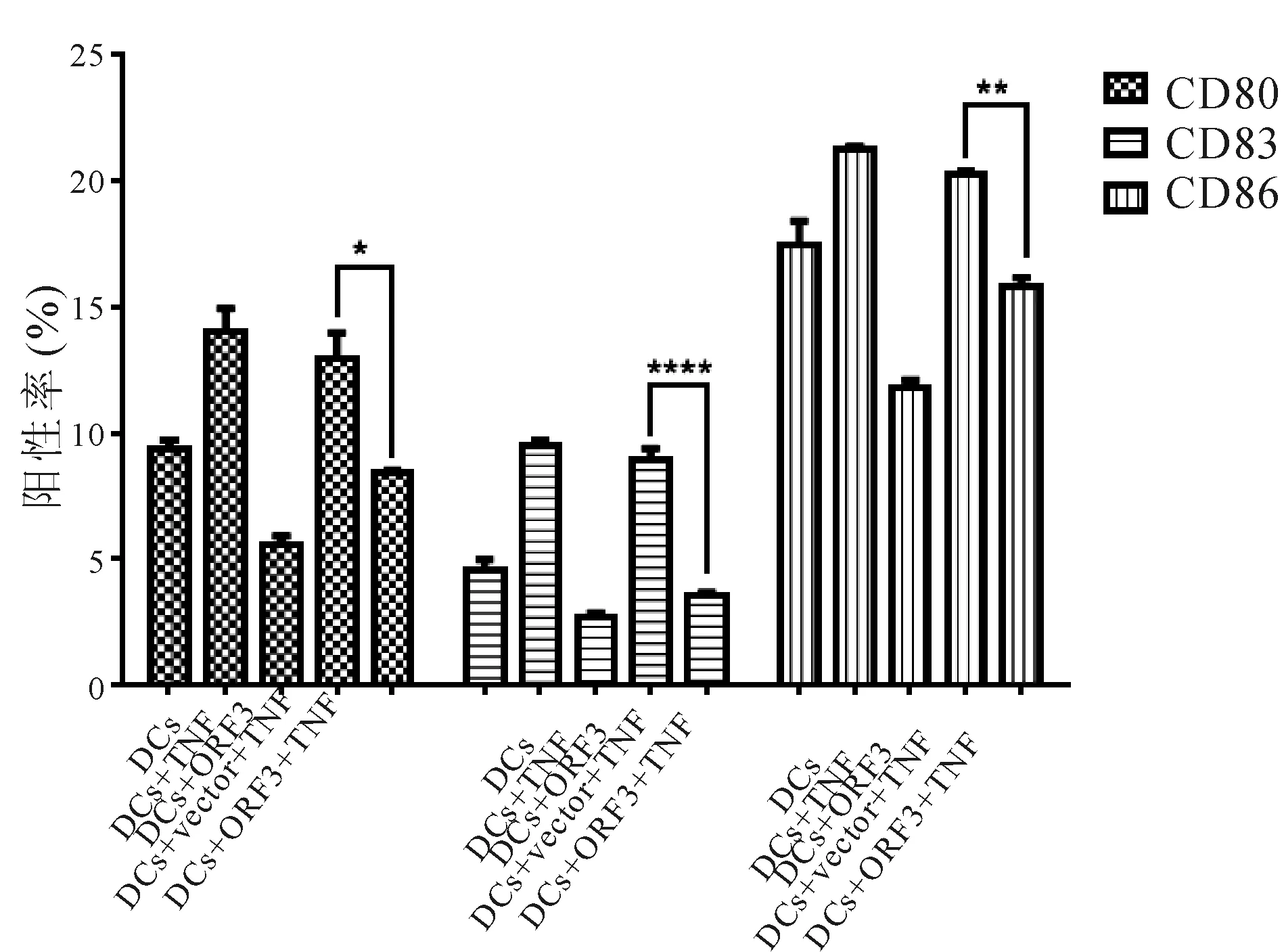
图6加入TNF后DC表面分子的表达情况
2.6 T淋巴细胞诱导成功 结果显示,诱导后细胞CD3阳性率大于90%,成功诱导出高纯度T淋巴细胞。见图7。
2.7 ORF3影响DC刺激T细胞增殖的能力 经TNF刺激成熟的DC能够促进T细胞增殖(P<0.001,图中未显示),而空载组DC刺激T细胞增殖能力减弱(P<0.005,图中未显示)。与空载组相比,ORF3组DC刺激T细胞增值的能力下降(P<0.001),说明ORF3可以抑制DC对T细胞的增殖刺激。见插页图8。
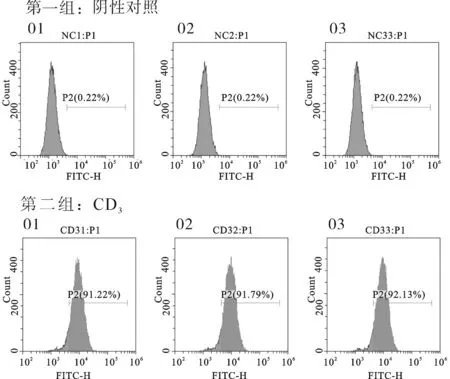
图7T细胞诱导后CD3的检测
3 讨论
慢性戊型肝炎主要发生在器官移植后、艾滋病病毒(HIV)感染、罹患血液系统恶性肿瘤等免疫力低下或者缺陷的病人中[7],有报道指出,器官移植患者感染HEV后60%以上会发展为慢性化[8]。病原微生物侵入机体后,可以迅速的被机体的固有免疫系统所识别,进而固有免疫活化导致炎症的发生,使感染得以局限和控制。DC作为机体非常重要的固有免疫细胞,是决定病毒感染后结局的关键因素。不同的病毒感染后可以对DC造成不同的影响,有的病毒通过改变DC的成熟度来影响疾病的病程[9]。病毒和DC的相互作用是决定病毒迅速被清除还是得以在机体内持续存在的关键。未成熟DC和成熟DC的表面分子标志存在很大差异。未成熟的DC表面MHC-II类分子表达水平很低,共刺激分子和粘附分子表达也很少。但是却高表达FcR和病原体受体,成熟DC表面表达大量MHC-II类分子,粘附分子和共刺激分子(CD80、CD86等),但是FcR和病原体受体的表达却基本消失。CD83是DC的特异性表面分子标志,且CD83在未成熟DC表达甚微,而在成熟的DC细胞中却大量表达[10]。
DC除了可以将抗原提呈给T淋巴细胞外,还可以分泌大量的细胞因子,调节机体的免疫反应。DC可以产生IL-12,诱导Th0细胞向Th1细胞方向分化,从而增强细胞免疫应答。同时也可以产生较高水平的IL-4诱导Th0细胞向Th2细胞方向分化,增强体液免疫应答。除此之外,DC还可以产生多种细胞因子和趋化因子,如IL-1、IL-18、IFN-β等调节机体的免疫应答。本研究表明ORF3可以抑制DC分泌IL-12、IL-4、IL-10和IFN-β等,这样就导致机体的体液免疫和细胞免疫同时收到影响,同时机体的免疫调节能力下降,这样就导致HEV长期在体内不能够有效清除,从而导致戊肝慢性化的发生。
成熟的DC还可以刺激T细胞增殖,使T细胞的数量迅速增加,快速调动机体的免疫系统。然而,HEV ORF3却可以削弱这一作用,使T细胞数量增长缓慢,使机体不能够短期内清除病毒,导致病毒在体内长期存在而发生慢性化。如前所述,ORF3的这一作用可能跟CD83的下降有关,也可能有多种机制参与,需要进一步的研究。
上面所述就是本研究对于戊型肝炎发生慢性化的原因的一点解释。但是,还需要更多的证据来证明。同时,ORF3抑制DC的具体机制是什么,通过什么信号通路来实现,有哪些关键性的分子参与了这一过程?这都需要更深入的研究。

