HBV相关慢加急性肝衰竭中西医结合诊疗推荐意见
1 定义与术语
1.1 推荐意见分级系统
本推荐意见分级系统参照IDSA-美国公共卫生署(USPHS)临床指南推荐分级系统(表1)。

表1 IDSA-美国公共卫生署(USPHS)临床指南推荐分级系统
1.2 HBV相关慢加急性肝衰竭(hepatitis B virus-related acute-on-chronic liver failure,HBV ACLF)的定义
由于病因不同,东西方对慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)定义和诊断方面存在较大差异[1]。在欧洲和北美,一般根据欧洲肝病研究协会慢性肝病研究中心(EASL-CLIF)的指南,将其定义为肝硬化患者由急性诱因(如细菌感染、上消化道出血等)引起发生的以急性失代偿、器官衰竭和短期死亡率高为特点的临床综合征[2];而亚太地区肝脏研究协会(APASL)定义为:在代偿性肝硬化或非肝硬化慢性肝病基础上的急性直接肝脏损伤(嗜肝性病毒感染、活动性饮酒或药物诱导的肝损伤)所导致的肝衰竭[3,4]。
最近,由浙江大学牵头的一项13家多中心前瞻性研究(chinese group on the Study of Severe Hepatitis B,COSSH),纳入了1322名慢性乙型肝炎急性肝损伤和乙肝肝硬化急性失代偿的患者,提出了新的HBV ACLF定义(COSSH-ACLF):ACLF是在慢性肝病(肝硬化和非肝硬化)基础上,由急性诱因引起的、以肝脏和/或肝外器官衰竭、短期病死率高为特征的临床综合征[5]。
不同基础肝病与不同急性诱因导致的病变存在着患者群体的差异。因此,ACLF仍缺乏全球统一的定义和诊断标准,但人们倾向于把ACLF当成一个完整的临床综合征来考虑。我国为HBV感染高发地区,HBV ACLF最为常见,其发病机制和临床表现明显有别于欧美等国家以酒精或药物诱发的ACLF。本推荐意见仅针对HBV ACLF。
推荐意见1(A-Ⅰ):HBV ACLF,指在慢性乙型肝炎、乙肝肝硬化基础上,各种诱因引起以急性黄疸加深、凝血功能障碍为临床表现的综合征,可出现肝性脑病、腹水、电解质紊乱、感染、肝肾综合征、肝肺综合征等并发症,以及肝外器官功能衰竭。患者黄疸迅速加深,血清TBil≥10×ULN或每日上升≥17.1μmol/L;有出血表现,PTA≤40%(或INR≥1.5)。
追溯文献,我国晋代《诸病源候论·黄病诸候》就有类似本病的描述[6]:“脾胃有热,谷气郁蒸,因为热毒所加,故卒然发黄,心满气喘,命在顷刻,故云急黄也。”《医宗金鉴·疸证总括》[7]称:“天行疫疠发黄,名曰瘟黄,死人最暴也。”《沈氏尊生书·黄疸》[8]亦曰:“天行疫疠以致发黄者,俗称之瘟黄,杀人最急。”“急黄”、“瘟黄”蕴含了慢加急性肝衰竭的重要临床特征:外感、危重(杀人最急)和快速增高的黄疸,还部分提示其原发病变(“脾胃有热,谷气郁蒸”)和急性病因(“热毒所加”)。
1.3 相关术语
1.3.1 慢性重型肝炎:1978年,我国学者在杭州“第一次全国病毒性肝炎会议”首先提出“重症(型)肝炎”的命名[9],并将其分为急性重型(暴发型肝炎)、亚急性重型和慢性重型3型。1984年,南宁病毒性肝炎会议考虑到要与国际接轨[10],将慢性重型肝炎从重型肝炎中剔出,归至慢性活动性肝炎,称为慢性活动性肝炎重型。随后,1990年上海全国病毒性肝炎会议又恢复了慢性重型肝炎的诊断[11-14]。2006年,中华医学会感染病学分会和中华医学会肝病学分会倡导与国际接轨,制订了我国第一部《肝衰竭诊疗指南》[15],将肝衰竭区分为急性肝衰竭、亚急性肝衰竭、慢加急(亚急)性肝衰竭和慢性肝衰竭 4种。
1.3.2 酒精性慢加急性肝衰竭(A-ACLF):日本学者Ohnishi H 1995年明确提出ACLF的概念[16]之后,欧美学者逐渐认识在慢性酒精性肝病基础上,确实有部分患者可以由于某种诱因,出现肝脏疾病快速进展以至于发生多器官功能衰竭。进一步研究表明,东西方ACLF存在明显差异,无论从临床特征、病理生理学以及诊疗措施上,HBV ACLF与A-ACLF应该是两类不同临床综合征。
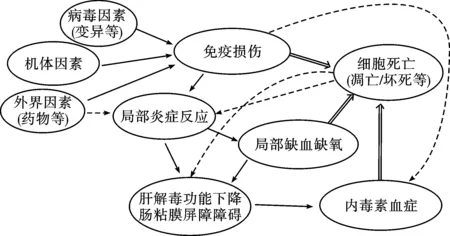
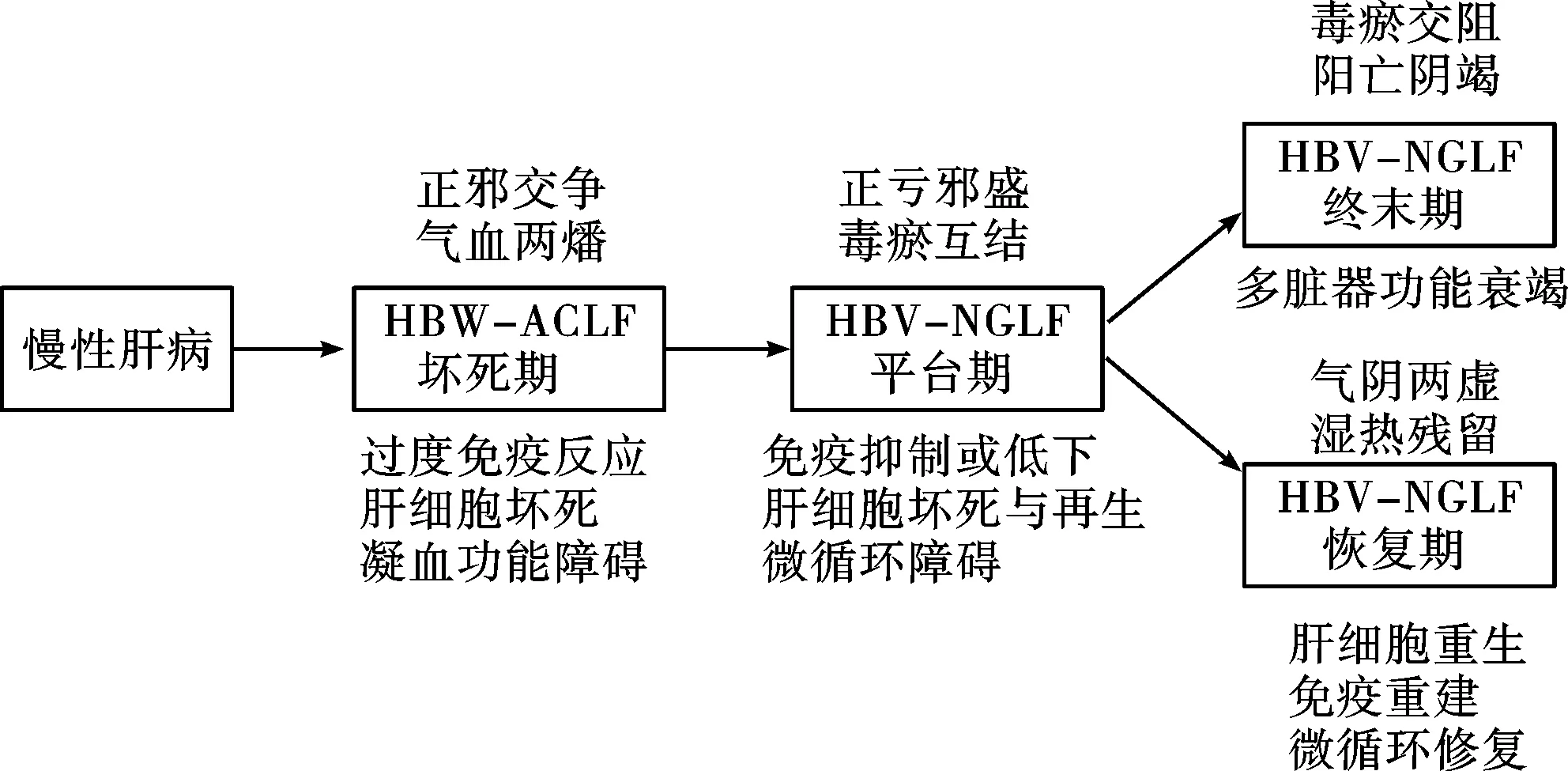
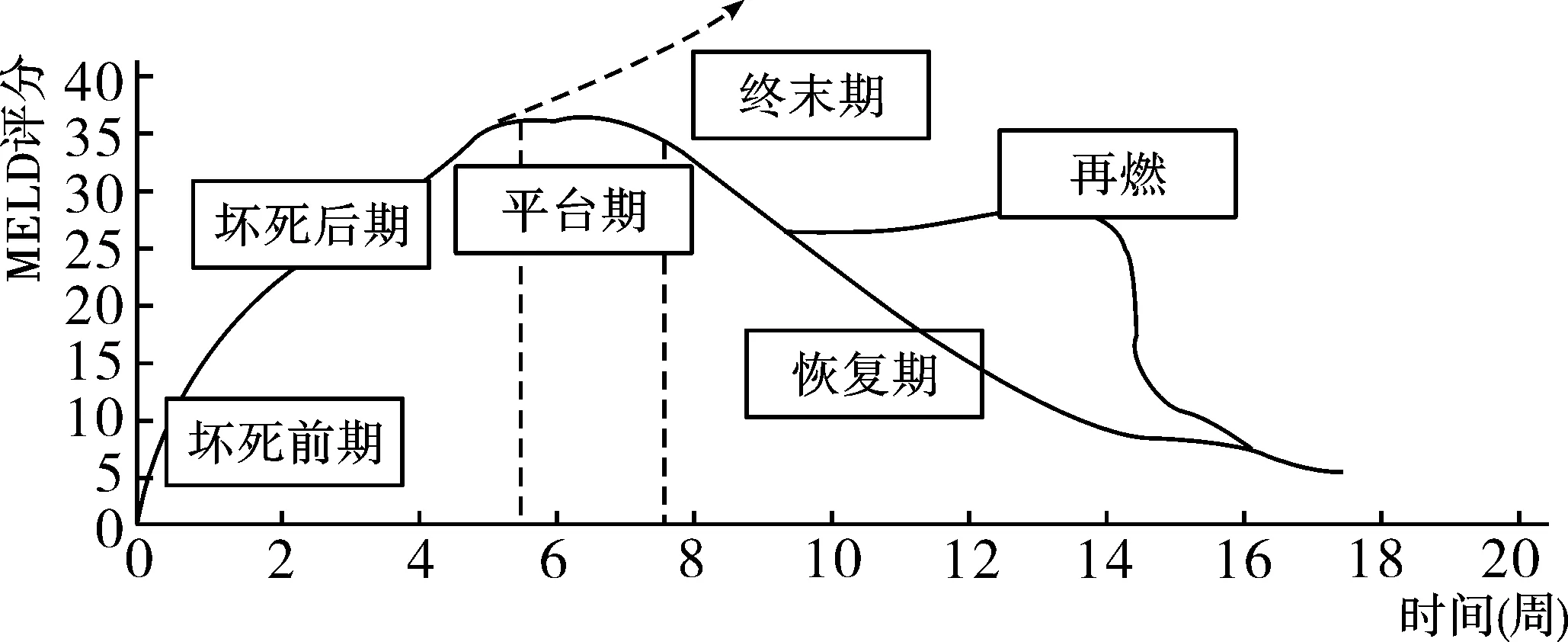
1.3.3 慢加急性肝衰竭前期(Pre-ACLF):《肝衰竭诊治指南》[17,18]提出了肝衰竭前期的概念,其临床特征为:①极度乏力,并有明显厌食、呕吐和腹胀等严重消化道症状;②ALT和/或AST大幅升高,黄疸升高(51μmol/L≤血清总胆红素≤171μmol/L),且每日上升≥17.1μmol/L;③有出血倾向,40% 浙江大学另一课题组选取符合上述诊断标准的患者以及HBV相关 ACLF患者进行研究,结果显示该类患者在12 周、24 周的死亡率与早期ACLF 患者无明显差异,但显著低于中期、晚期 ACLF 患者,MELD 分值、年龄、肝性脑病、甘油三酯水平、PLT 计数是影响 ACLF 前期患者生存的独立预测因素[19]。 另一项研究发现[20],37%入院表现为单一肝衰竭患者并且在入院28天进展至多脏器功能衰竭,28天死亡率40%。而其余63%的患者病情稳定,28天内不再进展至MOF,该部分患者28天死亡率仅3.0%。因此,有学者提出按亚太标准(TBil > 5mg/dl及INR > 1.5)且无肝外多脏器损伤或衰竭表现的患者为Pre-ACLF。在Pre-ACLF的患者中,40%左右在28天内进展至肝外脏器受累的多脏器损伤/衰竭才被诊断为真正具高死亡率的ACLF患者。 1.3.4 ACLF高危人群:欧洲学者提出,入院时未合并多脏器损伤/衰竭的肝硬化急性失代偿患者为ACLF的危险人群。其中约11%的患者将在28天内进展至ACLF。他们采用CLIF-AD评分[21]对肝硬化患者人群进行预测,当CLIF-AD评分高于60分时,被认为发生ACLF的风险比较高。CLIF-AD评分用于预测乙肝肝硬化急性失代偿患者发生ACLF的风险也得到了验证[20]。 国内学者通过1457例住院患者的队列研究,筛选出年龄、总胆红素水平、凝血酶原活动度和乙肝病毒载量等是慢性乙肝患者发生ACLF的独立危险因素,并建立了一个0~7的预警评分系统,其中 0~3分是发生ACLF的低风险人群,ACLF发病率仅为2%,而4~7分是发生ACLF的高危人群,ACLF发病率则高达33.8%。该预警评分系统不仅能够及早识别高危人群,还可以预测患者肝病相关的死亡风险,低风险组病死率0.8%,高风险组则为9.4%[22]。 对于ACLF患者,早期预警预测、对预后做出准确的判断能帮助临床医生选择最合适的治疗方法。传统的MELD等评分系统非ACLF的特异性评分,对ACLF的预后预测价值有限。在HBV ACLF人群中,COSSH-ACLF研究提出的COSSH-ACLF score具有较高的预测价值[5]。 2.1 原发基础病[3,4] 推荐意见2(A-Ⅰ):HBV ACLF的原发基础病包括慢性肝炎、代偿性肝硬化和失代偿性肝硬化。按基础肝病不同WCG将ACLF为A、B、C三种类型,A型以慢性肝炎为基础;B型以代偿期肝硬化为基础;C型以失代偿期肝硬化为基础。 2.2 急性诱因[3,4] 推荐意见3(A-Ⅰ):HBV ACLF的急性诱因包括感染性与非感染性两类。弄清急性诱因,对本病诊断和治疗有重要价值。 2.2.1 感染性诱因 (1)重叠感染嗜肝病毒(HAV、HEV、HCV、HDV等)和非嗜肝病毒(巨细胞病毒、EB病毒、肠道病毒、疱疹病毒等)。 (2)乙型肝炎抗病毒药物停药、病毒变异等导致。 (3)造成肝损伤的其它感染,如严重或持续的细菌感染或寄生虫感染等,尤其是革兰氏阴性菌感染。 2.2.2 非感染性诱因 (1)药物及肝毒性物质(对乙酰氨基酚、异烟肼、利福平、吡嗪酰胺等以及抗代谢药、抗肿瘤化疗药物、部分中草药、抗风湿病药物、毒蕈等)。 (2)酒精(最近4周内饮酒)。 (3)药物(免疫抑制剂等)、饮食、劳累、情绪等因素导致等肝炎复发或再激活。 (4)未知的肝毒性物质,如接触化工、化学毒物等。 东、西方国家的大队列研究发现约40%的慢加急性肝衰竭患者无法找到明确诱因[2,23],这部分患者可能涉及肠道功能障碍导致的肠道细菌移位。 3.1 发病机制 在HBV相关慢性肝病基础上,经病毒、细菌、药物、肝毒性物质等作用,导致免疫损伤、内毒素血症、微循环障碍以及肝细胞大量坏死,形成的以肝衰竭为先导的多器官功能衰竭[24](见图2)。 图2 HBV ACLF的三重打击学说 3.1.1 免疫异常 (1)免疫亢进:①导致患者肝细胞大量坏死的免疫损伤与全身炎性反应综合征(SIRS)密切相关[25];②先天性免疫系统中损伤相关分子模式(DAMPs)和病原体相关分子模式(PAMPs)通过不同信号途径被活化后,将释放大量的促炎因子(TNF-α、IL-1b、IL-6、IFN-γ等)和抑炎因子(IL-10),造成全身炎症反应综合征(SIRS);③严重的SIRS即为细胞因子风暴(cytokines storm),各种细胞因子的效应以及与肝细胞坏死的关系还有待进一步证实;④ HBV ACLF患者的白细胞计数和血浆C反应蛋白(CRP)水平比失代偿肝硬化患者要高,且这两者水平越高,衰竭器官个数越多。 (2)免疫抑制:过度炎症反应之后,会促使机体免疫系统向过度的代偿性抑炎反应综合症(CARS)过渡,导致系统性免疫抑制[20,25],表现为抑炎因子IL-10慢性升高,促炎因子TNF-α水平降至正常,外周血单核细胞的抗原提呈能力明显降低。 3.1.2 内毒素血症 内毒素攻击肝细胞的机制[28,29]:①降低肝脏腺苷酸和三磷酸腺苷/二磷酸腺苷比值,使能量代谢发生障碍;②下调巨噬细胞表面的清道夫受体的表达,降低巨噬细胞的吞噬功能,致使内毒素滞留于体内,导致肝脏发生微循环障碍;③与脂多糖结合蛋白形成复合物并与巨噬细胞表面受体(CD14)结合,使后者释放各种肝损伤因子和细胞因子;④诱导中性粒细胞向肝内聚集,并激活中性粒细胞;⑤上调共刺激因子CD80 与CD86 在肝细胞表面表达,参与导致大块肝细胞坏死的炎症过程;⑥作用于肝窦内皮细胞及微血管,引起肝微循环障碍,导致缺血缺氧性损伤。 3.1.3 微循环障碍 免疫损伤、肝细胞大块或亚大块坏死均可引起微循环障碍,从而造成局部组织缺血、缺氧,加重肝功能衰竭和肝细胞坏死[30,31]。 3.2 中医病因病机 3.2.1 病机特点及病理生理[32-34] (1)毒(热毒与湿热疫毒):①病毒、细菌、药物、肝毒性物质等;②内毒素血症;③过度炎症反应(凉血解毒药物可抑制过度免疫反应)。 (2)瘀:①肝纤维化、肝硬化的基础病变;②炎症导致的局部乃至全身微循环障碍;③肝细胞坏死导致的凝血功能异常。 (3)虚:①肝脏合成、代谢、免疫功能下降;②肝组织缺血、缺氧;③免疫抑制(B,Ⅰ)。 3.2.2 病机演变过程[33-36] (1)HBV ACLF患者以各自不同程度的毒(热毒与湿热疫毒)、瘀、虚组成主要病机,随着不同诱因、不同病程、不同病情(轻重)而变化,根据并发症、合并症的不同在不同病程中构成次要病机、兼夹病机。 (2)HBV ACLF的基本病机是本虚标实,随着病程而发生不同程度的虚实变化,并贯穿疾病的全过程,难以用单一病机进行解释。 (3)在疾病发生发展过程中,坏死期以正邪交争、气血两燔为主要病机,平台期以正亏邪盛、毒瘀互结为主要病机,终末期以毒瘀交阻,阴竭阳亡为主要病机,恢复期以气阴两虚、湿热残留为主要病机(图3)。 4.1 分期 推荐意见4(A-Ⅲ):根据临床表现,HBV ACLF可分为坏死期、平台期、终末期或恢复期四个不同的阶段,不同阶段具有不同的病理生理学特点。通过分期,可以明确疾病发生、发展的过程,有利于采取针对性干预策略。 聂广、高志良[37,38]按照本病的发生发展过程,提出了一个与与临床表现相结合的分期方案,今综合调整如下(图4)。 4.1.1 坏死期:分为坏死前期和坏死后期。坏死前期相当于慢加急性肝衰竭前期(Pre-ACLF),主要病理生理学特征是过度炎症反应,或称之为细胞因子风暴。坏死后期相当于慢加急性肝衰竭早期,即出现大量肝细胞坏死(大块和亚大块坏死)。中医病机为正邪交争(湿热毒瘀),气血两燔。 4.1.2 平台期:相当于慢加急性肝衰竭中期,以免疫抑制、器官功能紊乱为病理生理学特征,中医病机为邪实正损,毒瘀互结。由于过度炎症反应,导致系统性免疫抑制,此期最大的风险是感染。患者常常因为感染得不到控制而使病情再度加重,出现多脏器功能衰竭,进入终末期。 4.1.3 终末期:相当于慢加急性肝衰竭晚期,以多器官功能衰竭为病理生理学特征,中医病机为毒瘀交阻,阴竭阳亡。 4.1.4 恢复期:此期以肝细胞再生活跃为病理生理学特征,但仍需经过漫长的正邪交锋,才能使患者真正康复,中医病机为气阴两虚、湿热残留,体现出邪衰正复的病愈趋势。 坏死期(包括Pre-ACLF)和平台期是影响本病发生、发展的两个关键节点。如果应对得力,措施恰当,对提高HBV ACLF生存率至关重要。 4.2 分级 欧洲有一个标准,按照CLIF-OF诊断的慢加急性肝衰竭患者,通过衰竭脏器的数量将患者分为慢加急性肝衰竭Ⅰ级、Ⅱ级和Ⅲ级[39]。但这个标准的基础病变以酒精性肝病多见,且多数以肾衰竭为起始。国内采用COSSH-ACLF标准对HBV ACLF患者进行研究,HBV ACLF I级将单纯肝脏衰竭(总胆红素≥12mg/dL)合并INR≥1.5的患者纳入。根据COSSH-ACLF研究,乙肝ACLF I级 28天病死率为23.2%,90天病死率为35.9%;Ⅱ级28/90天病死率为60.5%和73.5%;III级28/90天病死率为93.1%和100%。 推荐意见5(A-Ⅱ):根据病情轻重,HBV ACLF可分Ⅰ级、Ⅱ级和Ⅲ级。I级为单纯肝脏衰竭(总胆红素≥12mg/dL)合并INR≥1.5;Ⅱ级为肝衰竭基础上合并1-2个脏器衰竭;Ⅲ级为多脏器功能衰竭。 病情分级对于预后判断和采取治疗策略(如肝移植)具有重要价值。此推荐意见可与我国现行的《肝衰竭诊疗指南》的早、中、晚分期标准[18]进行对照研究,从而确定一个更加符合HBV ACLF临床实际的分级标准。 4.2.1 Ⅰ级(即早期):①有极度乏力,并有明显厌食、呕吐和腹胀等严重消化道症状;②黄疸进行性加深(血清 TBIl≥171μmol/L 或每日上升≥17.1μmol/L);③有出血倾向,30% 4.2.2 Ⅱ级(即中期):在肝衰竭早期表现基础上,病情进一步发展,出现以下两条之一者:①出现Ⅱ度以下肝性脑病和(或)明显腹水、感染;②出血倾向明显(出血点或淤斑),20% 4.2.3 Ⅲ级(相当于晚期,但在并发症的数量上有区别):在肝衰竭中期表现基础上,病情进一步加重,有严重出血倾向(注射部位淤斑等),PTA≤20%,(或 INR≥2.6),并出现以下之一者:肝肾综合征、上消化道大出血、严重感染、Ⅱ度以上肝性脑病。 5.1 病理学诊断 5.1.1 HBV慢性肝炎基础上慢加急性肝衰竭[40]:病理发现不同程度的界面性肝炎或肝纤维化,只要任何一个肝小叶内发现坏死面积1/3-2/3的亚大块或 > 2/3的大块坏死即可诊断。 5.1.2 HBV相关肝硬化基础慢加急性肝衰竭:病理发现假小叶结构,肝移植或尸肝整体解剖或大块肝脏病理发现超过15%范围的肝实质亚大块(15%-90%)或大块(>90%)肝坏死[41]。HBV慢加急性肝衰竭基本伴有慢性的细胆管淤胆(ductular cholestasis)和以ck7免疫组化染色阳性为特征的肝祖细胞旺盛再生。 5.2 临床诊断 推荐意见6(A-Ⅲ):HBV ACLF诊断标准为:①黄疸迅速加深,血清TBil大于正常值上限10倍或每日上升≥17.1μmol/L;②出血倾向,PTA≤40%(或INR≥1.5),并排除其他原因者;③失代偿性腹水;④伴或不伴有肝性脑病;⑤极度乏力,有明显的消化道症状。 为了获得统一的CLIF诊断标准,可以考虑与APASL标准[3,4]、EASL-CLIF联盟标准[42]、世界胃肠病组织(WCG)标准[43]进行对照研究,最近国内提出了COSSH-ACLF诊断标准:①肝功能衰竭合并INR≥1.5或单肾衰竭或其他单个非肾脏脏器衰竭合并肾功能不全或I-II度肝性脑病。②六大脏器中出现两个或以上脏器衰竭。该标准基于多中心大样本数据,弥补了EASL-CLIF标准不适用于乙型肝炎人群的不足。 5.3 鉴别诊断 推荐意见7(A-Ⅲ):本病应与酒精性慢加急性肝衰竭、慢性肝衰竭、急性肝衰竭相鉴别。 5.3.1 酒精性慢加急性肝衰竭(A-ALCF):ACLF可见于多种慢性感染性或非感染性肝病终末期。HBV ACLF是东方型ACLF的主要发病类型,A-ALCF是西方型ACLF的主要发病类型。因此,基于二者病因方面存在明显差异,无论从临床特征、病理生理学以及诊疗措施上,可以说是两类不同临床综合征。研究发现,通过HBV抗病毒药物的诞生,通过早预防、早诊断、早治疗,改变HBV ACLF预后的可能性大于A-ALCF[2,20]。 5.3.2 慢性肝衰竭(CLIF):CLIF是在失代偿肝硬化基础上,肝功能缓慢进行性下降,直至不可逆性的肝衰竭,没有“过度炎症反应”所导致的肝脏大块或亚大块坏死的病理及相应的病理生理学改变[17,18]。而HBV ACLF是在慢性肝病患者肝脏功能变化处于相对稳定的状态下,因各种急性损伤,如HBV突破、特异性免疫应答激活、合并其他肝炎病毒感染、药物性肝损害、酒精性肝损害或身体其他部位的感染和炎症等,导致肝脏功能迅速恶化直至肝衰竭。 5.3.3 急性肝衰竭:急性肝功能衰竭[17,18]与HBV ACLF的区别主要在于有否原发病。肝穿刺证明几乎没有炎症和纤维化的慢性HBV携带者,如果由于重叠嗜肝病毒、或非嗜肝病毒、或细菌感染而导致的肝衰竭,仍然应该诊断为急性肝衰竭,而不是HBV ACLF。 6.1 一般处理 推荐意见8(A-Ⅲ):病情监护与营养疗法是提高HBV ACLF生存率具有重要措施,尤其是减少感染,在诊疗过程中至关重要。 6.1.1 病情监护[17,18] (1)卧床休息,减少体力消耗,减轻肝脏负担。 (2)加强病情监测,完善PTA/INR、血氨及血液生化的监测,对其他嗜肝病毒标志物、内毒素、自身免疫性肝病相关抗体等检测,以及腹部B超(肝胆脾胰、腹水)、胸部X线检查、心电图等相关检查。 (3)进行血气监测,注意纠正水电解质及酸碱平衡紊乱,特别要注意纠正低钠、低氯、低镁、低钾血症。 (4)注意消毒隔离,加强口腔护理及肠道管理,预防医院内感染发生。 (5)存在心血管、呼吸衰竭或Ⅲ~Ⅳ级肝性脑病(脑衰竭)的患者必须转入重症监护病房,存在肾衰竭的患者建议转入。肝脏和凝血功能衰竭的患者仍然可以在常规病房中治疗,但需要密切监测。在CANONIC研究中,50%的ACLF患者转入重症监护室(86%为ACLFⅢ级)。由于ACLF患者的死亡率高,ACLFⅡ级或入院后3-7天的Ⅲ级患者有必要接受重症监护以等待接受肝移植。 6.1.2 营养疗法[17,18] (1)推荐肠道内营养,包括高碳水化合物、低脂、适量蛋白饮食,提供每公斤体质量35~40kcal总热量,肝性脑病患者需限制经肠道蛋白摄人,进食不足者,每日静脉补给足够的热量、液体和维生素。 (2)积极纠正低蛋白血症,补充白蛋白或新鲜血浆,并酌情补充凝血因子。 6.2 病因学治疗 推荐意见9(A-Ⅰ):导致HBV ACLF发生的急性诱因是病因学治疗的关键环节。对于HBV复制活跃者,控制病毒为首选;对于合并细菌感染者,控制感染和消除内毒素非常重要;对于药物或化学毒物导致者,以人工肝等支持治疗为主,有待肝细胞再生。 6.2.1 抗HBV治疗 尽早给予抗病毒治疗,优先考虑使用耐药风险低的核苷(酸)类似物,如恩替卡韦、替诺福韦等一线药物[43-48]。 6.2.2 抗感染治疗 一旦出现感染,应首先根据经验选择抗菌药物,及时根据培养及药敏试验结果调整用药。可参考“终末期肝病合并感染诊治专家共识”[49],对不同部位感染使用强效或联合抗菌药物,应同时注意防治真菌二重感染。 预防性使用抗菌药物目前尚有争议,应遵循足量和短程原则,同时采取多环节控制医院感染的发生[50-52]。 6.3 免疫调节治疗 推荐意见10(B-Ⅱ):针对过激免疫反应,在坏死期早期(慢加急肝衰竭前期)推荐免疫抑制疗法;针对免疫低下状态,平台期和恢复期HBV ACLF患者应该考虑免疫增强疗法。 6.3.1 短程激素疗法 坏死早期HBV ACLF患者免疫反应过激,可考虑糖皮质激素具有抑制炎症,稳定肝细胞膜,阻止肝细胞进一步坏死的作用[53-56]。多项研究表明,在ACLF前期应用短程(3~5d)激素治疗,较对照组进展至ACLF 风险明显降低、生存率明显增高。但有明显出血倾向、严重细菌和真菌感染及疾病中晚期应避免使用。 6.3.2 免疫增强疗法 平台期和恢复期HBV ACLF患者,尤其是合并感染者,恢复免疫功能的治疗非常重要,如丙种球蛋白、胸腺肽α1等。最近的一项Meta分析显示,粒细胞集落刺激因子(G-CSF)可降低患者短期死亡率和肝肾综合征、肝性脑病和败血症的发生率,且副作用较轻[57]。为一项研究也证实了G-CSF在HBV ACLF患者中的生存优势[58]。但有学者强调,在ACLF的急性肝损伤期,或合并有败血症、严重溶血、以及巨噬细胞活化综合征的情况下,不应该使用G-CSF,因为此时机体内G-CSF或GM-CSF的水平已明显升高[59]。 6.4 人工肝支持治疗 推荐意见11(B-Ⅱ):各种人工肝支持疗法可能对清除肝衰竭时产生的毒素,降低促炎性细胞因子TNF-α、IL-10和IL-6的水平,减轻进一步肝损伤和全身炎症反应,改善肝性脑病有一定作用。应根据HBV ACLF患者不同时期、不同病情恰当地选择相应的人工肝支持疗法。 一篇Meta分析表明[60],人工肝可分别使ACLF患者短期(1个月和3个月)死亡风险降低30%,中期(6个月及1年)死亡风险降低30%,长期(3年)死亡风险降低50%。 6.4.1 非生物型人工肝(non-bioarticial liver,NBAL) 部分研究[61,62]证实NBAL联合内科综合治疗能有效改善肝功能,降低病死率。国内应用较为广泛的NBAL类型是血浆置换或选择性血浆置换,但由于目前血浆制品的紧缺,目前陆续出现了无血浆模式的NBAL和少血浆模式的NBAL。NBAL的适应症、相对禁忌症、并发症等参照2018年“肝衰竭诊治指南”[18]及2016年“非生物型人工肝支持系统治疗肝衰竭指南”[63]。 6.4.2 生物型及混合生物型人工肝支持系统 处于临床试验阶段,部分系统完成临床试验并证明了其对部分患者的有效性[64,65]。干细胞治疗在动物实验中获得了较好疗效,但在临床应用中尚缺乏足够的经验及证据[66-68]。 6.5 肝移植治疗 推荐意见11(B-Ⅱ):肝移植是目前公认治疗的ACLF最有效方法[69],可参照“中国肝移植乙型肝炎防治指南(2016版)”[70]、“肝衰竭诊治指南(2018年)”[18]和APASL“慢加急性肝衰竭共识”[71],根据适应症、禁忌症等恰当地选择肝移植治疗。 Finkenstedt 等[72]研究表明,ACLF患者肝移植后5 年生存率>80%。Artru等[73]发现,ACLF Ⅲ级患者在肝移植后一年的生存率为83.6%,但这些患者在肝移植后很容易发生并发症。在一些主要的移植接受者中心,ACLF患者的围手术期死亡率< 3%,1年生存率超过80%在[74]. 患者的长期生存率良好,5年生存率大于70%[75] 6.6 其它疗法 推荐意见12(C-Ⅲ):根据HBV ACLF患者不同时期、不同病情恰当地选择相应的改善凝血功能、抗炎保肝、微生态调节等相关疗法。 6.6.1 改善凝血功能 在活动性出血和严重凝血异常情况下,应考虑输入血小板、冷沉淀物(从血浆中制备的用于增加纤维蛋白原水平的冷冻血液制品)。 6.6.2 抗炎保肝 甘草酸制剂、水飞蓟素制剂、多烯磷脂酰胆碱及双环醇等,有不同程度的抗炎、抗氧化、保护肝细胞膜及细胞器等作用,临床应用可改善肝脏生化学指标[76]。 6.6.3 微生态调节 HBV ACLF患者存在肠道微生态失衡,可应用肠道微生态调节剂、乳果糖或拉克替醇,以减少肠道细菌易位或降低内毒素血症及肝性脑病的发生[18]。有报道粪便菌群移植(Faecal microbiota transplantation,FMT)作为一种治疗的新思路,可能优于单用益生菌[18]。 6.7 并发症治疗 推荐意见13(B-Ⅲ):根据平台期、终末期HBV ACLF患者的不同并发症,如脑水肿、肝性脑病、肝肾综合征、出血等,参考“肝衰竭诊治指南(2018年)”[18]和APASL“慢加急性肝衰竭共识”[71]采用相应治疗。 7.1 辨证治疗思路 7.1.1 采取分期辨证 推荐意见14(A-Ⅲ):鉴于分型辨证存在自身难以克服的逻辑学缺陷[33,34,77],本推荐意见推出分期辨证诊疗方案。其治疗学价值体现在:坏死期以过度炎症反应(或称“细胞因子风暴)为特征,采取免疫抑制的中西药物相互配合,如坏死前期使用短程激素,配合凉血解毒化瘀中药,可减少HBV ACLF的发生率和降低炎症反应的程度。平台期以免疫低下、器官功能紊乱为特征,通过益气温阳中药振奋正气,配合免疫增强剂可减少感染或提高其炎症干预效应,减少患者进展到终末期的比例。 推荐意见15(A-Ⅲ):根据临床表现和疾病演变过程,将患者病情区分为坏死期、平台期、终末期、恢复期4个不同的疾病阶段,采取证候学调查手段,统计本病各期的症状、特征出现的频率,确定主症、次症、兼夹症;根据“证素”理论确定本病各期的主要病机、次要病机、兼夹病机(与主症、次症、兼夹症对应);根据主要病机(主症)遣药组方(基本方),根据次要病机(次症)、兼夹病机(兼夹症)辨证加减[33,34,77]。在此基础上,构建中医药特色的分期辨证临床模式。 7.1.2 早期截断病势 推荐意见16(A-Ⅲ):本病的治疗关键在坏死期,截断“过度炎症反应”为重中之重,也是本病疗效突破的着眼点。姜春华教授“早用清热解毒、早用凉血活血、早用通腑攻下”,汪承柏教授重用赤芍,钱英、谌宁生教授的“截断逆挽法”,均是早期截断病势的经验总结。因此,早期重用清热利湿、凉血化瘀解毒方药,对减少HBV ACLF发生率、降低死亡率有重要作用,也是近年来多家医院中西医结合治疗和 “十一五”、“十二五” 国家重大专项的经验总结[78-86]。 7.1.3 中西取长补短 推荐意见17(A-Ⅲ):对于疾病早期的细胞因子风暴、凝血功能衰竭,以及平台期、终末期的耐药菌感染、内毒素血症、中毒性鼓肠等方面,西医尚无特效疗法。临床上,积极按中医理法方药角度遣药组方,并借鉴西医病理生理学指标,探讨凉血、解毒、通腑、扶正、温阳、通窍等中医药疗法的干预效应。 7.2 辨证论治 7.2.1 坏死期[87-99] (1)临床表现:身目俱黄,迅速加深,极度乏力,脘腹胀满,纳呆呕恶,小便短赤,大便溏稀或秘结,或鼻齿衄血、皮肤瘀斑、狂谵、胁下痞块,舌质绛红,瘀斑瘀点,脉弦数。 (2)基本病机:正邪交争,气血两燔(过度免疫反应、肝细胞坏死、凝血功能障碍)。 (3)基本治法:凉血解毒,荡涤湿热。 (4)基本方药:赤芍30-90g,茵陈30-45g,大黄10-15g,土茯苓30g,生地15g,郁金10g,栀子10g,厚朴15g。 (5)加减:如已用西药激素治疗,加石斛、砂仁、川芎、酸枣仁等以预防其消化道、血液、精神系统副作用;如大便秘结,加枳实、芒硝增添通腑之力;如纳差、腹胀,加神曲、佛手,以消食行气;如有精神亢奋、昏狂谵妄之态,加大黄、蒲公英、乌梅等煎液保留灌肠,或结肠透析,以增加排毒之功。 推荐意见18(B-Ⅲ):对HBV ACLF坏死期采取大剂凉血、解毒、通腑中药抑制过度肝细胞炎症反应,并根据患者个体体质、病情、急性诱因差异遣方用药,严格观察各种炎症因子变化情况。 7.2.2 平台期[100-111] (1)临床表现:身目黄染,色泽晦暗,腰膝酸软,神疲形衰,胁肋隐痛,失眠多梦,尿色深黄,或形寒肢冷,腹胀纳呆,但欲寐。舌质暗红,苔少,或舌淡胖有齿痕苔白腻,脉细涩,或沉迟。 (2)基本病机:正亏邪盛、毒瘀互结。 (3)基本治法:益气温阳,利湿退黄。 (4)基本方药:制附子20-60g,西洋参15-45g,茵陈30-60g,黄芪30g,白术20g,桂枝15g,赤芍30g,茯苓15g。 (5)加减:合并感染的患者,在抗生素等应用之时,如阴虚明显,根据“肝肾同源”、“肝体阴用阳”理论,加熟地黄、桑寄生、五味子等滋养肝肾药物调动机体生机和潜能;如脾肾阳虚明显,加菟丝子、淫羊霍等,以促进机体应激反应能力、改善细胞再生环境、提高机体免疫功能,预防由免疫抑制或低下而导致的感染。对感染患者,配合中药大黄、大青叶、土茯苓高位保留灌肠,以排除内毒素,减少其二次打击的可能性[112]。 推荐意见19(B-Ⅲ):在HBV-ACLF平台期,根据患者体质及免疫低下状况,以益气健脾、温阳扶元、养血柔肝、调达气机中药恢复机体正气和脏腑功能,预防院内感染,并密切观察临床症状体征及各种免疫学指标变化情况。 7.2.3 终末期 本病终末期,以毒瘀交阻,阴竭阳亡为主要病机,中西医干预疗效有限,主要是针对多脏器功能衰竭,各种并发症的处理。 (1)肝性脑病:①大黄煎剂(醋制大黄、乌梅)保留灌肠[112,113];②清开颗粒(制大黄、败酱草、石菖蒲)[114-116]口服;③安宫牛黄丸鼻饲,痰湿蒙塞清窍者可灌服苏合香丸。 (2)腹水[117]:参考中华中医药学会脾胃病专业委员会《肝硬化腹水中医诊疗规范专家共识意见》辨证论治。 (3)中毒性臌胀:①小承气汤加减(大黄、厚朴、枳实、莱菔子)灌肠[118]②温阳解毒化瘀方(茵陈、薏苡仁、白术、丹参、制附片、赤芍)口服[119];③清毒汤(黄连、大黄、厚朴、枳实、生地、玄参、乌梅、小蓟、茜草、血余炭)1剂/d,早晚分服,有助于协助清理肠源性内毒素[120]。 (4)上消化道出血:①三七粉:6g/次,胃肠道给药[121,122];②龙胆泻肝汤加减:龙胆草、黄芩、柴胡、当归、五倍子、白及、紫珠草、田三七、法半夏、乌贼骨、制大黄,每日1剂[123]。 推荐意见20(B-Ⅲ):根据标本主次、先后,按中医理法方药以及民间疗法应对各种急症,减少患者痛苦。 7.2.4 恢复期 (1)临床表现:黄疸下降,尿色渐淡,食欲好转,气力渐增,有时寐差,有时口苦,有时肝区不适,舌质红,苔白或薄腻,脉和缓。 (2)基本病机:气阴两虚、余邪残留。 (3)基本治法:益气养阴,兼清余邪。 (4)基本方药:黄芪20g,白术15g,茵陈15g,太子参15g,泽泻15g,茯神15g。 (5)加减:如睡眠欠佳,加酸枣仁、柏子仁等养心安神;如口苦、心烦,加栀子、豆豉清心除烦。 推荐意见21(B-Ⅲ):以益气健脾、温阳扶元、养血柔肝、调达气机中药恢复机体正气和脏腑功能,预防病情反复。 参考文献:具体见官方网站 起 草 组:聂 广 李秀惠 王宪波 李 海 陈 军 李 君 李 丽 王晓静 周尚琛 审 稿 组:王立福 王宇明 王融冰 毛德文 过建春 卢洪洲 吕文良 孙凤霞 孙克伟 刘 平 刘映霞 刘建平 刘寿荣 何 清 张明香 张建军 李 芹 李 慧 李 勇 李 筠 李晓东 吴其恺 陈建杰 宫 嫚 高月求 贾建伟 钟 森 钱 英 袁成民 黄加权 黄育华 夏瑾瑜 韩 涛 盛国光 童光东 潘 晨 扈晓宇 谭行华 薛博瑜 戴 炜2 原发基础病与急性诱因
3 发病机制与病机演变
4 分期与分级
5 诊断与鉴别诊断
6 西医治疗
7 中医药治疗

