红松松塔提取物多聚苯丙素-多糖复合物诱导人乳腺癌MCF-7细胞凋亡
安巍巍 唐雅莉 赵莲花 杨 悦 王新玲
近年来,肿瘤的发病率明显增高,而乳腺癌是女性最常见的恶性肿瘤之一[1-3]。在目前临床中,局部的手术范围日趋保守,化疗、放疗等综合治疗的有效性使得乳腺癌的长期生存率不断提高,但总生存率仍然不理想。因此,进一步研发乳腺癌的治疗方法和开发新的治疗方案仍然任重道远。
红松(Pinus Koraiensis Sieb.et Zucc)为我国东北的乡土树种。由于红松松塔没有可以入药的记载,国内对红松松塔还缺乏系统的药理活性研究。国外的研究证明松塔提取物多聚苯丙素-多糖复合物(Polyphenylpropenoid-polysaccharide complex,PPC)可激活人体内的免疫细胞,尤其是树突状细胞,发挥增强人体自身免疫力的作用[4-5],而且在研究中发现不同种属松塔的提取物均可发挥相似的作用。我们前期的研究也证明红松松塔的提取物可抑制S180荷瘤小鼠的肿瘤生长[6]。本研究以乳腺癌细胞MCF-7为研究对象,考察PPC诱导细胞凋亡的机制,为PPC的进一步开发和利用提供实验依据。
1 材料和方法
1.1 材料
人乳腺癌细胞株MCF-7购自黑龙江省肿瘤防治研究所;红松松塔采自黑龙江省伊春市;MTT和Hoechst 33258购自碧云天生物公司;胎牛血清购自美国GIBCO公司;α-MEM培养基购自美国GIBCO公司;Cell death detection kit购自美国Roche公司;Caspase-3 Colorimetric Assay和Caspase-9 Colorimetric Assay购自美国Millipore公司;Caspase-3多克隆抗兔抗体购自美国Cell signaling公司;Caspase-3抑制剂(z-DEVE-fmk)购自美国Calbiochem公司;辣根过氧化酶标记的养抗兔二抗购自碧云天生物公司。其他常用试剂均为分子生物学实验适用级别试剂。
1.2 方法
1.2.1 红松松塔PPC的制备 按文献报道进行制备。简述如下:红松松塔简单分解后进行清洗,干燥,粉碎。将粉末与0.1 m NaOH按固液比1∶5混合,加压提取2 h,过滤除去固体粉末,滤液以10 000 rpm离心15 min,取上清,调节pH7.0,过滤除菌,PPC浓度以μg/mL表示。
1.2.2 细胞培养 MCF-7细胞接种在含10%胎牛血清的α-MEM培养液中,在饱和湿度,温度为37℃,5% CO2培养箱中培养,2~3天传代。
1.2.3 MCF-7细胞生长抑制实验[7]取处于对数生长期的细胞,调整密度为5×104个细胞/mL,以每孔100 μL接种于96孔板。接种的同时加入PPC终浓度50、100、150和200 μg/mL。然后在培养24、48、72和96 h后,使用MTT法测定吸光度值,计算生长抑制率(以0时间或未处理细胞作为对照)。
1.2.4 细胞核荧光染色[8]取处于对数生长期的细胞,调整密度为5×104个细胞/mL,使用PPC处理细胞后48 h,收集细胞,1 000 rpm离心5 min,用PBS洗2次,以100 μL 4%的多聚甲醛重悬细胞,4℃固定1 h,1000 rpm离心3 min,弃上清,用PBS洗1次。使用10 μL PBS重悬细胞,加入Hoechst 33258,终浓度167 μM,37℃孵育10 min后,置于载玻片上,封片,荧光显微镜下观察,并拍照。
1.2.5 DNA片段化分析测定细胞凋亡 取处于对数生长期的细胞,调整密度为5×104个细胞/mL,使用PPC处理细胞后48 h,收集细胞,1 000 rpm离心5 min,用PBS洗2次,按文献方法提取DNA[9]:加入100 μL细胞裂解液(10 mM Tris-HCl pH 7.4,10 mM EDTA pH 8.0,0.5%Triton X-100)4℃裂解30 min,25 000×g离心20 min,收集上清液。加入40 ng.L-1Nase A,37℃孵育1 h,再加入40 ng.L-1proteinase K,37℃孵育2 h,加入20 μL 5M NaCl和120 μL异丙醇,-20℃过夜。25 000×g离心20 min,收集沉淀,以Tris-EDTA缓冲液(pH7.5)溶解。提出的DNA用2%琼脂糖凝胶在100 V下电泳1 h,以0.5 μg.mL-1溴化乙锭染色20 min,以蒸馏水洗10 min,使用凝胶自动成像拍照。
1.2.6 细胞凋亡检测 取处于对数生长期的细胞,调整密度为5×104个细胞/mL,在有和无z-DEVE-fmk(20 μM)条件下使用PPC处理细胞后24、48和72 h,按说明书所述进行细胞凋亡检测。
1.2.7 Caspase-3和Caspase-9酶活力检测 取处于对数生长期的细胞,调整密度为5×104个细胞/mL,在使用PPC(终浓度50、100和200 μg/mL)处理细胞48 h后,收集细胞。按试剂盒方法进行酶活力检测。
1.2.8 Caspase-3蛋白表达分析[10]取处于对数生长期的细胞,调整密度为5×104个细胞/mL,在有和无z-DEVE-fmk(20 μM)条件下使用PPC(终浓度50、100和200 μg/mL)处理细胞48 h后,收集细胞,按常规方法裂解细胞,测定蛋白浓度,以30 μg蛋白上样后,进行SDS-聚丙烯酰胺电泳,分离蛋白。转移到NC膜后,封闭、加入一抗和二抗后,使用ECL增强化学发光方法显色。
1.3 统计学处理
数据分析采用SPSS 17.0软件,不同时间重复测量资料的差异分析采用重复测量方差分析。采用t检验和方差分析比较连续性变量在各组中的差异,P<0.05为差异有统计学意义。
2 结果
2.1 PPC对MCF-7细胞的生长抑制作用
不同浓度的PPC处理细胞不同时间后使用MTT法检测细胞抑制率。重复测量方差分析结果显示时间和浓度分组的交互作用无统计学意义(P=0.351),说明时间因素的作用不随着浓度分组的不同而不同。48 h处理时间的抑制率显著高于24 h;不同浓度两两比较,除25 μg/mL与50 μg/mL浓度无差别外,其余比较均可见差别。使用不同浓度、不同时间的抑制率作图,可见浓度100 μg/mL(不同时间)或时间48 h(不同浓度)的结果稳定(图1)。因此,本研究选择48 h处理时间点及100 μg/mL进行后续实验。
2.2 PPC诱导MCF-7细胞凋亡
PPC(100 μg/mL)处理细胞后,使用细胞凋亡试剂盒检测吸光度值。重复测量数据方差分析结果显示时间因素有统计学意义(F=64.75,P=0.014);不同时间两两比较结果显示,除48 h与72 h无统计学差异,其余均有统计学差异(P<0.05),即吸光度(凋亡比例)随时间延长而增加,说明PPC可诱导细胞时间依赖性凋亡(图2A);DNA Ladder结果可见典型的细胞凋亡后DNA断裂形成的条带(图2B);Hoechst 33258染色表明,正常细胞全部蓝染,细胞壁完整(图2C),而PPC处理MCF-7细胞后,细胞核破碎后形成凋亡小体,即形成小的致密蓝染(箭头所示),是细胞发生凋亡的典型形态(图2D)。
2.3 Caspase-3和Caspase-9酶活力增加
PPC(100 μg/mL)处理细胞48 h后,使用Caspase activity detection kit检测Caspase-3和Caspase-9酶活力(n=3)。结果可见PPC处理后MCF-7细胞的Caspase-3和Caspase-9酶活力有增加趋势,但无统计学差异,可能是由于样本量较小(图3)。
2.4 Caspse-3前体酶蛋白表达减少
PPC(100 μg/mL)处理MCF-7细胞不同时间后,蛋白质电泳的结果可见Caspase-3前体酶的蛋白表达降低(P<0.05),说明PPC处理后Caspase-3酶活化(图4)。
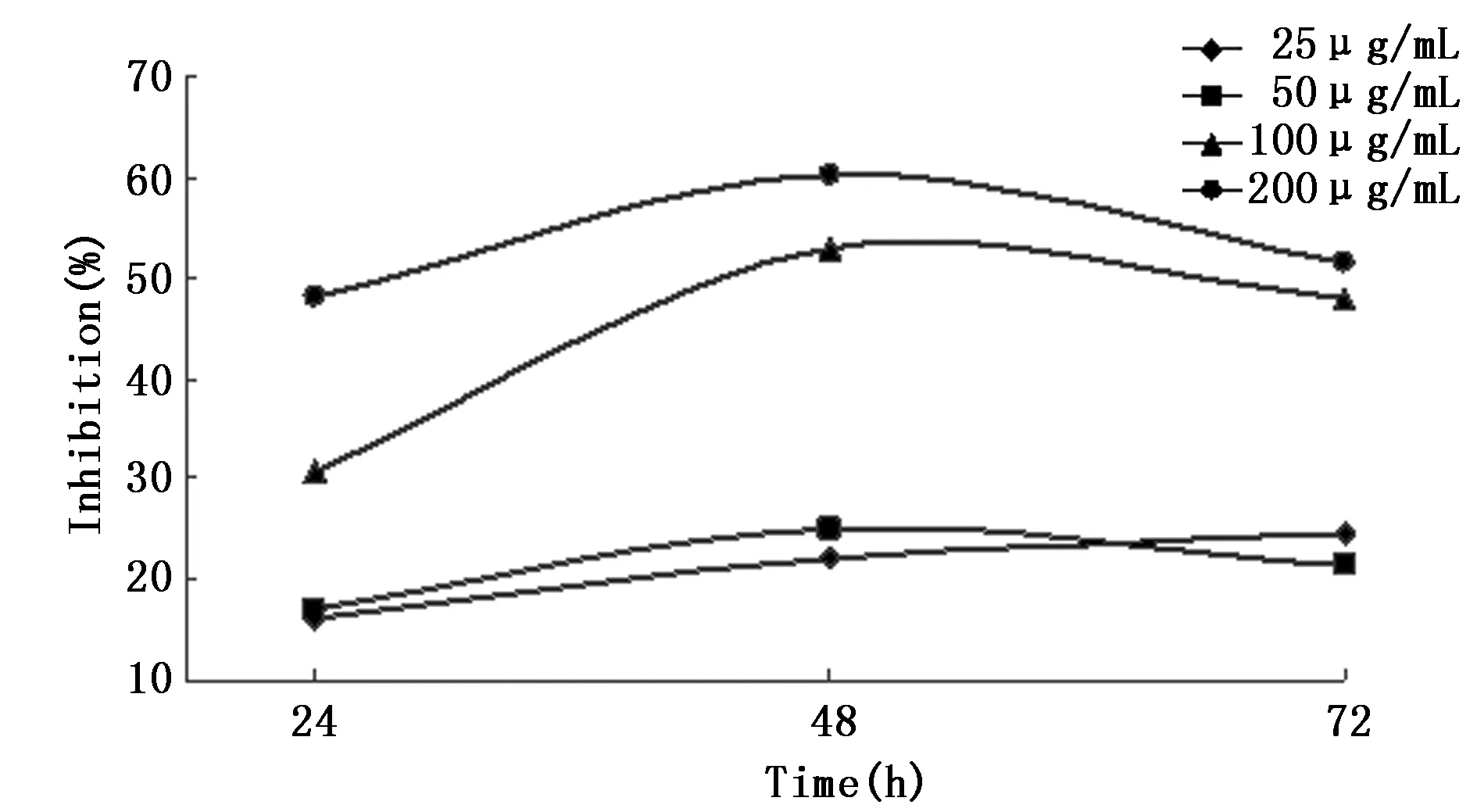
图1 PPC对MCF-7细胞的生长抑制作用Figure 1 Inhibitory effect of PPC on proliferation of MCF-7 cells
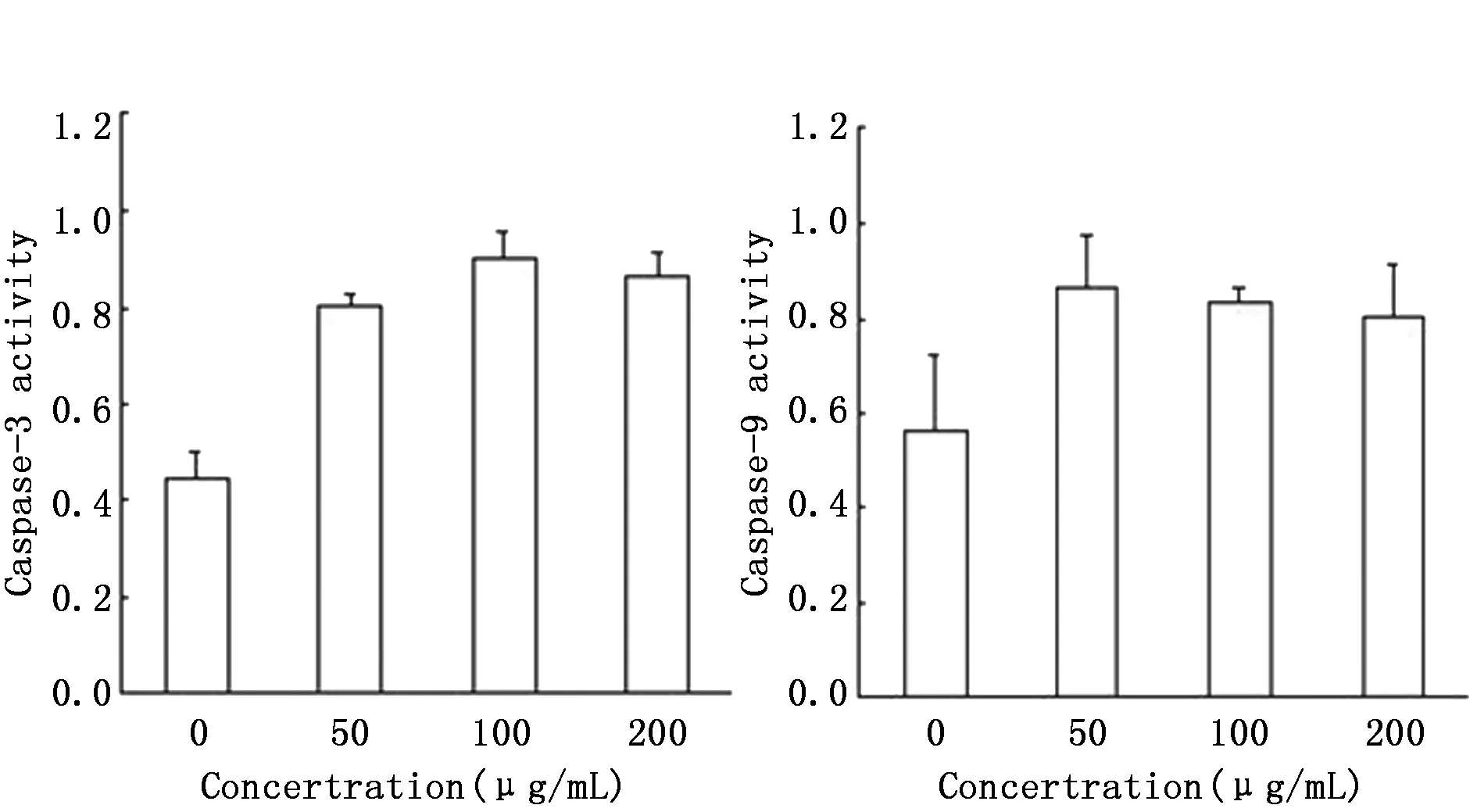
图3 PPC处理后细胞中caspase-3和caspase-9的酶活力Figure 3 Activities of caspase-3 and-9 in MCF-7 cells treated with PPC

图4 PPC处理后对Caspase-3前体酶蛋白表达的影响Figure 4 Effect of PPC on the expression of pro-caspase-3 protein in MCF-7 cells
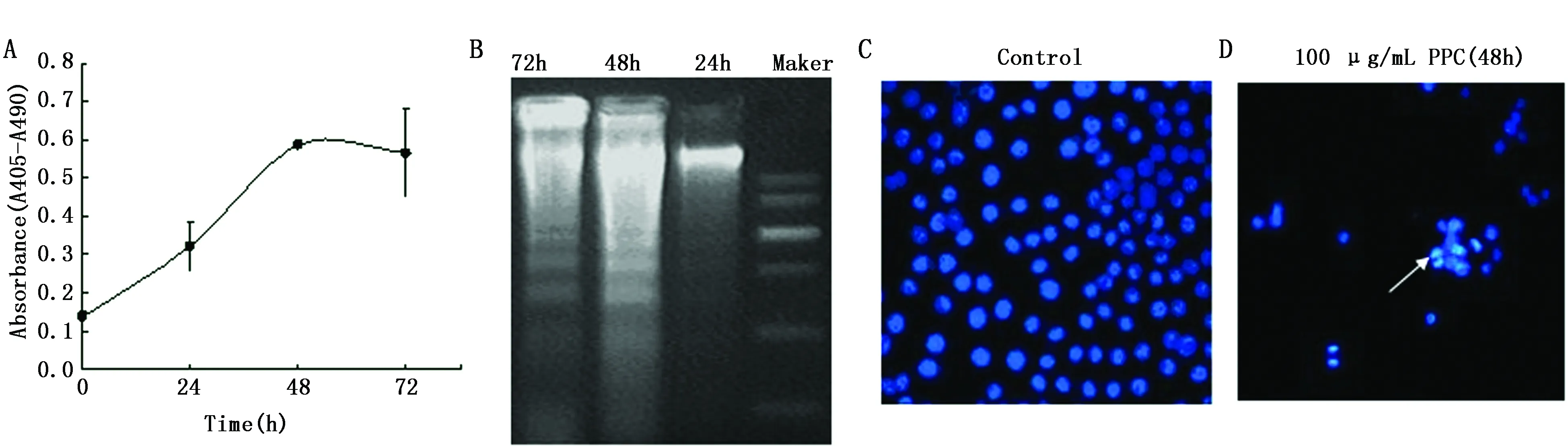
图2 PPC处理后MCF-7细胞生长抑制的作用模式(凋亡)Figure 2 Apoptosis of MCF-7 cells induced by PPCNote:A.Cell apoptosis was detected by a cell death detection kit;B.DNA fragmentation;C.Control cells;D.Nuclear staining with Hoechst33258(cells treated with 100 μg/mL of PPC for 48 h).
2.5 Caspse-3抑制剂部分抑制细胞凋亡
在有和无z-DEVE-fmk(20 μM)条件下使用PPC(100 μg/mL)处理MCF-7细胞48 h后,细胞凋亡检测可见细胞凋亡被部分抑制;蛋白质电泳的结果可见,PPC处理细胞Caspase-3前体酶的蛋白表达降低(P<0.05),而z-DEVE-fmk和PPC同时处理细胞时Caspase-3前体酶的蛋白表达恢复,进一步证明PPC处理后Caspase-3酶的活化(图5)。

图5 Caspase-3抑制剂z-DEVE-fmk对PPC处理诱导的细胞凋亡和Caspase-3前体酶蛋白表达的影响Figure 5 Effect of caspase-3 inhibitor(z-DEVE-fmk)on PCC-induced apoptosis and expression of pro-caspase-3 protein in MCF-7 cellsNote:A.Cell apoptosis was detected by a cell death detection kit;B.The expression of pro-caspase-3 protein was detected by Western blot.Con.Control;1.z-DWVE-fmk;2.PPC;3.PPC+ z-DWVE-fmk;*P<0.05,compared with the control group.
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,其发生发展与肿瘤细胞的恶性增殖和凋亡有关。随着对细胞凋亡研究的深入,现已证明细胞凋亡受阻可能是肿瘤发病机制之一,这就使采用新的药物诱导细胞凋亡来治疗这一疾病成为一种可行的办法[11-13]。细胞凋亡是细胞在一定的生理或病理条件下,遵循自身程序,由基因控制的细胞自主性死亡过程,具有独特的形态和生化特征。
基于文献报道和我们的研究结果,我们考察了PPC对乳腺癌细胞MCF-7的细胞毒作用及其作用机制。研究发现,PPC可抑制MCF-7细胞的生长,且有浓度和时间依赖性。细胞形态学的变化是判断细胞发生凋亡的最直观方法[14]。Hoechst 33258荧光染色法显示PPC处理的MCF-7细胞可见核浓缩的强蓝色荧光团块及细胞皱缩、核碎裂、凋亡小体等凋亡形态学改变,而对照细胞则显示为全部蓝染。DNA ladder的形成与细胞凋亡密不可分,同时也是判断细胞凋亡的重要标准之一[15]。PPC作用于MCF-7细胞后,在琼脂糖凝胶电泳上产生核酸片段条带。以上研究结果提示,PPC可诱导MCF-7细胞凋亡。
尽管凋亡的分子机制还不完全清楚,但已认识到凋亡过程受相关蛋白的调节和控制[16]。Caspase在细胞凋亡过程中起着主导作用[17],其中,Caspase-3是Caspase家族中最重要的凋亡执行者,是细胞凋亡蛋白酶级联反应的必经之路,在细胞凋亡过程中居中心地位;而Caspase-9是线粒体凋亡途径的重要“启动者”[20]。本研究结果表明,PPC诱导MCF-7细胞凋亡时Caspase-3和Caspase-9的酶活力升高,Caspase-3前体酶蛋白表达下降,即表示Caspase-3酶发生活化,而且Caspase-3抑制剂z-DEVE-fmk可部分抑制PPC诱导的MCF-7细胞凋亡,并可恢复Caspase-3前体酶蛋白表达。因此PPC可能通过激活Caspase家族诱导MCF-7细胞凋亡。以上研究结果表明PPC可能具有潜在的乳腺癌治疗作用,但仍需要对包括体内抑瘤作用等方面进一步研究。

