外周血STAT1,STAT3基因启动子CpG岛甲基化状态与大肠癌预后关系的研究
普 睿 朱 琳 夏婷婷 毕皓然 孙鸿儒 黄 浩 张 磊 赵亚双
大肠癌(Colorectal cancer,CRC)是常见的消化道恶性肿瘤之一,全球每年死于大肠癌的患者高达800 792人,其死亡率在死亡顺位上排在第二位。在我国,大肠癌的死亡率位列全部肿瘤死亡率的第三位,大肠癌患者平均5年生存率仅为56.9%左右[1]。目前,影响大肠癌预后生存的因素主要包括遗传学和表观遗传因素及临床病理因素等,但机制尚不明确[2]。近年来,大量独立的试验研究结果提示,特异性DNA甲基化可作为判断大肠癌患者预后的生物标志物。JAK-STAT信号通路的异常激活会导致细胞周期的失调,影响肿瘤细胞浸润转移,影响患者的存活状态[3]。
因此,本研究在239例大肠癌术后患者的队列中检测JAK-STAT通路主要基因STAT1及STAT3基因甲基化状态并分析其与大肠癌预后的关系,并进一步分析影响大肠癌患者的预后因素。
1 资料与方法
1.1 资料来源
收集2004年7月—2005年7月与2007年5月—2008年1月期间在哈尔滨医科大学附属肿瘤医院接受手术治疗的,经病理确诊为原发性散发大肠癌患者。入院后记录患者的一般人口学资料及临床病理资料,采集术前静脉血液样本5 mL,排除患者手术前进行过放化疗的病例、术后30天之内死亡的病例。术后对患者每年进行一次电话随访,记录患者的生存情况,最后一次随访日期是2014年3月15日。总生存时间为患者接受手术后第一天直至死亡或失访或到最后一次随访时间。死亡病例信息由家属或相应的联系人提供。
1.2 研究方法
采用特异性高分辨率熔解曲线(MS-HRM)分析,通过与标准品熔解曲线比较位置和形状间的差异,检测特定基因的甲基化程度。
1.3 统计学方法
运用SPSS 23.0统计学软件进行数据处理,采用Kaplan-Meier法计算生存时间,并绘制生存曲线,生存曲线的比较采用Log-rank检验。应用单因素及多因素Cox比例风险模型分析STAT1,STAT3基因甲基化状态以及临床病理因素与大肠癌预后之间的关系,P<0.05为差异有统计学意义。
2 结果
2.1 一般人口学资料
本研究共纳入239名大肠癌患者,男性147例(61.50%),女性92例(38.50%),年龄25~78(56.60±11.60)岁,对全部研究对象随访,随访过程中124人(51.90%)存活,96人(40.20%)死亡,19人(7.90%)失访,全部研究对象的基本特征见表1。
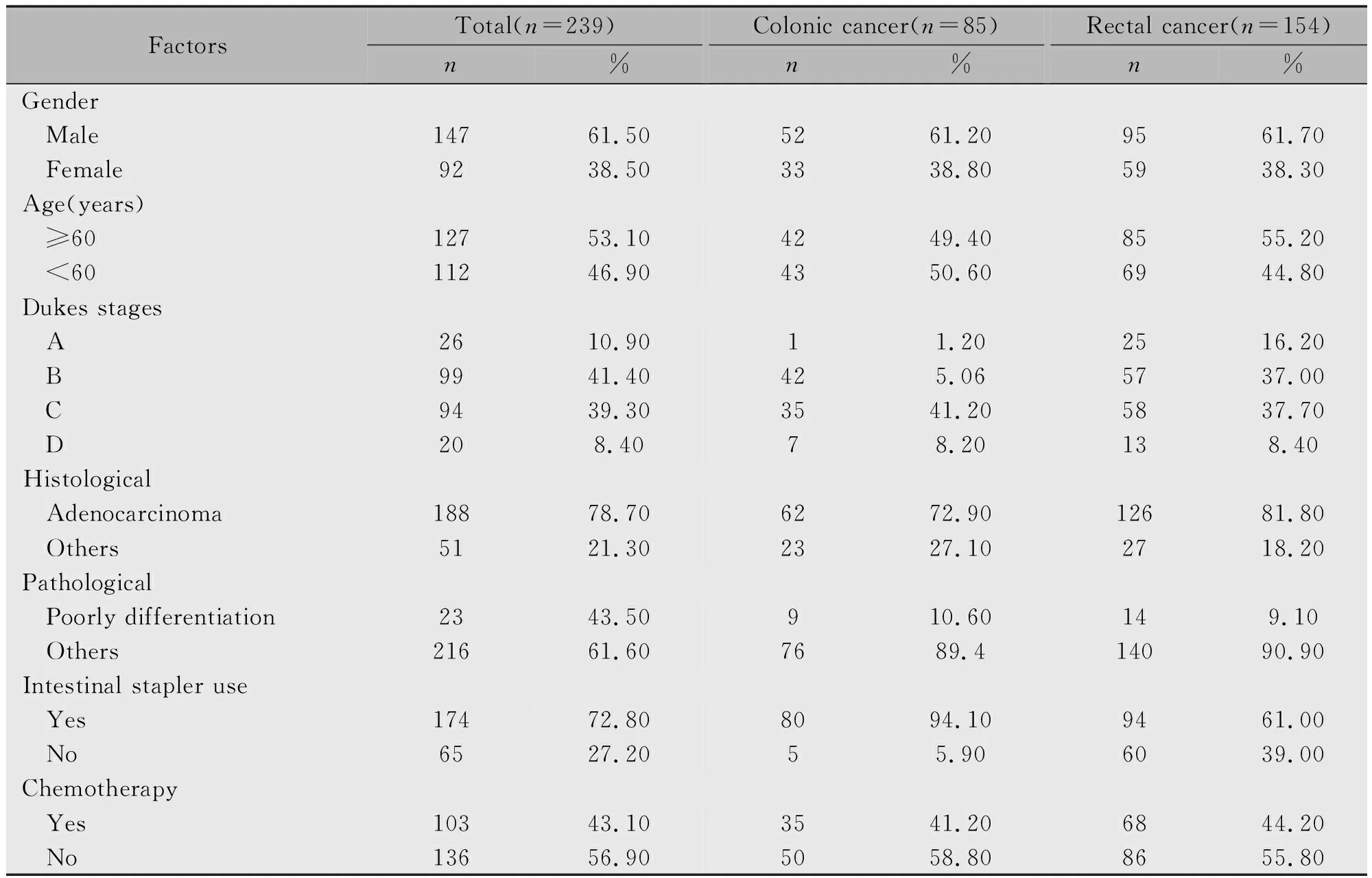
表1 研究对象的一般人口学特征
2.2 患者生存率
本研究纳入239例大肠癌术后患者,中位总生存时间为83个月,1年生存率为94.90%,3年生存率为86.00%,5年生存率为67.20%(表2)。
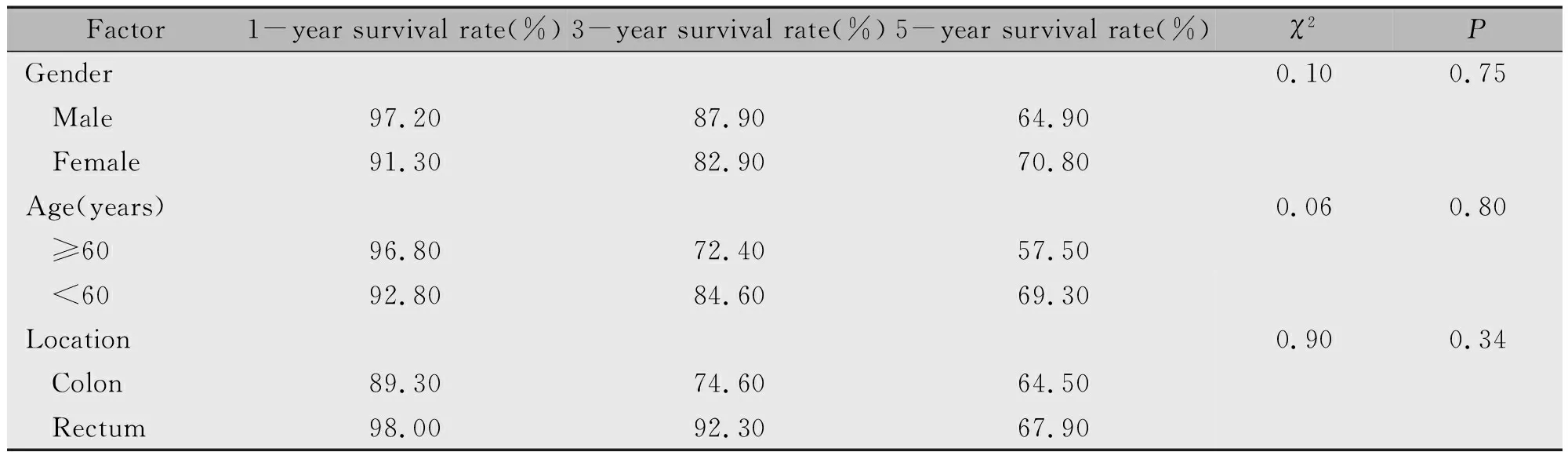
表2 大肠癌患者不同性别、年龄、部位的生存率
2.3 影响大肠癌预后生存的单因素分析
2.3.1 STAT1,STAT3基因与大肠癌预后的单因素分析 经Log-Rank检验和Cox单因素分析显示,STAT1,STAT3基因甲基化状态与大肠癌预后总生存时间无关(图1-2,表3)。
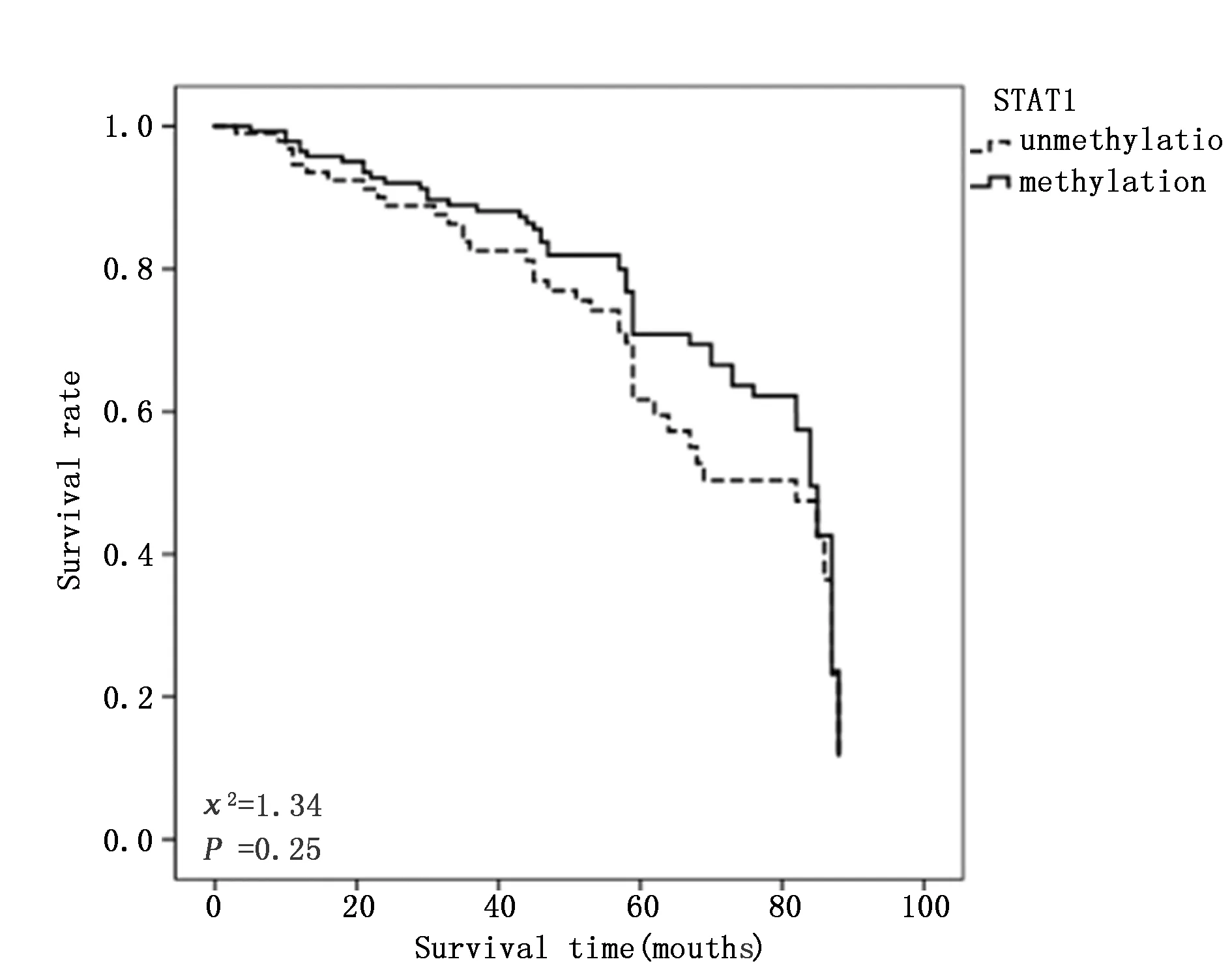
图1 大肠癌患者外周血STAT1基因甲基化状态与预后Figure 1 Methylation status and prognosis of STAT1 gene in peripheral blood of patients with colorectal cancer
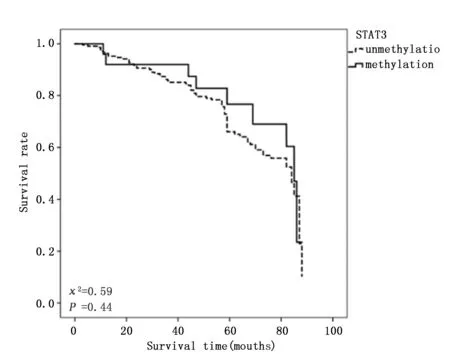
图2 大肠癌患者外周血STAT3基因甲基化状态与预后Figure 2 Methylation status and prognosis of STAT3 gene in peripheral blood of patients with colorectal cancer

表3 STAT1,STAT3基因与大肠癌预后关系分析
2.3.2 临床病理因素与大肠癌预后的单因素分析 将一般人口学资料和临床病理因素纳入单因素Cox比例风险模型,结果显示术中使用肠吻合器和Dukes分期可能与大肠癌患者预后有关(表4)。

表4 临床病理因素与大肠癌预后关系的生存分析
2.4 影响大肠癌预后生存的多因素分析
将单因素分析存在统计学差异的临床病理学因素及STAT1和STAT3基因甲基化情况纳入多因素Cox比例风险模型分析。结果显示,术中肠吻合器的使用和Dukes分期为大肠癌患者预后的影响因素,STAT1和STAT3基因甲基化状态与大肠癌预后状态无关(表5)。
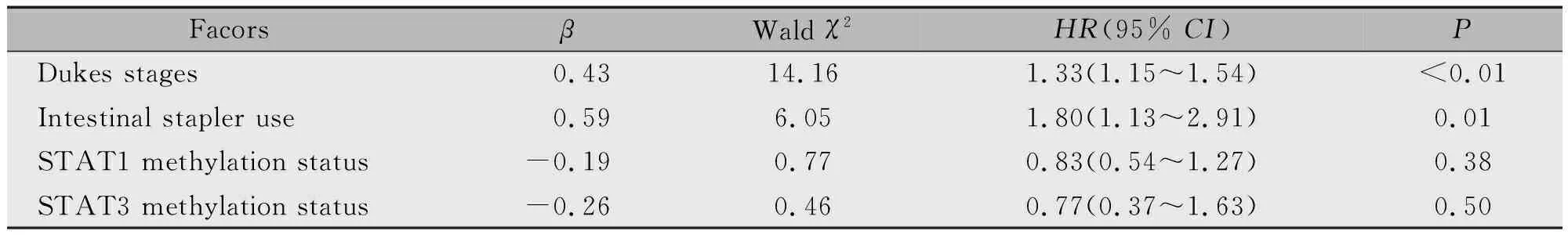
表5 大肠癌预后生存的多因素生存分析
3 讨论
近年来,虽然大肠癌的死亡率在全球范围内呈下降趋势,但发展中国家大肠癌的死亡人数占全球的52%,且生存率徘徊在22.5%~65%[4]。马来亚大学医学中心(UMMC)进行的一项双向队列研究表明与马来人和印度人相比,中国患者的5年生存率最低[5]。研究大肠癌患者术后生存的影响因素,可作为临床诊治方案的参考,对于提升患者生命质量有重要意义。
大肠癌的侵袭、复发、转移是多步骤、多因素、多基因的复杂过程,每一阶段都受多种基因/蛋白质的调控。DNA甲基化主要发生在编码基因启动子区CpG岛上,其可以通过抑制DNA与转录因子的识别与结合、促进CpG结合蛋白向基因启动子区募集等机制抑制基因转录,使相应的基因表达下调或不表达。一般来说,DNA甲基化程度越高,这段DNA被转录成RNA并翻译成有功能蛋白质的可能性就越小。JAK-STAT信号通路的异常激活导致细胞周期的失调,因而与大肠癌的发生、发展、侵袭等密切相关。研究发现,在大肠癌组织中JAK及STAT持续激活,而在正常上皮中缺失,同时结果显示抑制JAK-STAT信号的活化能抑制肿瘤增殖和生长[6-9]。在微阵列免疫组织化学分析对414例大肠癌肿瘤样本进行的检测中发现:高STAT1活性与患者总体存活率较高显著相关,STAT3高表达与大肠癌患者总生存期增加约30个月相关,STAT3被确定为预测疾病结果的独立因子[10]。另外,在104例晚期直肠癌中磷酸化STAT3(p-STAT3)的核免疫组化表达的研究中,结果显示具有p-STAT3阳性的肿瘤的患者具有较高的总体存活率[11]。而IGF2BP3基因参与细胞生长和迁移,已被证明是一种参与癌症发生发展的原癌基因,且甲基化状态可作为指导结直肠癌分化和预后的生物学标志物[12]。JAK-STAT通路与其有相似的生物学作用,故本研究选择JAK-STAT通路内的STAT1和STAT3基因进行甲基化的检测。
本研究239例大肠癌患者切除术后5年生存率为67.20%。该结果与国内蔡善荣等人报道842例大肠癌患者的5年生存率为66.30%以及与韩国Park等报道的2 230例大肠癌的5年生存率为67.20%相近[2,13]。
本研究结果显示,性别、年龄、肿瘤部位、肿瘤大体分型、组织学分型、术后化疗、STAT1以及STAT3基因甲基化状态与大肠癌患者术后生存率无相关性。Dukes分期是反映肿瘤浸润深度、淋巴结转移和远处转移的综合指标,许多研究已证实,Dukes分期是大肠癌预后的重要影响因素,生存率随Dukes分期依次下降[14]。杨艳芳等人的研究结果显示,Dukes分期每增加一期,其死亡风险即为上一期的3.06倍[15]。本研究显示Dukes分期不仅是影响大肠癌预后的独立因素,在多因素分析中也对患者生存期产生影响,与A期和B期患者相比,C期和D期患者死亡风险增加了0.33倍。由此我们推测,Dukes分期可作为推测大肠癌患者临床结局的可靠指标。
鲜有研究数据关于吻合器应用对大肠癌治愈率和生存率的影响,我们的结果表明使用肠吻合器患者的5年生存率是74.60%,不使用肠吻合器患者的5年生存率是47.50%。已有资料显示吻合器的广泛应用使低位直肠癌手术的保肛率增加,管状吻合器在大肠癌合并梗阻时的应用中,可缩短手术时间,减少深部操作的困难,减少并发症的发生,提高生存率[16]。邓纯禹[17]对比了手工缝合治疗和使用直肠吻合器的低位直肠癌前切除术患者共70例,经生活质量评分表调查显示使用肠吻合器患者各项评分均优于手工缝合治疗患者,而且降低了术后吻合口漏的并发症发生率,对于术者来说,使用肠吻合器也更加方便、安全,降低手术难度。据此我们推测,肠吻合器的使用通过提高患者术后生活质量,从而影响到预后生存期,更多的资料和证据尚待进一步研究。
本研究首次在中国人群中检测外周血STAT1,STAT3基因甲基化状态与大肠癌预后的关系,但尚未发现有统计学意义,需要更大样本的研究来证实。我们的研究结果显示Dukes分期和术中肠吻合器的使用是影响大肠癌患者预后的重要因素,我们需要同时考虑肿瘤的大小、浸润深度、分化程度、手术方法以及患者的健康水平等[18]。
综上所述,大肠癌患者中Dukes分期为更高者死亡风险增加,术中使用肠吻合器患者预后优于未使用者,外周血STAT1,STAT3基因甲基化状态尚不能作为影响大肠癌患者预后的生物标志物,仍需要更大样本的深入研究。

