MAGEA4和EB1蛋白在肺癌组织中的表达及其与临床病理特征及预后的相关性分析
刘金涛 高 玲 周会会
肺癌是最普遍的恶性肿瘤之一,肺癌的复发和转移显著影响患者的预后,因此,发现早期标记物对肺癌临床治疗早期疗效的判断具有重要意义[1-2]。黑素瘤抗原家族A4(Melanoma antigen family A4,MAGEA4)在各种恶性肿瘤中表达,MAGEA4被广泛用作癌症疫苗治疗的靶标[3-4]。MAGEA4可作为调节性T细胞(Tregs)发育和功能的主要调节剂[5-6]。人末端结合蛋白1(Human end-binding protein 1,EB1)最初被鉴定为腺瘤性结肠息肉(APC)的相互作用配偶体,其作用是增强结肠直肠癌中的APC功能[7-8]。最近的研究表明,EB1与各种系统中的微管介导的细胞活动有关,包括迁移、细胞分裂和形态发生。值得注意的是,据报道EB1在胃腺癌、肝细胞癌、食道鳞状细胞癌和乳腺癌中过表达[9]。本研究拟探讨MAGEA4和EB1蛋白在肺癌组织中的表达及其与临床病理特征及预后的相关性,为肺癌的诊治提供依据。
1 资料与方法
1.1 一般资料
2010年3月—2012年5月在我院胸外科行手术切除并经病理证实的肺癌患者136例为研究对象,符合美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)公布的2012版《NCCNCRC诊治指南》中的诊断标准[10]。手术中切除标本后行病理检查以判定临床病理特征。同时取距肺癌组织5 cm以上的正常肺组织为癌旁组织。患者自愿提供病理及正常肺组织,用作分析MAGEA4、EB1 mRNA、蛋白的表达及与临床病理特征的关系。该研究经本院医学伦理协会批准,患者及家属签署知情同意书。
1.2 MAGEA4和EB1 mRNA在肺癌组织及癌旁组织中表达的测定
使用RNeasy Mini Kit,根据制造商的说明书从肺癌组织及癌旁组织中提取总RNA,并用RQ1 RNase-Free DNase消化。然后使用Superscript II或Superscript VILO cDNA合成试剂盒从2 μg RNA逆转录cDNA,并用核糖核酸酶H消化。然后使用MAGEA4正向引物,5′-ATGTCTTCTGAGCAGAAGAGTCAGC-3′和MAGEA4反向引物,5′-TCAGACTCCCTCTTCCTCCTCT-3′;EB1正向引物,5′-ACCTAGGCTGCAGAAGACTTAG-3′和MAGEA4反向引物,5′-TCAGACTCACC-3′,内参基因为β-肌动蛋白,其正向引物序列为5′-CCAGGCTGTGCTATCCCTGTACGC-3′和反向引物5′-ACCGGAGTCCATCACGATGC-3′。用GoTaq DNA聚合酶扩增MAGEA4、EB1。反应包括94℃预热5min和94℃下变性30 s 30个循环,60.4℃退火30 s,72℃延伸1 min,然后在72℃延伸5 min。使用PowerSYBR®-Green PCR Master Mix,通过ABI PRISM7000上的定量RT-PCR评估MAGEA4、EB1表达,β-肌动蛋白作为内容基因,在与β-肌动蛋白比较后使用2-ΔΔCT方法计算相对表达。
1.3 MAGEA4和EB1蛋白在病理组织及癌旁组织中表达的测定
通过基于链霉抗生物素蛋白、生物素和过氧化物酶的免疫组织化学评估MAGEA4、EB1蛋白在肺癌组织和癌旁组织中的表达。病理组织、癌旁组织常规福尔马林固定,石蜡包埋、切片,在二甲苯中脱蜡并在一系列分级醇中脱水。然后将切片热固定并阻断过氧化物酶活性,然后与蛋白质封闭溶液一起温育。将样品切片在4℃下用针对MAGEA4的单克隆抗体以1∶2000的稀释度标记过夜。为了染色EB1,将样品在室温下用针对人EB1的小鼠单克隆抗体标记1 h。洗涤后,将切片在室温下与过氧化物酶标记的山羊抗小鼠和抗兔多克隆IgG(Fab′)一起孵育30 min,然后与Histofne Simple Stain MAXPO(MULTI)一起孵育。进一步洗涤后,用新鲜制备的3,3′二氨基联苯胺四盐酸盐观察样品,用苏木精复染并固定。用1∶20稀释度的小鼠同种型IgG1和IgG2a混合物探测的Secimens用作阴性对照,而正常人睾丸用作阳性对照。使用双盲法评估所有载玻片。对于每个切片,选择5个高倍视野(400×放大倍数)并在每个视野中计数100个肿瘤细胞。将染色强度和阳性面积百分比组合以解释MAGEA4、EB1免疫组织化学反应性。如下,染色强度:0=无染色,1=灰色,2=黄色,3=棕色;阳性区域:0表示≤5%,1表示6%~25%,2表示26%~50%,3表示51%~75%,4表示>75%。将染色强度和阳性面积的值相乘得到最终得分。0~2为阴性,3~4为弱阳性,6~8为中度阳性,9~12为强阳性。
1.4 随访
随访方式为电话随访,随访内容为术后生活质量,随访开始日期为出院日期,结束日期为2017年12月31日,总生存期为患者出院至死亡或随访截止的时间。
1.5 统计分析
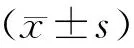
2 结果
2.1 癌旁组和肺癌组中MAGEA4、EB1 mRNA水平的表达
肺癌组MAGEA4、EB1 mRNA表达水平高于癌旁组(表1),差异有统计学意义(P<0.05)。

表1 癌旁组和肺癌组中EB1、MAGEA4 mRNA水平的表达
2.2 癌旁组和肺癌组中MAGEA4、EB1的免疫组化表达评分及阳性率
MAGEA4主要定于细胞膜和细胞质,呈黄色或深棕黄色颗粒,EB1主要定位于细胞质,呈棕黄色或棕褐色颗粒;肺癌组MAGEA4阳性129例,EB1阳性106例,肺癌组MAGEA4、EB1阳性率高于癌旁组(P<0.001);肺癌组MAGEA4、EB1蛋白表达评分高于癌旁组(P<0.001)(图1,表2)。

表2 MAGEA4、EB1在癌旁组、肺癌组中的免疫组化表达及阳性率

图1 癌旁组和肺癌组MAGEA4、EB1的表达Figure 1 Expression of MAGEA4 and EB1 proteins in paracancerous and lung cancer tissuesNote:A.Expression of MAGEA4 protein in adjacent tissues;B.Expression of MAGEA4 protein in lung cancer tissues;C.Expression of EB1 protein in adjacent tissues;D.Expression of EB1 protein in lung cancer tissues.
2.3 MAGEA4、EB1蛋白表达与临床病理特征的关系
MAGEA4、EB1蛋白表达与年龄、病理学类型无关(P>0.05);与肿瘤最大径、病理学分级、TNM分期、浸润深度、淋巴血管间隙浸润、淋巴结转移、复发有关,且肿瘤最大径≥5 cm、病理学分期越高、TNM分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发,MAGEA4、EB1蛋白阳性表达率越高(P<0.001)(表3)。
2.4 MAGEA4、EB1表达水平与肺癌患者预后分析
随访发现,MAGEA4阴性表达患者的中位存活时间为72.76个月(95%CI:67.64~87.91个月),明显高于MAGEA4阳性表达患者的51.74个月(95%CI:45.62~65.99个月),差异有统计学意义(P<0.05)。EB1阴性表达患者的中位存活时间为74.65个月(95%CI:56.32~89.14个月),明显高于EB1阳性表达患者的49.17个月(95%CI:32.54~59.32个月),差异有统计学意义(P<0.05);MAGEA4、EB1阴性组3年生存率高于MAGEA4、EB1阳性组(47.6%vs. 35.4%,60.3%vs. 32.4%),差异有统计学意义(P<0.05)。进行Cox回归分析,回归模型具有统计学意义(P<0.05);淋巴血管间隙浸润、淋巴结转移、MAGEA4阳性、EB阳性是肺癌患者预后的独立危险因素(P<0.05)(图2,表4)。
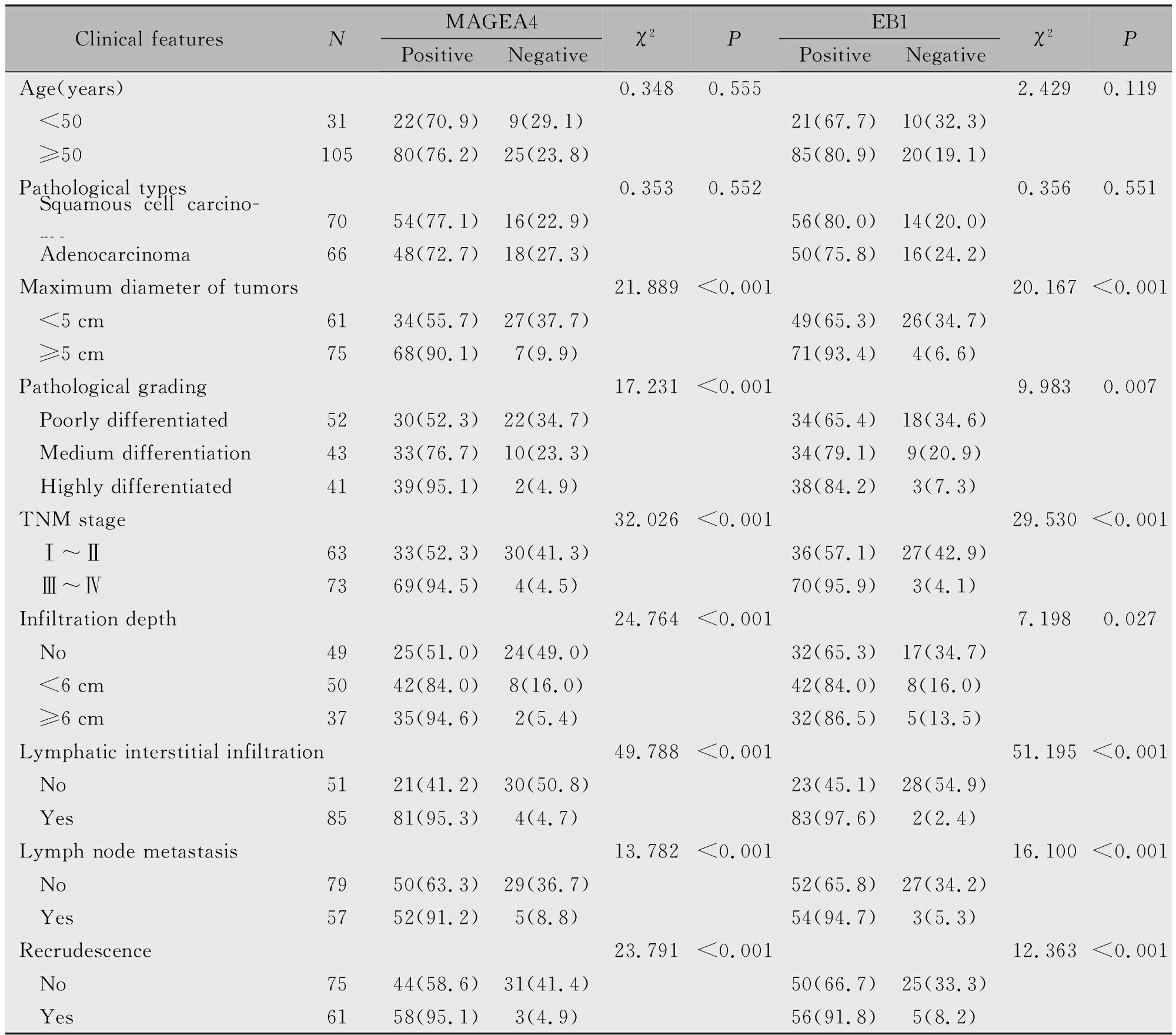
表3 MAGEA4、EB1蛋白表达与临床病理特征的关系

表4 影响肺癌患者预后的多因素Cox回归分析

图2 MAGEA4、EB1阳、阴组Kaplan-Meier生存曲线分析Figure 2 Kaplan-Meier survival curves of positive and negative expression of MAGEA4 or EB1 proteins in lung cancer patientsNote:A.The negative expression of MAGEA4 protein;B.The positive expression of MAGEA4 protein;C.The negative expression of EB1 protein;D.The positive expression of EB1 protein.
3 讨论
MAGEA4作为Tregs发育和功能的主要调节剂。Tregs是T细胞亚群,具有免疫抑制功能,可防止身体对自身抗原反应过度。因此,这些细胞在自身耐受中起关键作用[11-12]。此外,Tregs参与肿瘤逃离免疫系统。患有乳腺癌、胃癌、肝癌和一些其他癌症的患者的外周血和肿瘤组织中MAGEA4+Tregs的数量增加。在之前的研究中,MAGEA4+Tregs的数量已显示与肿瘤进展和肺癌患者预后密切相关。最近的研究报道,MAGEA4不仅在Tregs中表达,而且还在肿瘤细胞中表达,不同肿瘤细胞中的MAGEA4表达可以起到不同的作用[13]。人胰腺癌高表达MAGEA4,39个样本中有24例表达MAGEA4(61%阳性率)。此外,MAGEA4在胰腺癌中的表达可抑制T细胞增殖;使用免疫组织化学发现乳腺癌细胞中MAGEA4表达增加(57%阳性率),MAGEA4表达与无复发和总存活率下降密切相关;前列腺癌细胞中MAGEA4表达升高[14]。本研究结果发现,肺癌组MAGEA4 mRNA表达水平高于癌旁组;肺癌组MAGEA4阳性率、蛋白表达高于癌旁组;MAGEA4蛋白表达与肿瘤最大径、病理学分级、TNM分期、浸润深度、淋巴血管间隙浸润、淋巴结转移、复发有相关性,且肿瘤最大径≥5 cm、病理学分期越高、TNM分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发时,MAGEA4、EB1蛋白阳性表达率越高。这与上述讨论符合,同时也提示,MAGEA4蛋白在肺癌组织中高表达,其能促进肺癌的进展。细胞分子学实验发现,外源性MAGEA4在肝癌细胞核中积累,抑制Caspase介导的肝癌细胞凋亡,并使肝癌细胞对化学治疗剂敏感性降低,意味着MAGEA4是肿瘤促进因子,MAGEA4由蛋白酶体加工以产生抑制凋亡的C末端片段,其最终降低p53活性,从而抑制细胞凋亡。
EB1在微管动力学、细胞极性和基因组稳定性中的生理作用已被大量研究。然而,EB1控制肿瘤发生和肿瘤细胞生长的分子途径才刚刚开始起步。蛋白质组学分析将EB1鉴定为喉癌细胞中的放射抗性相关基因。研究表明[15],EB1是乳腺癌细胞通过诱导GTSE1(G-2和S期表达1)激活而增加侵袭能力所必需的。EB1功能主要归因于与APC的复合物形成,并且随后通过抑制APC和β-连环蛋白之间的直接相互作用诱导β-连环蛋白的核积累。由此产生的β-连环蛋白的增加增强了T细胞因子/淋巴增强因子(Tcf/Lef)的转录活性。已经确定Wnt/β-catenin途径通过促进β-连环蛋白介导的Tcf/Lef靶基因(例如细胞周期蛋白D1和c-Myc)的表达来调节肿瘤发生和癌细胞的恶性表型[16]。因此,EB1对β-连环蛋白动力学的影响支持EB1是致癌基因的可能性,尽管与细胞生长和肿瘤发展的调节相关的信号传导机制仍有待阐明。近期研究显示EB1在免疫细胞上表达并介导天然免疫和获得性免疫[17]。近年来,已显示EB1在肿瘤细胞上表达;然而,与免疫细胞中功能相反,它起着负面作用。本研究结果发现,肺癌组MAGEA4、EB1mRNA表达水平高于癌旁组;肺癌组MAGEA4、EB1阳性率、蛋白表达高于癌旁组。这与上述讨论相符。相关研究显示EB1活化释放炎性细胞因子和免疫抑制因子以诱导免疫耐受并促进肿瘤逃逸。结直肠癌和胰腺导管腺癌中已显示EB1表达增加,并且EB1表达与肿瘤进展之间存在密切关系。动物研究表明[18],携带S180骨肉瘤小鼠早期EB1的表达明显高于晚期骨肉瘤。此外,EB1刺激后培养的S180骨肉瘤细胞中IL-10和TGF-β(两种重要的免疫抑制因子)的表达上调。本研究同时发现,MAGEA4、EB1蛋白表达与肿瘤最大径、病理学分级、TNM分期、浸润深度、淋巴血管间隙浸润、淋巴结转移、复发有相关性,且肿瘤最大径≥5 cm、病理学分期越高、TNM分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发时MAGEA4、EB1蛋白阳性表达率越高。提示MAGEA4和EB1蛋白在肺癌组织中高表达,其能促进肺癌的进展。
此外,本研究也发现MAGEA4、EB1阴性表达患者的平均存活时间高于MAGEA4、EB1阳性表达患者;MAGEA4、EB1阴性组3年生存率高于MAGEA4、EB1阳性组;淋巴血管间隙浸润、淋巴结转移MAGEA4阳性、EB1阳性是肺癌患者预后的独立危险因素,说明MAGEA4、EB1蛋白低表达的肺癌患者能获得较好的预后。
综上所述,MAGEA4和EB1蛋白在肺癌组织中阳性表达率增高,其高表达可能与肺癌的发生发展相关;MAGEA4、EB1蛋白阴性表达的肺癌患者能获得较好的预后。

