miR-362靶向Six1抑制宫颈癌细胞增殖、迁移的作用机制研究
李 景 吴华珍 刘继琐
宫颈癌是一种常见的妇科恶性肿瘤,占全球人类癌症的12%。据估计,在2015年全球有56万例新发病例和29万例宫颈癌死亡病例[1-3]。宫颈癌患者局部晚期疾病和转移性疾病的5年总生存率分别为30%~50%和5%~15%[4-5]。miR-362通过直接靶向Gli3发挥其抗增殖功能,并通过在体外和体内抑制宫颈癌生长而起到肿瘤抑制剂的作用[6-8]。miR-362参与DNA甲基转移酶1(DNMT1)的调节,以在体外和体内抑制肝癌细胞增殖和转移。Six1是Six家族的同源域的成员,位于人类染色体14q23(34)上[9]。Six1在细胞增殖、细胞周期进程、细胞凋亡、细胞分化和血管生成中起重要作用[10]。此外,据报道Six1受miRNA调节,例如肺癌中的miR-134和急性髓性白血病中的miR-370。本研究拟探讨miR-362靶向Six1抑制宫颈癌细胞增殖、迁移的作用机制,为宫颈癌的治疗提供理论依据。
1 资料与方法
1.1 临床资料
2012年4月—2013年8月在我院行手术切除并经病理证实的宫颈癌患者142例为宫颈癌组,获得宫颈癌组织和配对的癌旁组织(离肿瘤3 cm,病理未发现癌细胞),将其储存在-80℃冰箱,直至进行RNA提取。该研究经我院医学伦理协会批准,患者及家属签署知情同意。
1.2 宫颈癌组织及癌旁正常组织miR-362表达水平测定
使用TRIzol试剂按照制造商的说明从组织或细胞中提取总RNA。使用Applied Biosystems 7900HT RT-PCR系统进行逆转录定量聚合酶链反应(RT-qPCR)。为了量化miR-362的表达,使用以下方法合成互补DNA(cDNA),TaqMan MicroRNA Reverse Transcription Kit逆转录,然后用TaqMan MicroRNA PCR Kit进行qPCR。研究中使用的引物如下:miR-362:5′-ACACTCCAGCTGGGCTCCTATATGATGC-3′,5′-ACTCCACGACACCAGTTGAG-3′。U6:5′-CTCGCTTCGGCAGCACA-3′,5′-AACGCTTCACGAATTTGCGT-3′。U6用作miR-362 mRNA表达的内源对照。用2-ΔΔCt方法计算miR-362的相对水平。
1.3 Hela细胞培养及分组设计
宫颈癌细胞系Hela细胞来源于中国科学院细胞中心(中国上海),在Dulbecco′s Modified Eagle′s培养基(DMEM)中培养,加入10%胎牛血清(FBS)、100 IU/mL青霉素、100 μg/mL链霉素;所有细胞在37℃含有5%CO2的潮湿培养箱中培养。
分组设计:Hela宫颈癌组:取5×106Hela宫颈癌细胞于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、20% O2);miR-362mimics、miR-362 inhibitor组:取10 mL转染miR-362 mimics、miR-362inhibitor的Hela宫颈癌细胞液于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、2% O2)。以上各组每孔设6个平行样,培养72 h。
Hela宫颈癌细胞株miR-362mimics、miR-362inhibitor转染:取5×106Hela宫颈癌细胞液接种于6孔板,细胞长到60%~70%汇合的密度时,用Lipofectamine 2000试剂按照制造商的说明书进行细胞转染。转染步骤如下:取100pmol的miR-362mimics、miR-362inhibitor于200 μL DMEM培养基中,取4 μL lipofectamine2000于200 μL DMEM培养基中,混匀lipofectamine2000和miRNA液,室温培育30 min,无菌PBS洗涤细胞,将混合液加入细胞孔内,6 h后弃混合液,加入含胎牛血清的DMEM培养基培养,转染后约24 h,流式细胞仪检测转染效情况。miR-362mimics、miR-362inhibitor获自上海蓝基因生物科技有限公司。
1.4 癌细胞活力的MTT法检测及癌细胞单克隆形成数目检测
通过使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-2H-四唑溴化物(MTT)测定来评估细胞增殖。收集转染的各组细胞并以每孔2,000个细胞的密度接种在96孔板中。然后将细胞在37℃下在含有5%CO2和100%湿度的条件下孵育72 h。向每个孔中加入20 μL MTT溶液(5 mg/mL),随后在37℃下再孵育4 h。小心丢弃含有MTT溶液的培养基,并加入200 μL二甲基亚砜(DMSO)以溶解甲crystals沉淀物。使用自动多孔分光光度计(Bio-Rad)测量490 nm处的光密度(OD)值。
1.5 癌细胞单克隆形成数目检测
转染24 h后,将各组细胞用胰蛋白酶处理,计数,并以密度为1 000个细胞/孔在6孔板中接种用完全培养基培养8天。每3天更换培养基以维持细胞生长。培养8天后,将菌落固定并用0.5%结晶紫在室温下染色30 min。在倒置显微镜下计数菌落数。
1.6 癌细胞凋亡及细胞周期检测
通过使用膜联蛋白V/荧光素异硫氰酸酯(FITC)细胞凋亡试剂盒检测细胞凋亡。将在6 cm培养皿中培养的细胞用胰蛋白酶消化,洗涤,在黑暗中用FITC缀合的抗膜联蛋白V抗体染色。在室温下15 min,然后通过流式细胞术(BD Biosciences)分析。每个实验重复三次。使用FACS Calibur系统测试标记的各组细胞,并测定凋亡百分比及细胞周期。
1.7 Transwell细胞侵袭实验
收获转染的各组细胞,用无FBS DMEM培养基洗涤两次,然后重悬于无FBS的DMEM培养基中。将总共1×105个细胞加入到涂有Matrigel的Transwell培养板的上室中。将含有20%FBS的约600 μL DMEM加入Transwell培养板的下室中。在37℃和5%CO2的潮湿培养箱中孵育48 h后,用棉签小心地除去残留在膜上表面的细胞。渗透到膜下表面的细胞用4%多聚甲醛固定,用0.5%结晶紫染色,用磷酸盐缓冲盐水(PBS)洗涤,并在空气中干燥。在光学显微镜下对侵入的细胞进行计数。
1.8 Hela宫颈癌细胞iR-362、Six1 mRNA水平测定
实时荧光定量PCR测定各组miR-362、Six1 mRNA表达水平。Six1正向引物:5′-GTTAGCCTTGTCTTTACT-3′,反向引物:5′-ACTGCTACTGTTCGACAGAATCG-3′。
1.9 统计分析
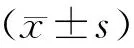
2 结果
2.1 癌旁组织、宫颈癌组织中miR-362mRNA表达水平的比较
宫颈癌组织miR-362mRNA表达水平低于癌旁组织(P<0.05)(表1)。
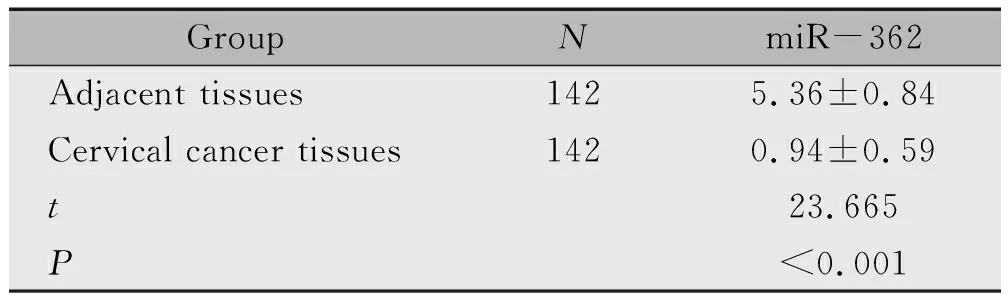
表1 癌旁组织、宫颈癌组织中miR-362mRNA水平的表达
2.2 miR-362表达与临床病理特征的关系
以宫颈癌组miR-362 mRNA中位数0.94为判定点,<0.94为低表达,≥0.94为高表达;有淋巴血管间隙浸润、病理学分期越高、TNM分期越高、有淋巴结转移、浸润深度越深时,miR-362mRNA表达率越低,miR-362表达与淋巴血管间隙浸润、病理学分级、TNM分期、淋巴结转移、浸润深度有关(P<0.05)(表2)。
2.3 各组Hela癌细胞OD值、存活率水平的表达
miR-362mimics组OD值、存活率水平低于Hela癌细胞组(P<0.05),miR-362inhibitor组OD值、存活率水平高于Hela癌细胞组、miR-362mimics组(P<0.05)(表3)。
2.4 各组Hela癌细胞单克隆形成数目的表达
miR-362mimics组克隆形成数目低于Hela癌细胞组(P<0.05),miR-362inhibitor组克隆形成数目高于Hela癌细胞组、miR-362mimics组(P<0.05)(图1,表4)。

表2 miR-362表达与临床病理特征的关系[n(%)]

表3 各组Hela癌细胞OD值、存活率水平的表达
Note:bP<0.05,compared with Hela cancer cells group;cP<0.05,compared with miR-362 mimics group.

表4 各组Hela癌细胞克隆形成数目的表达
Note:bP<0.05,compared with Hela cancer cells group;cP<0.05,compared with miR-362mimics group,.
2.5 各组Hela癌细胞凋亡率的表达
miR-362mimics组细胞凋亡率高于Hela癌细胞组(P<0.05),miR-362inhibitor组细胞凋亡率低于Hela癌细胞组、miR-362mimics组(P<0.05)(表5)。
2.6 各组Hela癌细胞G1期比较
miR-362mimics组G1期高于Hela癌细胞组(P<0.05),miR-362inhibitor组G1期低于Hela癌细胞组、miR-362mimics组(P<0.05)(图2,表6)。
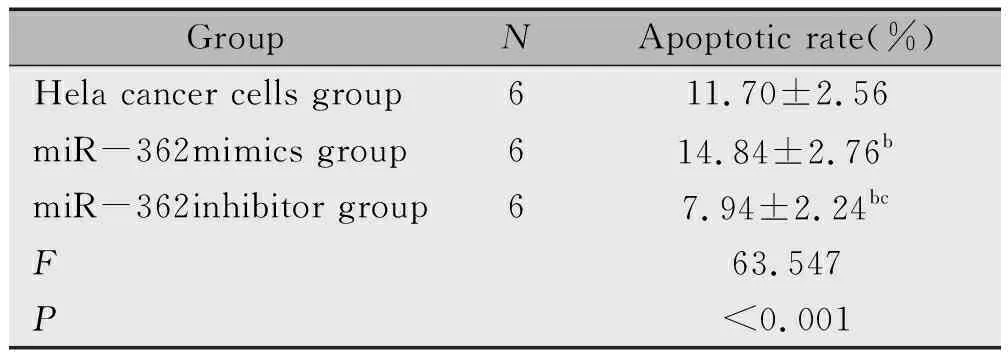
表5 各组Hela癌细胞凋亡率的表达
Note:bP<0.05,compared with Hela cancer cells group;cP<0.05, comparedwith miR-362mimics group.
2.7 各组Hela癌细胞穿膜数的表达
miR-362 mimics组细胞穿膜数低于Hela癌细胞组(P<0.05),miR-362inhibitor组穿膜数高于Hela癌细胞组、miR-362 mimics组(P<0.05)(表7,图3)。

图1 各组Hela癌细胞克隆形成数目比较Figure 1 Comparison of the number of colony formation of Hela cancer cells in each group Note:A:Hela cells group;B:miR-362mimics group;C:miR-362inhibitor group.
图2 各组Hela癌细胞G1期比较Figure 2 Comparison of G1 Phase of Hela Cancer Cells in Different GroupsNote:A:Hela cancer cells group,B:miR-362mimics group,C:miR-362inhibitor group.
表6 各组Hela癌细胞G1期比较
Note:bP<0.05,compared with Hela cancer cells group.cP<0.05,compared with miR-362mimics group.

表7 各组Hela癌细胞穿膜数的表达
Note:bP<0.05,compared with Hela cancer cells group;cP<0.05,compared with miR-362mimics group.
图3 各组Hela癌细胞G1期比较Figure 3 Comparison of G1 phase of Hela cancer cells in each group Note:A:Hela cancer cells group,B:miR-362mimics group,C:miR-362inhibitor group.
2.8 各组Hela癌细胞miR-362、SIX1 mRNA表达水平比较
miR-362mimics组miR-362 mRNA表达水平高于Hela癌细胞组(P<0.05),miR-362inhibitor组miR-362 mRNA表达水平低于Hela癌细胞组、miR-362mimics组(P<0.05)。miR-362mimics组Six1 mRNA表达水平低于Hela癌细胞组(P<0.05),miR-362inhibitor组Six1 mRNA表达水平高于Hela癌细胞组、miR-362mimics组(P<0.05)(表8)。

表8 各组Hela癌细胞miR-362、SIX1 mRNA表达水平比较
Note:bP<0.05,compared with Hela cancer cells group;cP<0.05,compared with miR-362mimics group.
3 讨论
越来越多的证据表明,miRNA在正常细胞特征和病理状态中都发挥着重要作用。这些miRNA可通过调节其靶基因而充当肿瘤抑制因子或癌基因。因此,鉴定宫颈癌中癌症特异性miRNA及其靶基因对于理解它们在肿瘤发生和发展中的作用是至关重要的,并且可以作为新的治疗靶标进行研究。目前已经在各种类型的癌症中研究了miR-362的表达。例如,在乳腺癌中,与对照CCD-1095Sk细胞系相比,发现miR-362在MDA-MB-231和MCF7细胞系中显著下调;慢性粒细胞白血病细胞系和慢性粒细胞白血病患者的新鲜血液样本中miR-362的表达水平较低;在肝细胞癌中鉴定出明显的miR-362下调,并且与肿瘤进展显著相关;在胃癌中,miR-362表达在肿瘤组织和细胞系中下调[11]。miR-362是CCL20的正向调节物,CCL20的过度表达抑制分化和结节转移,因此miR-362与CCL2030 UTR的结合能抑制恶性肿瘤[12-13]。同时,许多miRNA在宫颈癌中被下调并且充当肿瘤抑制剂。一项研究通过MTT法和流式细胞术评估肝癌细胞的生长和凋亡,发现miR-362的过表达通过调节PI3K/Akt/mTOR信号通路靶向磷酸肌醇3-激酶催化亚基δ(PIK3CD)抑制细胞增殖、诱导细胞凋亡和降低致瘤性。本研究结果显示,宫颈癌组miR-362mRNA表达水平低于癌旁组;淋巴血管间隙浸润、病理学分期越高、TNM分期越高、有淋巴结转移、浸润深度越深,miR-362mRNA表达率越低,miR-362表达与淋巴血管间隙浸润、病理学分级、TNM分期、淋巴结转移、浸润深度相关性明显;Hela宫颈癌细胞体外试验表明,miR-362过表达可降低Hela宫颈癌细胞增殖、侵袭水平,增加Hela宫颈癌细胞凋亡水平。这与上述讨论符合,同时提示miR-362在宫颈癌的发生和发展过程中发挥了肿瘤抑制作用。
Six1作为转录因子参与多种生物过程,包括癌症。已在多种肿瘤细胞系和肿瘤组织中检测到Six1表达增加,表明Six1对肿瘤细胞增殖和生长至关重要。Six1的表达升高与肿瘤恶性相关[14]。在乳腺癌、结直肠癌、食管鳞状细胞癌和胰腺癌中发现了Six1的异常升高。大量证据表明Six1有助于肿瘤发生。SIX1表达增加促进血管生成、侵袭和转移[15]。在胰腺癌细胞中,SIX1表达下调减少了MMP-2、MMP-9和VEGF的表达,从而抑制血管生成、侵袭和迁移[16]。此外,一系列研究报道了Six1在肿瘤发生中的功能可以通过miRNA调节。例如,下调的miR-370通过上调急性髓性白血病(AML)中的Six1而促进增殖和细胞衰老[17]。研究已证实在宫颈癌中,Six1表达上调,Six1的表达水平与宫颈癌的临床分期、分化和淋巴结转移显著相关。考虑到Six1在宫颈癌中的重要性和作用,它可以作为宫颈癌患者的治疗靶点。本研究结果显示,miR-362mimics组Six1 mRNA表达水平低于Hela癌细胞组,miR-362inhibitor组Six1 mRNA表达水平高于Hela癌细胞组、miR-362mimics组。提示miR-362过表达可抑制Hela癌细胞Six1的表达,miR-362通过负调节Six1抑制细胞增殖、迁移和侵袭。miR-362可用作抑制人宫颈癌生长和转移的治疗靶标。
综上所述,miR-362在宫颈癌的发生和发展过程中发挥了肿瘤抑制作用;其机制与miR-362通过负调节Six1抑制癌细胞增殖、迁移和侵袭有关。

