传统发酵蔬菜中抑制嗜水气单胞菌群体感应及生物膜形成乳酸菌的筛选与鉴定
林 洋 崔天琦 吕欣然,2 白凤翎* 励建荣 沈 琳
(1 渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013 2 北京林业大学生物科学与技术学院 北京100083 3 大连东霖食品股份有限公司 辽宁大连116101)
嗜水气单胞菌 (Aeromonas hydrophila)分布范围广,主要存在于土壤、淤泥、海水及淡水等环境中,是一种可以导致人-兽-水生动物共患病发生的革兰氏阴性条件致病菌,也可引起鲤鱼、金钱鱼、黄鳝和中华鳖等多种水生动物出现败血症,给水产养殖业带来巨大经济损失[1]。嗜水气单胞菌致病性与之产生的溶血素、蛋白酶及粘附素(菌毛和表面S 层蛋白)等毒力因子密切相关[2]。其毒力因子间通过协同作用产生毒性效应且受细胞密度的调控,这种细胞密度依赖性调节被称为群体感应(quorum sensing,QS)[3]。QS 感应之间的交流主要依靠信号分子的传导,嗜水气单胞菌的信号分子主要是N-酰基高丝氨酸内酯(AHLs)[4]。同时,细菌QS 现象也是导致食品腐败的主要方式之一,近年来已成为研究的热点[5-6]。
细菌生物膜(bacterial biofilm,BF)的形成、生物发光、毒性基因表达和胞外多糖的合成等都与QS 密切相关[7]。BF 是细菌在生长过程中为适应外界生存环境形成的一种生长方式,形成生物膜的细菌具有极强的耐药性[8-10]。如果利用传统的抗生素来抑制BF 的形成,会导致细菌产生极强的耐药性[11]。可从自然界中寻找生物源性群体感应抑制剂(quorum sensing inhibitor,QSI),通过降低细菌生物膜的形成,抑制细菌QS 的方式,控制食品中腐败菌和致病菌的生长繁殖。
QSI 是只针对QS 系统具有抑制作用,而不干扰细菌体内正常的生命活动[12]。QSI 一般通过抑制信号分子合成,降低其受体蛋白活性或抑制信号分子合成酶,促进信号分子的降解,与信号分子竞争性结合受体蛋白等4 种方式抑制细菌的群体感应[13-14]。目前已从动物、植物、微生物中获得多种生物源性QSI[15]。其中,微生物源性QSI 主要来源于真菌和芽孢杆菌。Musthafa 等[16]研究发现芽孢杆菌(Bacillus sp.SS4) 代谢产物对铜绿假单胞菌(Pseudomonas aeruginosa PAO1)生物膜和胞外蛋白酶的抑制率分别为33%和65%。Nakayama 等[17]发现放线菌(Streptomyces sp.)Y33-1 的次生代谢物siamycin I 可有效抑制粪肠球菌(Enterococcus faecalis)QS 系统所需明胶酶的产生,而不影响菌体的生长。
乳酸菌广泛分布于传统发酵食品、动物肠道及土壤淤泥等自然环境中,通过产生乳酸、双乙酰、罗伊氏菌素以及乳酸菌素等方式抑制它种微生物的生长繁殖[18]。乳酸菌生物防腐制剂具有安全、高效、绿色、无残留等特点,广泛应用于食品的防腐保鲜中。而对乳酸菌的代谢产物能否作为腐败菌和致病菌的QSI 方面的研究国内外鲜见报道。Park 等[19]研究发现,清酒乳杆菌(Lactobacillus sakei)NR28 能够有效抑制大肠肝菌(Escherichia coli)ATCC43894 生物膜的形成,具有QS 抑制活性。
本文以水产养殖致病菌嗜水气单胞菌为目标菌株,以来源于传统发酵蔬菜的乳酸菌为供试菌株,从供试菌株乳酸菌中筛选可作为QSI 的菌株,并分析其产生的活性物质,同时探究其对生物膜生成量和结构的影响,为研发一种嗜水气单胞菌QSI 提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株及培养条件 乳酸菌菌株:AJS2-4(安徽绩溪酸豆角)、AJX3-5 (安徽绩溪腌雪菜)、LHJ1-5(辽宁葫芦岛腌芥菜)、LJS1-4(辽宁锦州酸菜)、LZH1-3(辽宁彰武酸黄瓜)、CY2-4(辽宁朝阳酸菜)、NNL1-5 (内蒙古宁城酸辣椒) 和LDS513(辽宁大连酸黄瓜)。
指示菌株:紫色杆菌(Chromobacterium violaceum)CV026,自身不产生N-酰基-高丝氨酸内酯(AHLs)类信号分子,仅当外源AHLs 信号分子出现时,菌株才能够产生紫色菌素,并检测出环境中的信号分子C4-HSL~C8-HSL,保藏于本院微生物实验室。
目标菌株:嗜水气单胞菌 (Aeromonas hydrophila)LY-2,分离自腐败大菱鲆体表,保藏于本院微生物实验室。
1.2 试剂、仪器与设备
1.2.1 培养基和试剂 LB 肉汤、LB 琼脂、MRS 肉汤、MRS 琼脂,北京奥博星生物技术有限公司;胰蛋白酶(2.5×105U/g)、木瓜蛋白酶(2.0×105U/g)、中性蛋白酶(2.0×105U/g)、碱性蛋白酶(2.0×105U/g)、胃蛋白酶(1.5×105U/g),华蓝化学有限公司;乳酸菌生化鉴定管,杭州天和微生物试剂有限公司;细菌基因组DNA 快速抽提试剂盒、卡那霉素、DNA marker-D、Taq PCR Master mix,上海生工生物工程有限公司。
1.2.2 仪器与设备 ABI stepone plus PCR 仪,德国Eppendorf 公司;DYY-8C 电泳仪,北京市六一仪器厂;Quantity One 凝胶成像系统,美国Bio-Rad 公司;MS105UD 电子分析天平,瑞士梅特勒-托利多有限公司;Imark 酶标仪,美国BIO-RAD;S-4800 扫描电镜、E-1045 镀金仪,日本日立公司;MM-80 显微镜,日本NIKON;DL-CJ-2N 超级洁净工作台,北京市东联哈尔仪器制造有限公司;SPX-250 生化培养箱,宁波海曙赛福实验仪器厂;IKA Vortex GENIUS 3 振荡器,德国IKA 公司;5804R 高速冷冻离心机,德国Eppendorf 公司;Multiskan FC 酶标仪,美国Thermo Fisher 公司;V3 全自动菌落计数仪,杭州讯数科技有限公司;GI54DS 立式高压蒸汽灭菌锅,致微(厦门)仪器有限公司;RE-2000A 旋转蒸发器,上海亚荣生化仪器厂;Labconco Free Zone 2.5 台式真空冷冻干燥机,美国LABCONCO 公司。
1.3 方法
1.3.1 乳酸菌无细胞上清液 (cell free supernatants,CFS) 和嗜水气单胞菌AHLs 的制备 将分离自传统发酵蔬菜的乳酸菌接种于MRS 肉汤中,37 ℃培养24 h 后,以2.0%的接种量传代培养2 次。将发酵液于4 ℃6 500 r/min 离心15 min,上清液经0.45 μm 滤膜过滤获得CFS,置于4 ℃冰箱保存备用。
将-80 ℃保存的嗜水气单胞菌接种于LB 肉汤中,以1.0%的接种量传代培养1 次,将发酵液于4 ℃6 500 r/min 离心15 min,收集的无细胞上清液中含有AHLs 信号分子,置于4 ℃冰箱保存备用。
1.3.2 抑制嗜水气单胞菌群体感应乳酸菌的筛选将-80 ℃保存的紫色杆菌CV026 接种于LB 肉汤,30 ℃过夜培养。以2%接入量接种于10 mL 含有10 μg/mL 卡那霉素的LB 肉汤中,30 ℃培养24 h 后,移取2.5 mL 菌液于25 mL 含有25 μL AHLs信号分子的LB 软琼脂培养基中,混匀,倒入摆有牛津杯的素琼脂的平板中,待凝固后取出牛津杯,每孔加入180 μL 乳酸菌CFS,置于30 ℃培养24 h,用全自动菌落计数仪记录孔周围呈现的白色不透明的浑浊圈。同时以MRS 为对照组。
1.3.3 乳酸菌粗提物的制备 取100 mL 乳酸菌CFS 于500 mL 分液漏斗中,加入20 mL 乙酸乙酯进行萃取。萃取5 次。加入溶剂后顺时针缓慢震荡,静置5 min 后,收集合并上层及乳化层液体,真空旋转蒸发,收集萃取液于真空冷冻干燥,置于-80 ℃保存备用。于45 ℃下120 r/min 真空旋转蒸发至无残留的有机溶剂,收集萃取液,真空冷冻干燥,置-18 ℃冰箱保存备用。
1.3.4 乳酸菌粗提物对紫色杆菌CV026 及嗜水气单胞菌生长曲线的影响 将活化的嗜水气单胞菌用LB 肉汤制成约106CFU/mL 菌悬液,将190 μL 菌悬液置于96 孔板中,加入10 μL QSI 粗提物,使其终质量浓度分别达到32.0,16.0,8.0,4.0,2.0 mg/mL,以不加粗提物的LB 培养基作为对照,30 ℃培养24 h,每隔2 h 在波长595 nm 处测定OD 值。
1.3.5 乳酸菌粗提物对嗜水气单胞菌生物膜形成的影响
1.3.5.1 96 孔板法测定对嗜水气单胞菌生物膜的抑制率 利用96 孔板法[20],将活化的嗜水气单胞菌用LB 肉汤制成约106CFU/mL 菌悬液,移取180 μL 菌悬液于96 孔板中,加入20 μL 乳酸菌粗提物,同时以MRS 为对照组。30 ℃培养24 h后,缓慢移出孔内培养液,加入200 μL 无菌水清洗5 次后,再添加200 μL 0.4%的结晶紫染色5 min 后,用200 μL 无菌水清洗3 次,置于干燥箱中干燥10 min。取出96 孔板,向孔中加入200 μL 95%乙醇,并移取150 μL 液体于新的96 孔板内,用酶标仪测其OD595nm。每个样品设置3 个平行。
式中:ODcontrol——对照组OD 值;ODQSI——CFS处理组的OD 值。
1.3.5.2 光学显微镜观察 在含有1.0 mL LB 肉汤的24 孔板中放入无菌盖玻片(R=1.4 cm),再向孔中加入10 μL 过夜培养的嗜水气单胞菌菌悬液和100 μL 乳酸菌粗提物,同时以MRS 为对照组,30 ℃培养24 h 后,用超纯水将盖玻片润洗3 次,再用0.4%结晶紫染色20 min,通过显微镜观察生物膜。
1.3.5.3 扫描电镜分析 采用光学显微镜观察乳酸菌粗提物对生物膜形成的影响。加入2.5%戊二醛溶液,置于4 ℃下固定12 h,用无菌水将盖玻片洗涤3 次除掉残留的戊二醛,然后分别用40%,70%,90%,100%乙醇脱水处理15 min,将盖玻片真空干燥,喷金,扫描电镜观察生物膜。
1.3.6 乳酸菌粗提物对嗜水气单胞菌信号分子(AHLs)的降解 参照Romero 等[21]的方法稍作修改。将乳酸菌粗提物添加到1 mL 含有10 μL AHLs 信号分子粗提物的LB 肉汤中,使其终质量浓度为4.0 mg/mL 和8.0 mg/mL,同时以MRS 为对照组,37 ℃培养24 h。采用牛津杯打孔法测定其降解活性。
1.3.7 乳酸菌粗提物对嗜水气单胞菌QS 抑制作用的影响因素 参考吕欣然等[22]的方法并稍作修改,测定蛋白酶、温度和pH 值对乳酸菌粗提物的影响。
1) 蛋白酶 将乳酸菌粗提物pH 值分别调至胃蛋白酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶和碱性蛋白酶的最适pH 值,将蛋白酶添加到粗提物溶液中使其最终质量浓度为1.0 mg/mL,37 ℃下水浴2 h,再将pH 值调为初始值。以未处理的乳酸菌粗提物为对照,采用牛津杯打孔法测定其活性。
2) 温度 将乳酸菌粗提物分别在40,60,80,100 ℃和121 ℃条件下处理30 min,以未处理的乳酸菌粗提物为对照,采用牛津杯打孔法测定其活性。
3) pH 利用1.0 mol/L NaOH 和1.0 mol/L HCl 将粗提物溶液的pH 值分别调为3.0,3.5,4.0,4.5,5.0,5.5 和6.0,采用牛津杯打孔法测定其降活性。
1.3.8 乳酸菌菌株鉴定
1.3.8.1 生理生化鉴定 挑选具有群体感应抑制作用的乳酸菌菌株,参照东秀珠[23]、Bergey[24]和凌代文[25]等文献对乳酸菌菌株进行生理生化鉴定。
1.3.8.2 16S rRNA 鉴定 参考马欢欢等[26]的方法并稍作修改。移取1.0 mL 乳酸菌菌悬液于1.5 mL EP 管中,12 000 r/min 离心5 min,利用DNA快速抽提试剂盒对菌株DNA 进行提取,以16S rDNA 通用引物对PCR 进行扩增。正向引物为27f (5’-AGAGTTTGATCCTGGCTCAG-3’),反向引物为1492r(5’-TACGGYTACCTTTGTTACGACTT-3’),引物由上海生工生物技术公司合成。PCR 扩增反应体系:DNA 模板1.0 μL、Taq PCR Master mix 12.5 μL、dd H2O 9.5 μL、上游引物1.0 μL、下游引物1.0 μL,总体积25 μL。PCR 扩增扩增反应程序:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,72 ℃保持10 min,循环30 次,4 ℃保温。使用1%琼脂糖对PCR 产物进行电泳,凝胶成像仪观察结果并拍照。将扩增成功的PCR 产物送到上海生物工程股份有限公司测定序列。将获得的序列与NCBI 的GeneBank 数据库进行BLAST 比对和分析,然后应用MEGA 5.0 软件构建菌株的系统发育进化树。
1.3.9 数据处理 采用SPSS 18.0 对试验数据进行统计学分析,数据平行3 次,结果用平均值±标准偏差表示,用软件Origin 8.0 绘图。
2 结果与讨论
2.1 抑制嗜水气单胞菌QS 作用乳酸菌的筛选
当外源AHLs 信号分子存在时,能够诱导紫色杆菌CV026 产生紫色素。当某种群体感应抑制剂存在时,其能够抑制紫色杆菌CV026 产生紫色素。本研究采用牛津杯打孔法共获得8 株对嗜水气单胞菌QS 有抑制作用的乳酸菌菌株。图1显示部分乳酸菌菌株对嗜水气单胞菌QS 的抑制效果。可以看出,添加了乳酸菌代谢物的孔周围出现浑浊不透明的抑制圈。在8 株抑制QS 的乳酸菌中,菌株 AJS2-4(安徽绩溪酸豆角)和 LZH1-3(辽宁省彰武酸黄瓜) 对嗜水气单胞菌QS 抑制作用较强,抑菌圈直径分别为13.81 mm 和12.25 mm(图1),因此选择菌株AJS2-4 做后续试验。

图1 乳酸菌菌株AJS2-4 和菌株LZH1-3 对紫色杆菌CV026 产紫色素的抑制效果Fig.1 Inhibtion effecs of LAB strain AJS2-4 and LZH1-3 on violacein production of C.violaceum CV026
2.2 乳酸菌粗提物对紫色杆菌CV026 及嗜水气单胞菌生长曲线的影响
为了验证菌株AJS2-4 是通过影响嗜水气单胞菌QS 系统而非抑菌的方式发挥作用,需研究菌株AJS2-4 粗提物对紫色杆菌CV026 和嗜水气单胞菌生长曲线的影响。如图2所示,乳酸菌粗提物质量浓度为32 mg/mL 和16 mg/mL 时,紫色杆菌CV026 和嗜水气单胞菌LY-2 的生长被完全抑制;乳酸菌粗提物质量浓度为8 mg/mL 时,紫色杆菌CV026 和嗜水气单胞菌LY-2 的OD 值分别降低0.46 和0.42;乳酸菌粗提物质量浓度为4 mg/mL 和2 mg/mL 时,紫色杆菌CV026 和嗜水气单胞菌LY-2 的生长曲线与对照组的生长趋势基本一致,说明菌株AJS2-4 粗提物质量浓度为4 mg/mL 和2 mg/mL 时,其对紫色杆菌CV026 和嗜水气单胞菌LY-2 没有抑菌活性。质量浓度4 mg/mL的粗提物被应用于后续研究。

图2 菌株AJS2-4 粗提物对紫色杆菌CV026 (a)和嗜水气单胞菌LY-2 (b)生长曲线的影响Fig.2 Effect of LAB crude extraction from strain AJS2-4 on growth curves of C.violaceum CV026 (a)and A.hydrophila LY-2 (b)
2.3 乳酸菌粗提物对生物膜形成的影响

图3 菌株AJS2-4 粗提物对嗜水气单胞菌LY-2 生物膜形成的影响Fig.3 Effect of crude extraction from strain AJS2-4 on biofilm microscopic of A.hydrophila LY-2
96 孔板法结果表明,4 mg/mL 的菌株AJS2-4粗提物对嗜水气单胞菌生物膜的抑制率为32.25%。图3是菌株AJS2-4 粗提物对嗜水气单胞菌生物膜影响的光学显微镜图片和扫描电镜图片。可以看出,采用光学显微镜观察时,对照组嗜水气单胞菌菌落浓密(图3a),而经菌株AJS2-4 粗提物处理的嗜水气单胞菌菌落密度较稀疏(图3b),表明菌株AJS2-4 粗提物可有效降低嗜水气单胞菌生物膜的形成。应用扫描电镜观察时,对照组细菌紧密聚集形成完整的生物膜,结构较致密(图3c),而经菌株AJS2-4 粗提物处理后,细菌已不能聚集形成片状的生物膜,结构稀薄疏松,细胞的完整性被破坏,表明菌株AJS2-4 粗提物不仅降低嗜水气单胞菌生物膜的生成量,也能使其生物膜结构破裂变得疏松(图3d)。SUN 等[27]研究发现水莱茵海默氏菌(Rheinheimera aquimaris)QSI02 提取物二酮哌嗪类化合物cyclo(Trp-Ser)质量浓度为0.2 mg/mL 时,对铜绿色假单胞菌PA01 生物膜抑制率达到59.9%,光镜和扫描电镜结果表明,二酮哌嗪类化合物cyclo (Trp-Ser) 使铜绿色假单胞菌PA01生物膜结构疏松,与本研究结果相似。
2.4 乳酸菌粗提物对嗜水气单胞菌AHLs 信号分子的降解效果
当外源AHLs 信号分子存在时,诱导紫色杆菌CV026 产生紫色菌素。图4是菌株AJS2-4 粗提物对嗜水气单胞菌AHLs 信号分子降解效果图。与对照组相比,菌株AJS2-4 粗提物质量浓度为4 mg/mL 时,使紫色晕圈变小且降解率为49.36%;用质量浓度为8 mg/mL 菌株AJS2-4 粗提物处理时,紫色晕圈完全消失,信号分子被完全降解。结果表明,菌株AJS2-4 粗提物对嗜水气单胞菌信号分子存在降解作用,从而抑制嗜水气单胞菌的QS 系统。Torres 等[28]将分离自贝类的南极超微细菌(Alteromonas stellipolaris)PQQ-42 与C6-HSL(10mmoL/L)信号分子共培养时,对C6-HSL 信号分子的降解率高达99.7%,进而抑制地中海弧菌 VibC-Oc-097(V.mediterranei)的QS,与本研究结果相似。

图4 菌株AJS2-4 粗提物对嗜水气单胞菌AHLs 降解效果Fig.4 Effect of crude extraction from strain AJS2-4 on AHLs-degradation
2.5 乳酸菌粗提物对嗜水气单胞菌群体感应抑制作用的影响因素
图5显示菌株AJS2-4 粗提物对蛋白酶的敏感性。可以看出,菌株AJS2-4 粗提物经木瓜蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶以及胰蛋白酶处理2 h 后对嗜水气单胞菌无QS 抑制活性,推测菌株AJS2-4 粗提物中对嗜水气单胞菌QS有抑制活性的物质为蛋白类物质。
表1是不同温度和pH 处理对菌株AJS2-4粗提物的影响。可以看出,菌株AJS2-4 粗提物经40,60,80,100 ℃和121 ℃处理30 min 后,抑制活性未发生显著性改变,表明菌株AJS2-4 中的蛋白类活性物质具有较好的热稳定性。此外,菌株AJS2-4 粗提物抑制QS 活性物质随着pH 的升高呈现逐渐降低趋势,在pH 5.0 时,抑制QS 的活性物质活性完全丧失,表明菌株AJS2-4 粗提物中具有QS 抑制作用的蛋白类活性物质在酸性条件下活性较好,受环境pH 影响较大。
2.6 乳酸菌菌株鉴定
菌株AJS2-4 的生理生化鉴定结果见表2,依照文献[24]、[25]可初步断定菌株AJS2-4 为植物乳杆菌(Lactobacillus plantarum)。

图5 蛋白酶对菌株AJS2-4 粗提物活性的影响Fig.5 Effect of protease on the activity of crude extraction from strain AJS2-4
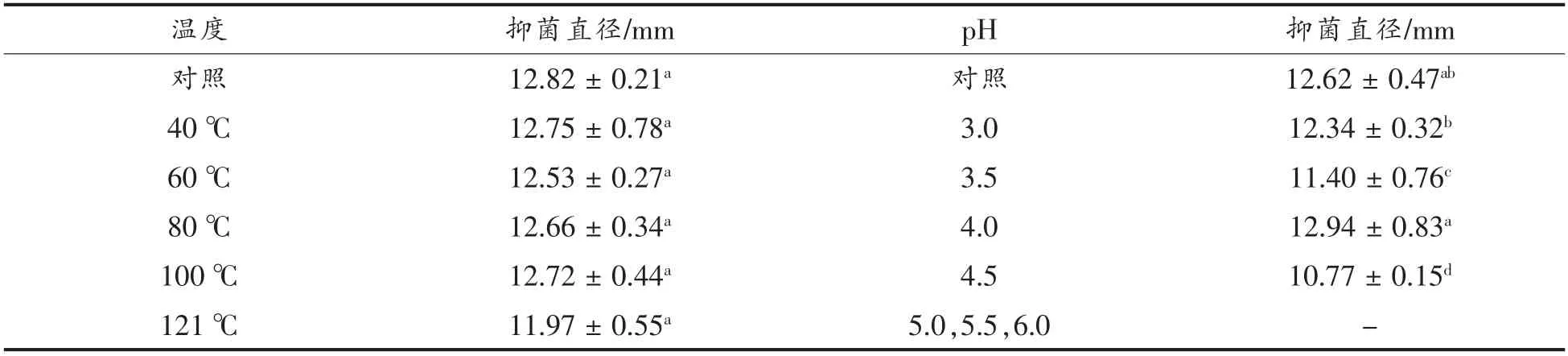
表1 温度和pH 处理对菌株AJS2-4 粗提物活性的影响Table 1 Effect of temperature and pH on crude extraction from strain AJS2-4

表2 菌株AJS2-4 的生理生化鉴定结果Table 2 Physiological and biochemical test results of strain AJS2-4
图6是菌株AJS2-4 的16S rRNA 基因扩增电泳图,结果显示菌株AJS2-4 核酸序列在1 400 bp 左右被成功扩增出一条特异性亮带。将PCR 扩增产物进行测序后,与NCBI 数据库中已知序列进行比对,并构建系统发育树(图7)。由图7可知,菌株AJS2-4 与植物乳杆菌(Lb.Plantarum)KF673529.1 在同一个分支上,置信度为99%。AJS2-4 被鉴定为植物乳杆菌(Lb.plantarum),该结果与生理生化鉴定结果相同。

图6 菌株AJS2-4 的16S rRNA 基因扩增电泳图Fig.6 PCR amplification of 16S rRNA gene of strain AJS2-4

图7 菌株AJS2-4 的16S rRNA 系统发育树Fig.7 The phylogenetic tree for sequences of strain AJS2-4
3 结论
从安徽绩溪酸豆角中获得1 株能够抑制嗜水气单胞菌QS 活性的乳酸菌菌株AJS2-4。该乳酸菌粗提物对嗜水气单胞菌生物膜的形成具有抑制作用,并通过降解AHLs 信号分子的方式抑制嗜水气单胞菌的QS 作用。初步分析菌株AJS2-4 粗提物中抑制QS 活性物质为蛋白类物质。通过生理生化试验和16S rRNA 序列分析菌株AJS2-4,被鉴定为植物乳杆菌(Lactobacillus plantarum)。本文从传统发酵蔬菜中获得微生物源性QSI,对挖掘新的乳酸菌生物资源以及研发高效的微生态制剂提供借鉴作用。

