Standford A型主动脉夹层术后患者1例二次应用体外膜肺氧合救治体会*
彭勤宝,孟维朋,官莉,刘亚湘,郑少忆
南方医科大学南方医院心血管外科(广东广州 510515)
心脏手术后有0.5%~1%的患者可发生心源性休克(postoperative cardiogenic shock,PCS)[1],此类患者中有1%~4%需要静脉-动脉体外膜肺氧合支持(veno-arterial extracorporeal membrane oxygenation,VA-ECMO)以维持循环稳定[2],脱机率约30%~60%不等,存活出院率只占43.6%,而院内死亡率可高达60%~80%[3-4]。急性A型主动脉夹层(acute type A aortic dissection,aTAAD)高达20%的术后死亡率明显高于其他心脏手术[5],一旦发生PCS需进行循环辅助,ECMO是替代主动脉内球囊反搏(IABP)的首选方式[6]。ECMO成功脱机而又二次运行一般出现在复杂先心病需分期手术的婴幼儿患者中[7],且成功率比单次ECMO更低,本病例为夹层术后成人病例,较为少见,现报告如下。
1 资料与方法
1.1 一般资料 患者,男,54岁,体重78 kg,因突发腰背部疼痛8 h,于2017年11月17日急诊收治入院。完善相关检查提示为aTAAD,夹层累及右冠状动脉起始段,于急诊下行“bentall+全弓置换+降主动脉支架置入+右侧大隐静脉-右冠状动脉旁路移植”术,关胸至第8小时突发右心衰竭,大剂量血管活性药支持下血压不能维持,最低血压55/33 mmHg(1 mmHg=0.133 kPa),右心室极度充盈,考虑到右下肢行大隐静脉取出术,为避免下肢静脉回流障碍引起相关并发症,于左侧股动、静脉置管行VA-ECMO,辅助至第60小时发生顽固性低血压,超声提示“急性二尖瓣腱索断裂并关闭不全(重度)”。
1.2 诊治方法 患者急性二尖瓣腱索断裂并重度关闭不全诊断明确后,急诊行再次开胸二尖瓣置换术(MVR),术中使用Stockert V型体外循环机,选用进口膜肺(Maquet-V71000),术中常规超滤(Dideco-SHF06),维持灌注流量为2.2~2.6 L/(min·m2),平均动脉压(MAP)在60~80 mmHg,使用超滤技术及输注红细胞使红细胞压积(Hct)在0.24~0.3之间,心肌保护采用升主动脉切开冠状动脉口直接灌注+冠状静脉窦逆行灌注,停跳液选用4∶1含血St.Thomas液灌至心电成一直线后加用HTK液灌注6~8 min。夹层手术采用腋动脉、右股动脉、右心房腔房管插管转流,在脱离体外循环(CPB)转接ECMO前于左侧股动静脉完成置管,ECMO系统采用乳酸林格液预充,开启ECMO转流即刻钳夹腔房管脱离CPB,缓慢回输CPB系统余血,于ECMO系统行改良超滤(Modified Urtrafiltration,MUF),30 min滤除液体5 900 mL,Hct由0.23提升至0.32。MVR手术沿用ECMO的血管通路,开胸后转接至CPB管路转流,ECMO系统余血使用乳酸林格液置换至CPB系统,而后使用10*10接头连接动静脉管路自循环待机备用,术毕转接回ECMO系统继续辅助,采用MUF调整Hct,围转流期血气指标满意(表1)。ECMO全程维持平均流量在3.5(1.9~5.2)L/min,离心泵转速在2 900~3 300 r/min,平均动脉压40~80 mmHg,使用肝素5~15 U/(kg·h)保持活化全血凝血时间值(ACT)在170~220 s之间,维持血温36~37℃。
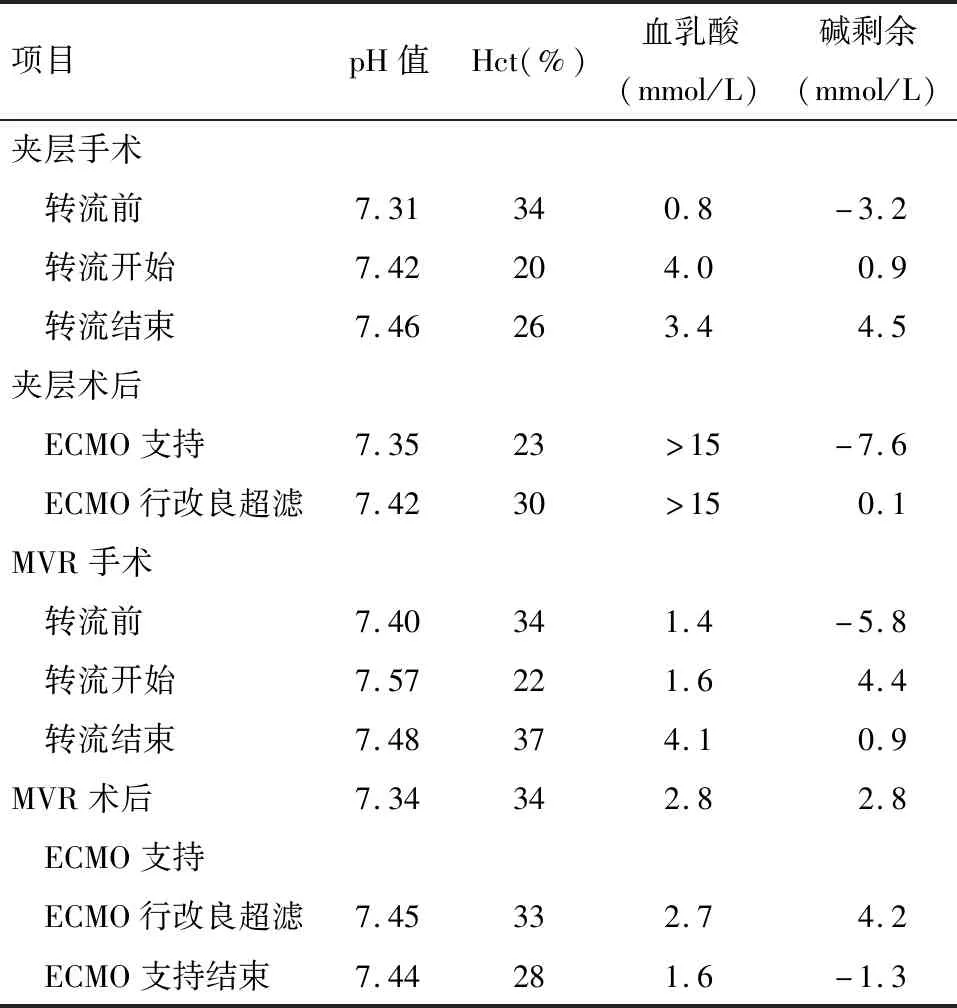
表1 CPB及ECMO期间血气指标
2 结果
术毕继续予ECMO二次辅助65 h后成功撤机,ECMO辅助合计125 h,2次CPB及ECMO支持阶段共用红细胞30单位,血浆3 000 mL,机采血小板2单位。MVR术后第12天行气管切开;第13天CT检查提示:小脑出血、蛛网膜下腔出血、脑梗死。予对症治疗,第28天恢复清醒,第30天因鼻腔真菌感染行部分鼻中隔切除术,第33天撤离呼吸机,40 d后转普通病房,64 d后完全康复步行离院,期间间断行持续肾替代治疗(CRRT)合计39 d后肾功能完全恢复,患者住院期间总花费将近98万人民币。
3 讨论
有回顾性分析研究表明对于aTAAD术后低心排且需要ECMO辅助的高风险患者,其住院死亡率超60%,术后并发症复杂,住院时间长,但长期随访表明存活患者的心功能可恢复至正常水平,在合理控制感染、出血等并发症的基础上ECMO仍是合适的治疗手段[8]。本例患者短期内经历2次CPB和ECMO,对灌注师从操作技术层面分析,首先要求在每一次的模式要严格落实各项无菌操作,文献报道ECMO支持期间医院感染发生率为9%~65%,感染者需CRRT治疗率、病死率等均高于非感染患者[9-10],再者需利落地完成管道的裁剪以及与新系统的对接,缩短操作过程短暂的循环支持缺失引起患者血流动力学的波动[11],三者考虑到费用问题,旧的ECMO组件在进行MVR术的过程中需以1 500 r/min的转速自循环备用,且受限于血源紧张,需在该系统上加装MUF组件以便提升患者Hct,减少因管路非血制品预充造成血液稀释对患者带来不良影响[12],各种复杂高风险的操作要求灌注师有良好的应对水平。
有单中心28年经验报道31例经历二次ECMO运行的患者只有18例(51.06%)顺利脱机,但只有7例(23%)顺利出院,6例经历3次ECMO运行的患者全部死亡,死亡原因为感染或不可逆器官损伤[13]。研究表明心脏术中无法脱离CPB直接转ECMO支持患者由于有持续的循环辅助,撤机后出院存活率更高[4],本例患者接受CPB或ECMO转流过程中均维持足够流量及较高的Hct水平和灌注压,使得乳酸水平快速降低至正常范围,酸中毒得以纠正,文献表明提供充分的氧供、维持良好的器官灌注有利于早期恢复[14]。在辅助循环阶段患者虽经历两次手术,创伤大,大量输血,但通过灌注师采取有针对性的转流计划,重视各种风险因素并积极预防和处理,对患者术后转归是有积极影响的。

