外科手术患者术前肾功能实验室评估指标分析*
郑小凤,蔡应木,吴洁,尹俊,吴映娥,赵颖,庄泽锐,李卓林,何超
1汕头大学医学院第一附属医院检验科(广东汕头 515041); 汕头大学医学院第二附属医院 2血液内科, 3神经外科,4普外科(广东汕头 515041)
对手术患者而言,麻醉、手术创伤、失血、低血压都会加重肾脏负担,一些药物会产生肾毒性,损害肾脏功能,术后容易并发急性肾损伤(AKI),增加术后预后风险及死亡率[1],因而,对术前肾脏储备功能有一定要求,然而目前临床上术前肾功能评估只有1977年goldman提出的goldman分级体系[2]中提到的血尿素氮(BUN)和血肌酐(Scr),这是肾功能评价的经典指标,但其具有局限性,容易受到肾外因素影响,因而Scr和BUN在评估肾功能储备上存在缺陷[3]。胱抑素(Cys C)被认为是一种能更好反映肾脏滤过功能的指标,是评价肾功能的一种敏感度好、特异度高的指标[4]。另外近年来有一些能早期评价肾功能储备的指标,例如中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)及肾损伤分子1(kidney injury molecule 1,Kim-1)[4],但临床上鲜少采用。鉴于围术期肾功能准备对手术患者十分重要,本研究就术前肾功能耐受力评估指标进行探讨,完善临床肾功能评价体系。
1 资料与方法
1.1 一般资料
1.1.1 研究对象及分组 住院患者组:选取2018年1—4月在汕头大学医学院第一附属医院住院的成年患者9 732例。手术患者组:选取2018年11月至2019年1月汕头大学医学院第一附属医院住院的手术患者70例,根据是否检测NGAL、Kim-1项目分为手术患者A组39例和手术患者B组31例。AKI组和非AKI组:选取的70例手术患者,参照KDIGO指南AKI的诊断标准[5],术后发生AKI的患者21例,非AKI的患者49例。
手术样本排除标准:(1)年龄<18岁的患者;(2)术前应用造影剂、肾毒性药物的患者;(3)肾脏肿瘤患者;(4)妊娠。所有患者手术均采用全麻。
1.1.2 仪器和试剂 仪器采用BECKMAN COULTER公司生产的BECKMAN COULTER-AU5800生化分析系统和GRIFOLS公司生产的变色龙Triturus®全自动开放式酶免分析系统;试剂由上海仁捷生物科技有限公司生产提供(生产批号:Jan 2019)。
1.2 方法
1.2.1 住院患者组 入选的9 732例患者入院24 h内均完善血Cys C、Scr、BUN等生化指标检查。
1.2.2 手术患者组 A组:术前24 h内完善血Cys C、Scr、BUN等生化指标检查,术后48 h内均再次复查。B组:24 h内完善血Cys C、Scr、BUN等生化指标检查,及NGAL、Kim-1检测,术后48 h内均再次复查。A、B两组中各检查项目性别及年龄分布比较差异无统计学意义(P>0.01),见表1、表2。
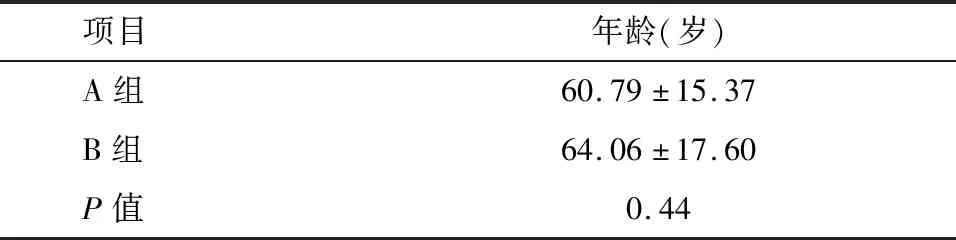
项目年龄(岁)A组60.79±15.37B组64.06±17.60P值0.44
1.2.3 AKI组与非AKI组 分析评估手术前后两组患者Scr、Cys C、NGAL及Kim-1数据。
血清NGAL及Kim-1采用酶联免疫吸附法(ELISA)方法进行检测,血Cys C采用乳胶增强免疫透射比浊法,实验步骤严格按照试剂盒说明书操作。
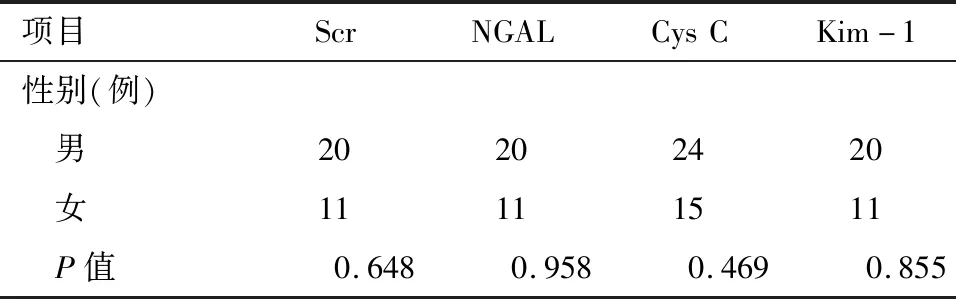
表2 手术患者组各检查项目内性别分布
1.2.4 CKD分期及AKI的诊断标准 参照2012年美国国家肾脏病基金会(NKF)制定的KDIGO对CKD进行以下分期[6],见表3。参照KDIGO指南AKI的诊断标准[5]:符合下列情形之一者即可定义为AKI(未分级):(1)在48 h内Scr上升0.3 mg/dL(≥26.5 μmol/L);(2)已知或假定肾功能损害发生在7 d之内,Scr上升至>基础值的1.5倍;(3)尿量<0.5 mL/(kg·h)。本研究GFR采用慢性肾脏疾病流行病学协作组(Chronic Kidney Disease Epidemiology Collaboration,CKD-EPI)肌酐公式计算[7]。

表3 美国肾脏病基金会对CKD的分期及建议
2 结果
2.1 Cys C与GFR的关系及其临界值 分析9 732例住院患者,可见,患者血清Cys C与GFR呈负性相关(r=0.697,P<0.01),在GFR<90 mL/(min·1.73 m2)时, Cys C的最佳临界点为0.82 mg/L,曲线下面积0.734(灵敏度64%,特异度70%,95%置信区间0.722~0.746,P<0.01),见图1; GFR<60 mL/(min·1.73 m2)时,Cys C的最佳临界点为1.01 mg/L,曲线下面积0.91(灵敏度81%,特异度84%,95%置信区间0.904~0.916,P<0.01),见图2;GFR<30 mL/(min·1.73 m2)时,Cys C的最佳临界点为1.675 mg/L,曲线下面积0.997(灵敏度97%,特异度99%,95%置信区间0.996~0.997,P<0.01),见图3。
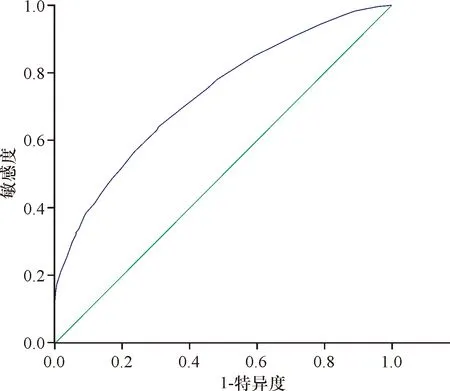
图1 GFR<90 mL/(min·1.73 m2)时Cys C的ROC曲线
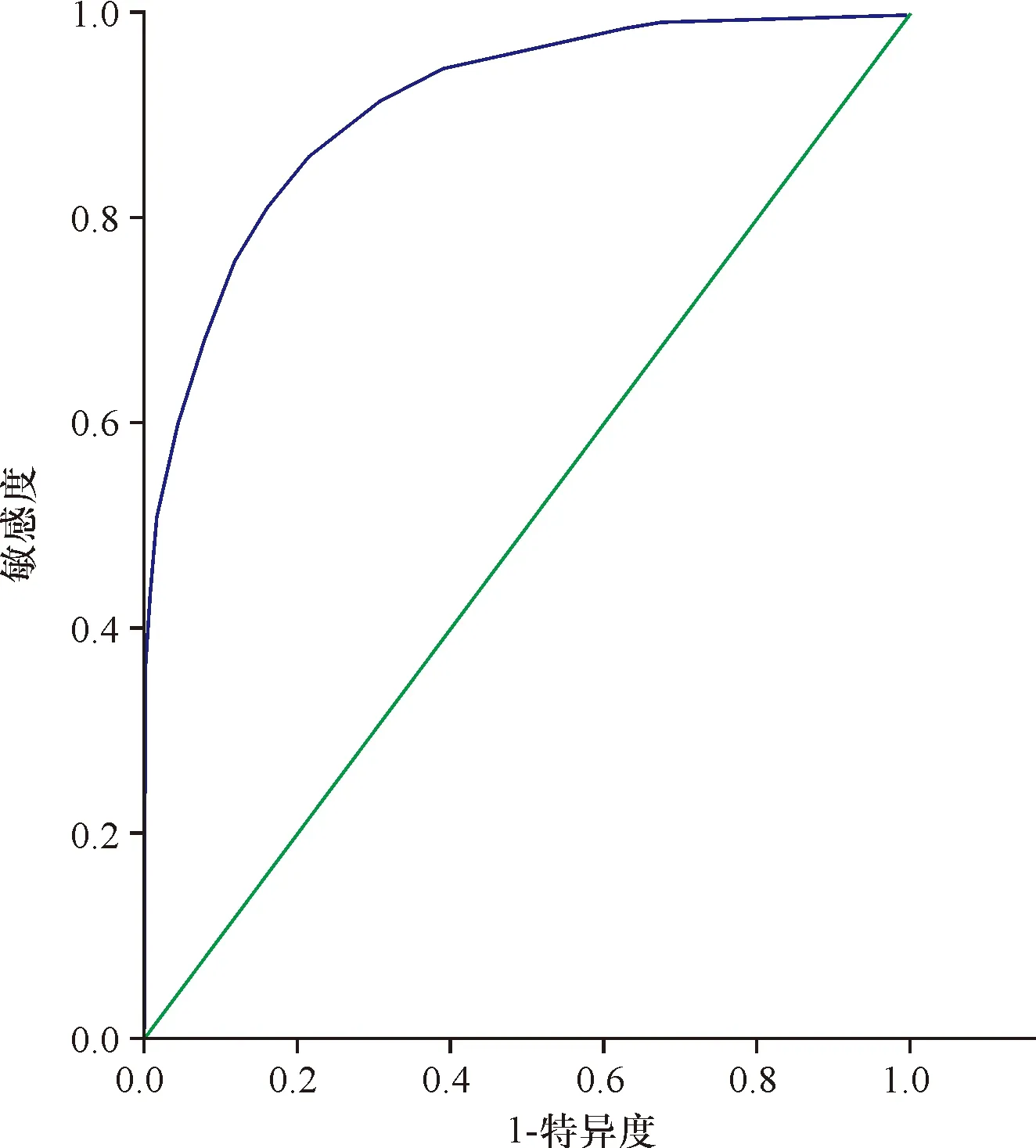
图2 GFR<60 mL/(min·1.73 m2)时Cys C的ROC曲线
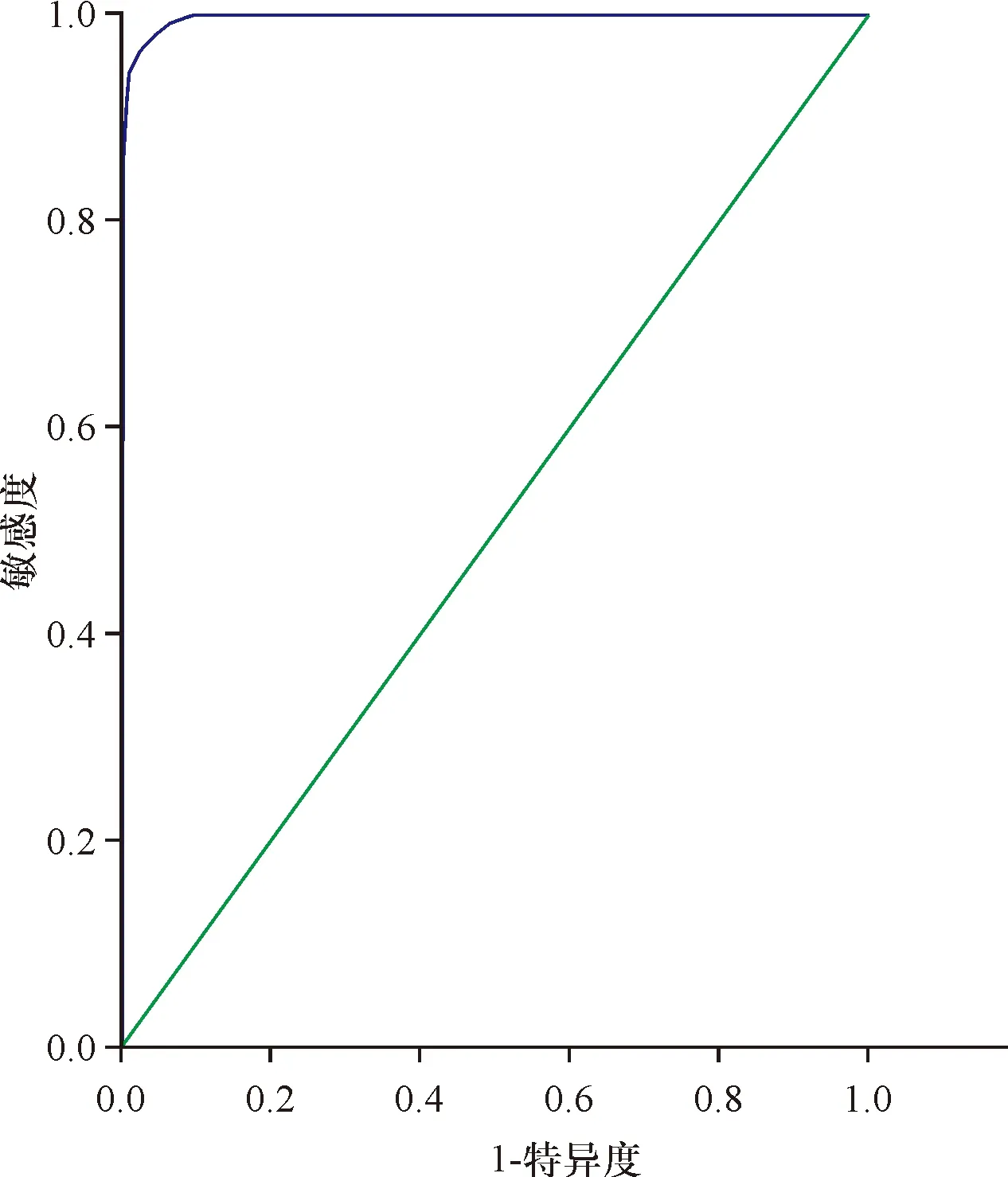
图3GFR<30mL/(min·1.73m2)时,CysC的ROC曲线
2.2 AKI组与非AKI组手术前后Scr、Cys C、NGAL及Kim-1比较 A组中,AKI组术后48 h内血Cys C升高水平较非AKI组显著,B组中,AKI组术后48 h内Scr、NGAL及Kim-1升高水平较非AKI组显著,差异有统计学意义(P<0.01),见表4。
2.3 Cys C、NGAL及Kim-1对 AKI的诊断价值 术后48 h内血Cys C的ROC曲线下面积为0.828(95%置信区间0.655~0.954,P=0.001),术后48 h内血Scr的ROC曲线下面积为0.769(95%置信区间0.624~0.914,P=0.007),在Cys C取1.315 mg/L时为诊断AKI的最佳临界点(灵敏度85%,特异度74%);术后48 h内血NGAL及Kim-1的曲线下面积分别为0.649(95%置信区间0.448~0.849,P=0.07)、0.714(95%置信区间0.514~0.915,P=0.02),见图4、图5。可见,在术后48 h内对AKI的诊断中,准确性为Cys C>Scr>Kim-1>NGAL。
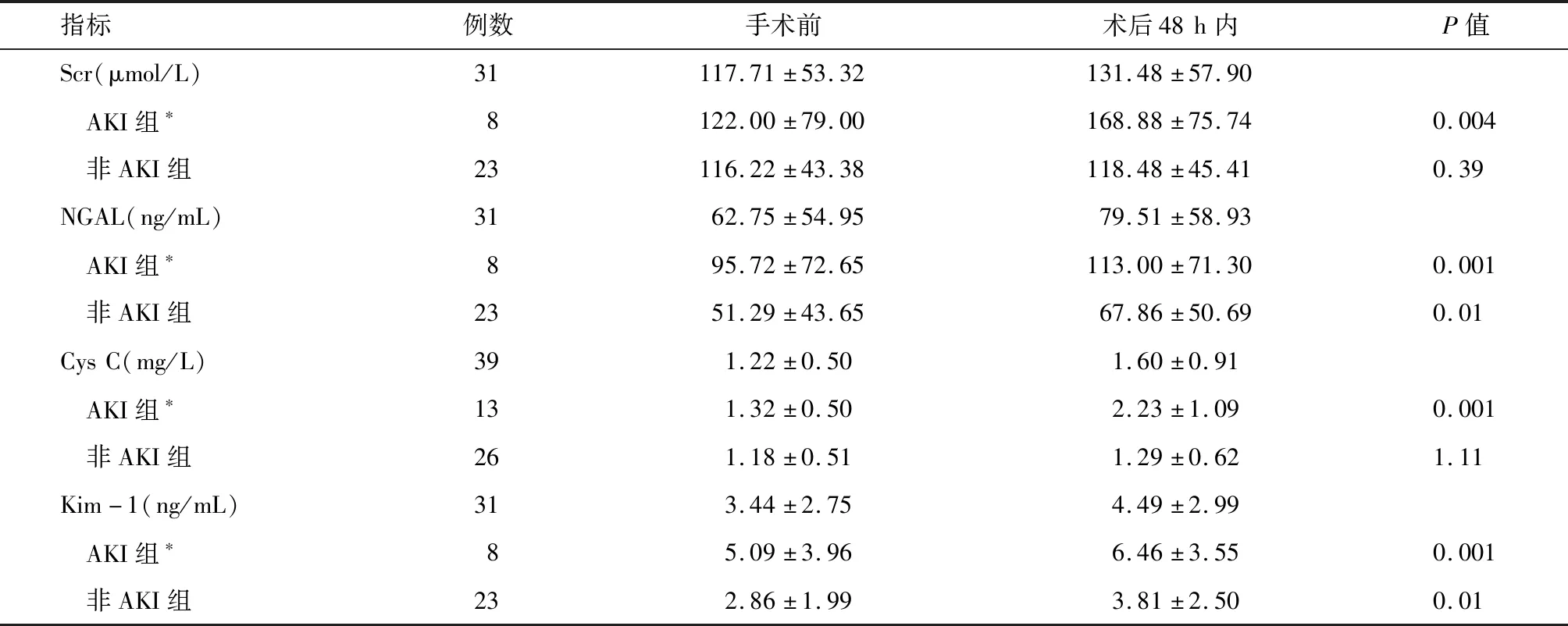
指标例数手术前术后48h内P值Scr(μmol/L)31117.71±53.32131.48±57.90 AKI组∗8122.00±79.00168.88±75.740.004 非AKI组23116.22±43.38118.48±45.410.39NGAL(ng/mL)3162.75±54.9579.51±58.93 AKI组∗895.72±72.65113.00±71.300.001 非AKI组2351.29±43.6567.86±50.690.01CysC(mg/L)391.22±0.501.60±0.91 AKI组∗131.32±0.502.23±1.090.001 非AKI组261.18±0.511.29±0.621.11Kim-1(ng/mL)313.44±2.754.49±2.99 AKI组∗85.09±3.966.46±3.550.001 非AKI组232.86±1.993.81±2.500.01
*与非AKI组比较P<0.01
3 讨论
肾功能储备下降的患者,正常无明显的临床表现,麻醉和手术可导致急性肾功能衰竭的危险性增加,术后发生AKI的严重后果死亡率高达50%,存活者多年存在肾功能不全或发展为慢性功能肾衰竭,仅有15%患者能完全恢复[8]。因此,手术前对患者进行肾储备功能评估对选择手术时机、术式、麻醉方式、使用药物减少诱发肾功能衰竭提高手术安全性有重要意义。目前临床上主要以Scr及BUN作为术前肾功能的评估,但是Scr及BUN容易受到诸多因素的影响,如蛋白摄入量、消化道出血等,且当GFR下降到1/2时血BUN才升高,GFR下降到1/3时Scr才明显升高,结果并不可靠[9]。
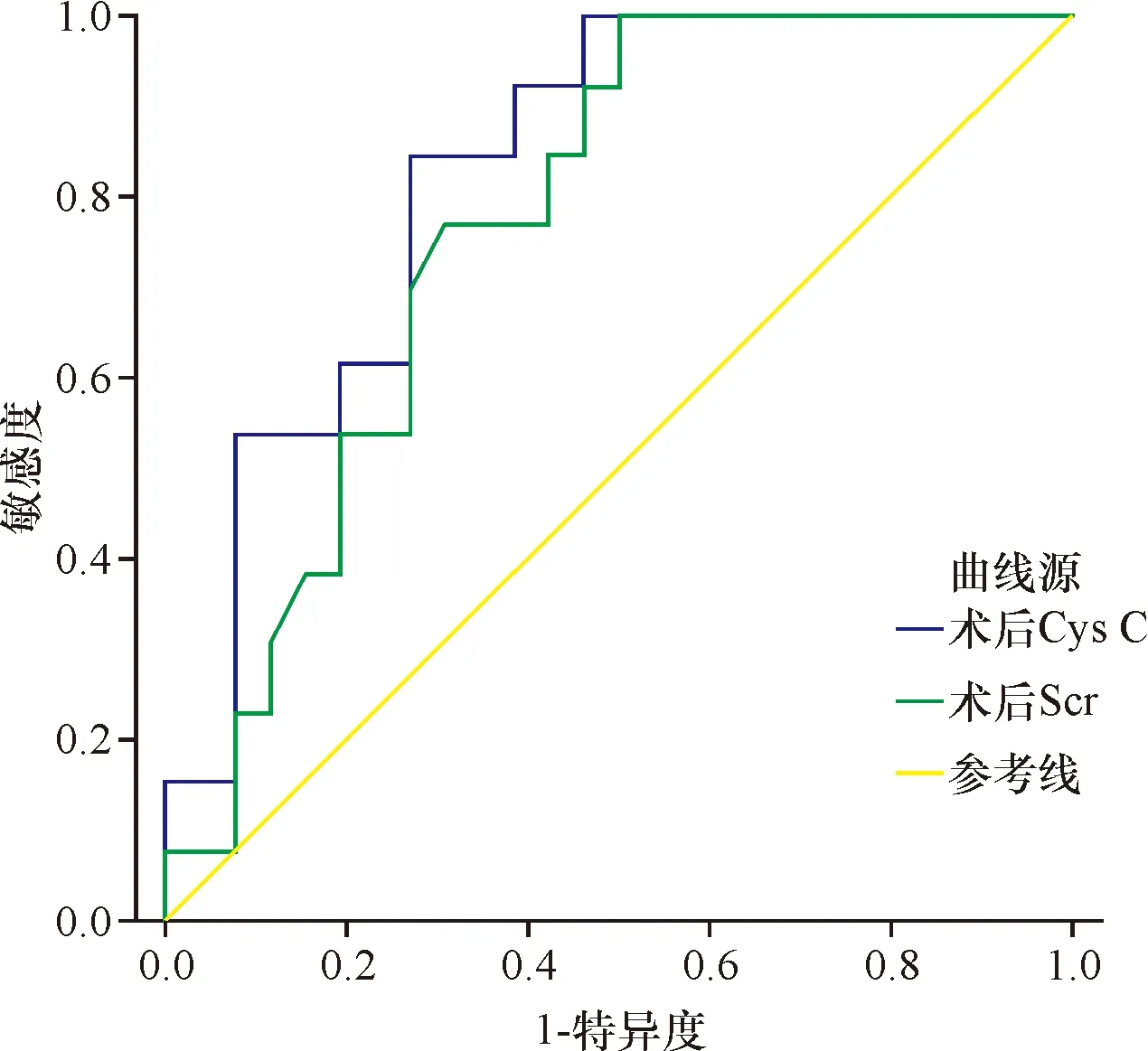
图4 Cys C、Scr术后48 h内诊断AKI的ROC曲线
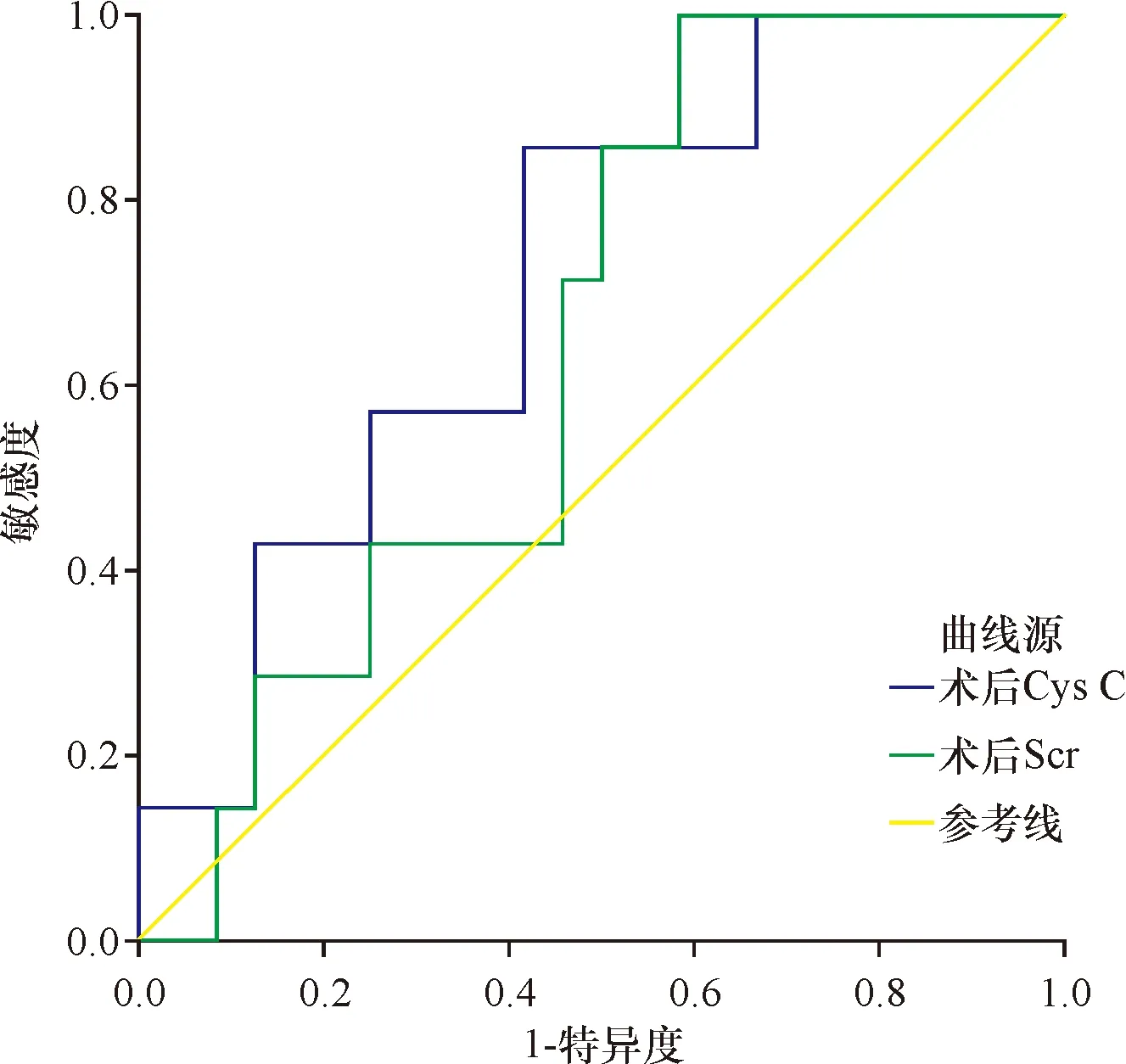
图5 NGAL、Kim-1术后48 h内诊断AKI的ROC曲线
近年来很多研究发现,Cys C、NGAL、Kim-1等标志物可以早期识别肾功能损害,尤其是Cys C,这也对手术患者术后发生AKI的预测起到一定作用[10]。Cys C是一种半胱氨酸蛋白酶抑制剂,广泛存在于各种组织的有核细胞和体液中,是一种低分子量,碱性非糖化蛋白质,循环中的Cys C仅经肾小球滤过而被清除[11],其浓度由肾小球滤过决定,不受性别、年龄、饮食、肌肉量的影响,当肾功能受损时,Cys C在血液中的浓度随GFR的变化而变化[12]。本研究手术患者70例中,术后发生AKI 21例,因而,早诊断、早治疗AKI是降低病死率的关键因素,有必要对术前肾功能进行评估,并做好术前准备。本研究发现,相较于非AKI组,术后48 h内AKI组的血Cys C较术前明显升高(P<0.01),且由ROC曲线分析可见,Cys C在AKI的诊断上准确度明显高于其他指标。
本研究结合Cys C的术前临界值及肾功能损伤分级(RIFLE分级)[13]充分评估,结合美国肾脏病基金会对CKD的分期及建议[6](表1),就评估的结果对术前肾功能准备及AKI预防提出以下意见[6]:(1)术前Cys C≤0.82 mg/L,GFR无异常,重点治疗原发病;(2)术前0.82 mg/L
NGAL是一种分泌性糖蛋白,正常表达于中性粒细胞、肾小管上皮细胞、肝实质细胞等[15]。研究显示,当肾缺血或毒素急性损伤肾小管时,受损的肾小管内皮细胞高表达NGAL,因而NGAL是一种应用于AKI的标志物[16]。本研究发现,相较于非AKI组,术后48 h内AKI组的血NGAL较术前明显升高(P<0.01),提示AKI组的患者血NGAL水平能够较好地反映肾功能的损害。但在本研究中,NGAL诊断AKI的准确度还不够。
Kim-1是肾脏近曲小管上皮细胞一种跨膜糖蛋白,在正常肝、肾、脾微量表达,而在受损后再生的近曲小管上皮细胞中表达显著增强[17]。本研究结果显示:相较于非AKI组,术后48 h内AKI组的血Kim-1值较术前明显升高(P<0.01),但在AKI的诊断上准确性不及Cys C及Scr。
综上所述,单纯的术前Scr筛查对肾功能损害评估存在缺陷,而Cys C、NGAL和Kim-1对肾功能早期损伤具有预测作用,验证了以往的研究[9]。ROC曲线在临床诊断上具有重要的意义[18],用该曲线确定了Cys C的最佳临界值及Cys C、Scr、NGAL、Kim-1对AKI的诊断价值,可见,对于行手术的患者,应将这3项指标纳入手术患者术前肾脏储备功能的评估体系中,结合goldman分级体系对肾功能进行全面评估,并对术前肾功能受损的患者及时作出处理,提高手术耐受力,降低手术风险及减少术后并发症的发生。但本研究存在一定的不足:首先,本研究以Scr计算GFR,但Scr对肾功能损害的诊断本身就不灵敏,特异度也不高;其次,本研究中NGAL及Kim-1不及Scr敏感,考虑选取的样本量较少,因而,对于NGAL及Kim-1的研究需要大样本进一步验证其在手术耐受力评估中的价值;另外,手术方式及麻醉对肾功能的影响未进行探讨。

