珠子草药材质量标准及HPLC指纹图谱研究
潘新波 王信 萨日娜 李彩东 张伟

摘要:目的 建立珠子草药材的质量标准及HPLC指纹图谱,探讨不同产地珠子草药材成分的差异性。方法 分别从性状、鉴别、检查和浸出物、含量测定方面对珠子草药材的质量标准进行研究。采用ZORBAX Eclipse plus C18色谱柱(250 mm×4.6 mm,5 ?m),以乙腈-0.1%磷酸水溶液作为流动相进行梯度洗脱,柱温25 ℃,检测波长270 nm,流速1.0 mL/min,进样量10 ?L,对10个不同产地珠子草药材进行测定;采用相似度分析和主成分分析对指纹图谱进行评价。结果 拟定了珠子草药材质量标准草案,建立了10个不同产地珠子草药材的HPLC指纹图谱,确定了8个共有峰,指认了短叶苏木酚和柯里拉京2个特征峰。不同产地珠子草的化学成分组成及含量存在一定差异,其中柯里拉京可作为区别产地的特征性物质。结论 本研究建立的定性定量检测方法操作简便、准确可靠、专属性强、重复性好,可作为珠子草药材的质量控制方法;建立的珠子草HPLC指纹图谱可为该药材的鉴别及质量控制提供参考。
关键词:珠子草;质量标准;高效液相色谱法;指纹图谱;相似度分析;主成分分析
中图分类号:R282 文献标识码:A 文章编号:1005-5304(2019)07-0066-07
Abstract: Objective To establish the quality standards and HPLC fingerprints of Phyllanthus niruri Linn.; To study the differences in the components of Phyllanthus niruri Linn. from different producing areas. Methods The quality standards of Phyllanthus niruri Linn. was studied from characters, identification, inspection with extract, and content determination. The HPLC separation was performed on ZORBAX Eclipse plus C18 column (250 mm × 4.6 mm, 5 ?m). The mobile phase was acetonitrile-0.1% phosphoric acid water in gradient elution; the column temperature was 25 ℃; the detection wavelength was 270 nm; the flow rate was 1.0 mL/min; the sample volume was 10 ?L. Phyllanthus niruri Linn. from ten different producing areas were determined; similarity analysis and principal component analysis were used to analyze the fingerprints. Results The quality standard of Phyllanthus niruri Linn. was drafted. The HPLC fingerprints of Phyllanthus niruri Linn. from ten different producing areas were established with eight common peaks, and two characteristic peaks included brevifolincarboxylic acid and corilagin were confirmed. There were some differences in the chemical components and content of Phyllanthus niruri Linn. from different producing areas, of which corilagin could be used as the characteristic material to distinguish the difference of producing areas. Conclusion The qualitative and quantitative determination method is simple, accurate and reliable, with good stability and reproducibility, which can be used for the quality control of Phyllanthus niruri Linn. The established HPLC fingerprints can be used for the identification and quality control of Phyllanthus niruri Linn.
Keywords: Phyllanthus niruri Linn.; quality standards; HPLC; fingerprints; similarity analysis; principal component analysis
珠子草Phyllanthus niruri Linn.為大戟科叶下珠属植物,又名月下珠、小返魂、霸贝菜,全草入药,是印度与我国的传统民间草药,具有平肝清热、利水解毒功效,临床用于治疗肝炎、肠炎、尿路感染、无名肿痛及糖尿病等[1-2]。研究显示,珠子草主要活性成分为多酚类及木脂素类,其中多酚类包括柯里拉京、没食子酸和鞣花酸等[3-4]。迄今对珠子草药材的基础研究主要集中在化学成分、药理作用及机制方面,临床研究主要集中在抗乙肝病毒、改善肝功能和抗肝细胞纤维化等方面[5-7],而针对珠子草有效成分含量、质量综合评价与控制的研究相对较少,限制了珠子草药材的应用和开发。珠子草曾收载于地方标准2005年版《云南省中药材标准》,只有简单的性状描述等,质量标准不完善。为了更好开发利用珠子草,合理评价和控制该药材的质量,对其质量标准进行提高和系统性研究尤为必要。
本课题组前期对珠子草药材进行了生药学鉴别研究[8],基于此,本试验依据2015年版《中华人民共和国药典》(一部)中药质量标准研究制定技术要求,对珠子草药材进行深入的质量标准研究,并建立10个不同产地的珠子草药材HPLC指纹图谱,进行相似度分析和主成分分析,比较不同产地珠子草药材HPLC成分差异性,为更好地控制珠子草药材质量提供依据。
1 仪器与试药
美国Agilent 1260高效液相色谱仪(四元梯度泵,DAD检测器,OpenLAB色谱工作站),XPE105十万分之一电子分析天平(梅特勒托利多公司),KH-100E超声波提取器(昆山禾创超声仪器有限公司),BX51生物显微镜(日本Olympus公司),WH-43电热恒温干燥箱(天津市泰斯特仪器有限公司),TDW箱式电阻炉(上海东星建材试验有限公司),XMTD-204恒温水浴锅(江苏新康医疗器械有限公司)。
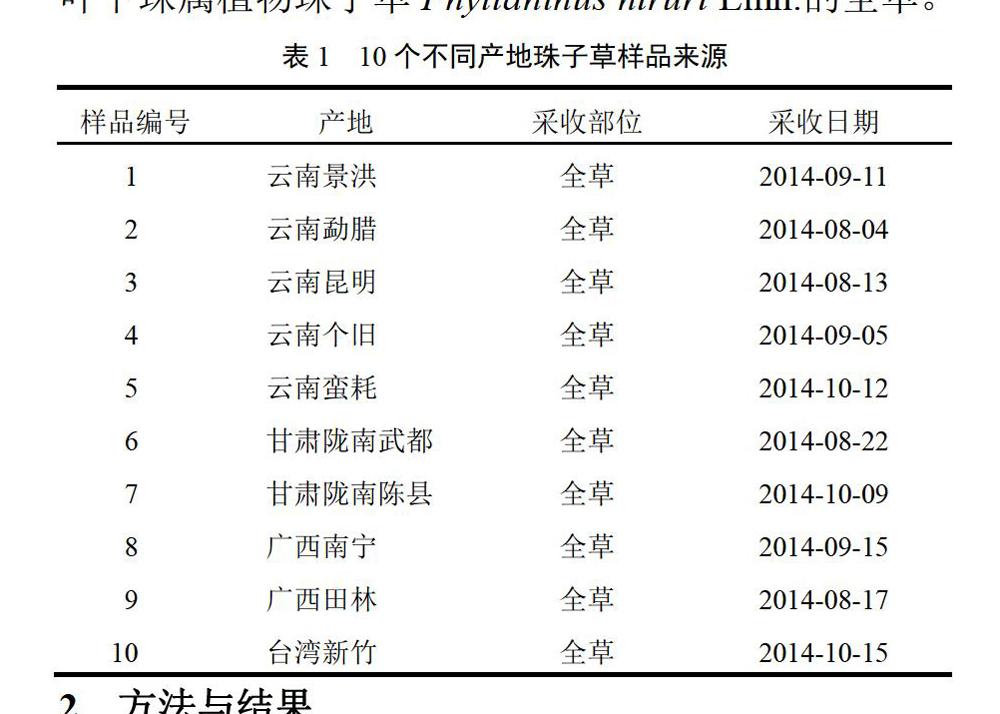
短叶苏木酚对照品(德尔塔林试剂公司,批号18490-0805,纯度≥98%),柯里拉京对照品(中国食品药品检定研究院,批號111623-200302,纯度≥98%),鞣花酸对照品(天津一方科技有限公司,批号00597,纯度≥97%),珠子草对照药材(中国食品药品检定研究院,批号121319-200301),乙醇(分析纯,天津市红岩化学试剂厂),盐酸(分析纯,北京化工厂),磷酸(色谱纯,天津市科密欧化学试剂有限公司),乙腈(色谱纯,山东禹王实业有限公司化工分公司),甲醇(色谱纯,深圳西陇化工股份有限公司),薄层硅胶G板(青岛海洋化工集团公司),水为超纯水,其他试剂均为分析纯,无灰滤纸(杭州特种纸业有限公司)。10个不同产地珠子草药材样品来源见表1,经西北师范大学王庆瑞教授鉴定为大戟科叶下珠属植物珠子草Phyllanthus niruri Linn.的全草。
2 方法与结果
2.1 性状
本品长短不一,高20~70 cm,根外表棕色至红棕色,直径2~6 mm,有纵纹,质硬、脆易折,折断面棕色至灰绿色;主根不发达,须根多数,浅灰棕色。茎圆柱形,略带褐红色,直径1~4.5 mm,有纵皱纹,体轻,质脆,易折断,断面灰绿色,髓部中空。单叶互生,叶片纸质,长圆形,长约4~10 mm,宽约2~4.5 mm,叶柄极短,托叶披针形。花细小,腋生于叶背之下。蒴果扁圆形或略呈圆三角形,直径1~1.5 cm,红褐色,平滑无毛,轴柱及花萼均宿存;种子6枚,三角状卵形,淡黄色或灰黄色,背侧为上下纵纹,侧面为同心圆状纹理。以叶多、青绿色者为佳。气微香,味苦。
2.2 鉴别
2.2.1 显微鉴别
根横切面:表皮为3~4列长方形细胞,切向排列。皮层较宽,少有裂隙,由数列疏松的薄壁细胞组成。韧皮部狭窄,呈环带状,韧皮射线不明显,筛管散列,内含黄棕色分泌物。形成层呈环状,为一列扁平细胞。初生木质部导管较集中,次生导管稀疏略呈放射状排列,射线细胞1~2列径向延长,导管多角形,直径8.4~39.0 ?m。木质部宽广,木射线密集,由1~2列细胞组成,射线间嵌有导管、木纤维及木薄壁细胞,导管单个或2~7个径向相聚成群、呈放射状排列,外侧常有木纤维嵌于导管群间,薄壁细胞含淀粉粒。
茎横切面:表皮3~4列细胞,类方形,常脱落。皮层5~7列类圆形、矩圆形细胞,排列较疏松。韧皮部约6列类圆形、类多角形细胞,筛管内充满分泌物。形成层为一列小型细胞,环状排列。木质部宽广,导管稀疏,木射线明显。薄壁细胞呈环状分布,木质部纤维发达,壁极厚,胞腔狭小。射线细密,1~3列长方形细胞径向延长。髓部薄壁细胞类圆形,排列疏松,髓中央常呈空腔。
粉末特征:全草粉末灰绿色,味苦。木纤维常成束,黄色或淡黄色,断端平截或纵成帚状,直径7.8~18.2 ?m,长80.6~447.2 ?m。草酸钙簇晶散在或存在于叶肉组织中,直径10.4~28.6 ?m;草酸钙方晶众多,不规则,呈四面体、锥形、斧形等,直径5.2~26 ?m。叶上下表皮细胞多角形,周壁弯曲,下表皮气孔密集,气孔不定式或不等式,副卫细胞3~4个。淀粉粒单粒,稀复粒,类圆形,脐点裂缝状、人字状等,大小不一,直径5.2~18.2 ?m[8]。
2.2.2 薄层鉴别
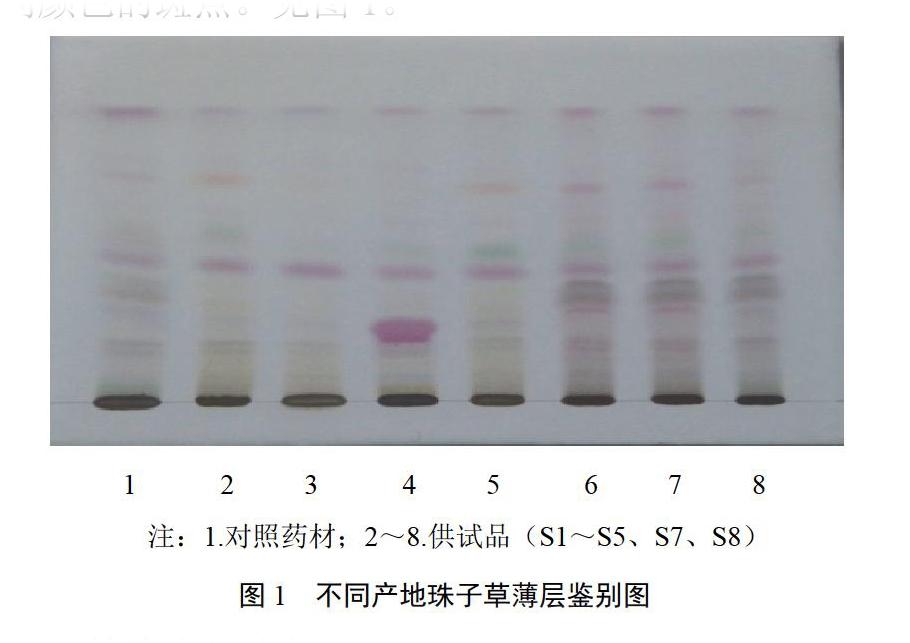
取本品粉末1 g,加甲醇20 mL,超声(功率800 W,频率50 kHz)处理10 min,过滤,滤液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取珠子草对照药材粉末1 g,照供试品溶液制备方法制成珠子草对照药材溶液。照薄层色谱法(2015年版《中华人民共和国药典》通则0502)试验,依次吸取对照药材溶液和供试品溶液各10 ?L,分别点于同一硅胶G板上,以环己烷-氯仿-乙酸乙酯-冰乙酸(5∶1∶1∶0.1)为溶剂上行展开,取出,挥干溶剂,喷以10%硫酸乙醇溶液,105 ℃加热至斑点显色清晰,日光下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。见图1。
2.3 检查和浸出物
2.3.1 杂质
按2015年版《中华人民共和国药典》(四部)通则2301杂质检查法,取供试品约5 g,称定质量,用肉眼或借助放大镜(5~10倍)观察,将杂质(泥土、其他等)拣出;如其中有可以筛分的杂质,则通过适当的筛,将杂质分出。将各类杂质分别称重,计算,结果见表2。10个不同产地珠子草药材样品杂质含量在2.02~3.10%之间,应将其杂质标准在其平均值2.41%的基础上上浮20%,故将杂质含量暂定为不得超过3.0%。
2.3.2 水分、灰分及浸出物
按2015年版《中华人民共和国药典》(四部)通则0832第二法烘干法测定水分;按通则2302灰分测定法测定总灰分和酸不溶性灰分;按通则2201浸出物测定法冷浸法,用乙醇作溶剂,测定醇溶性浸出物。结果见表3。
2.4 含量测定
2.4.1 色谱条件
色谱柱:ZORBAX Eclipse plus C18(250 mm×4.6 mm,5 ?m);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~20 min,3%~15%A;20~45 min,15%~28%A;45~60 min,28%~45%A);流速:1 mL/min;柱温:25 ℃;检测波长:270 nm;进样量:10 ?L。
2.4.2 混合对照品溶液的制备
分别取鞣花酸、短叶苏木酚及柯里拉京对照品适量,精密称定,置棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得每1 mL分别含鞣花酸0.046 8 mg、短叶苏木酚0.028 8 mg和柯里拉京0.045 2 mg的混合对照品溶液,置于4 ℃避光保存备用。
2.4.3 供试品溶液的制备
取本品粉末(过2号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇20 mL溶解,称定质量,超声(功率800 W,频率50 kHz)提取30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,用0.45 ?m微孔滤膜过滤,取续滤液,即得。
2.5 方法学考察
2.5.1 精密度试验
精密吸取6号供试品溶液10 ?L,按“2.4.1”项下色谱条件连续进样测定6次,以柯里拉京为参照峰,计算各共有峰的相对保留时间及相对峰面积,结果相对保留时间RSD<0.25%,相对峰面积RSD<3.75%,表明仪器精密度良好。
2.5.2 重复性试验
精密称取同一批珠子草样品(6号)粉末6份,按“2.4.3”项下方法制备供试品溶液,精密吸取10 ?L,按“2.4.1”项下色谱条件分别进样测定,计算各共有峰的相对保留时间及相对峰面积,结果相对保留时间RSD<0.64%,相对峰面积RSD<2.17%,表明该方法重复性良好。
2.5.3 稳定性试验
取6号供试品溶液,按“2.4.1”项下色谱条件分别于制备后0、4、8、12、24 h进样测定,结果相对保留时间RSD<0.31%,相对峰面积RSD<2.58%,表明供试品溶液在24 h内基本稳定。
2.6 指纹图谱的建立与相似度分析
取10个不同产地珠子草样品,按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件分别进样测定,记录色谱图。采用国家药典委员会《中药色谱指纹图谱相似度评价系统(2004A)》软件,以S6样品色谱图为参照谱图,多点校正后经自动匹配,中位数法生成样品叠加色谱图(见图2)和共有模式(见图3)。通过供试品与对照品色谱峰相对保留时间及紫外吸收谱图比对,确定4号峰为短叶苏木酚,5号峰为柯里拉京。
2.7 主成分分析
以10个不同产地珠子草样品HPLC图谱的全时段检测信号为原始数据,通过数学组合,生成一个9000×10的矩阵,矩阵的列代表不同产地的珠子草样品。将此矩阵导入SPSS19.0软件,进行主成分分析,结果见表4、表5。以10个不同产地珠子草样品HPLC图谱数据集的前3个特征主成分(PC1、PC2、PC3)作投影,分析结果见图4。
2.8 含量测定
2.8.1 线性关系考察
分别精密吸取“2.4.2”项下混合对照品溶液2.0、5.0、10.0、15.0、20.0 ?L,按“2.4.1”项下色谱条件进样测定,以对照品进样量为横坐标,色谱峰面积为纵坐标,绘制标准曲线,得短叶苏木酚、柯里拉京和鞣花酸的回归方程分别为Y=138.444X-37.799(r=0.999 6)、Y=84.837 9X-10.874(r=0.999 2)、Y=122.9X+13.29(r=0.999 5),分别在0.057 6~0.576 ?g、0.090 4~0.904 ?g和0.093 6~0.936 ?g范围内线性关系良好。
2.8.2 精密度试验
精密吸取混合对照品溶液各10 ?L,按“2.4.1”项下色谱条件连续进样测定6次,以混合对照品峰面积积分值计算,短叶苏木酚、柯里拉京和鞣花酸色谱峰的峰面积RSD分别为1.40%、1.72%和1.39%,结果表明仪器精密度良好。
2.8.3 重复性试验
精密称取同一批珠子草样品(6号)粉末6份,按“2.4.3”项下方法制备供试品溶液,精密吸取10 ?L,按“2.4.1”项下色谱条件分别进样测定,短叶苏木酚、柯里拉京和鞣花酸色谱峰的峰面积RSD分别为0.64%、1.52%和0.13%,结果表明该方法重复性良好。
2.8.4 稳定性试验
取6号供试品溶液,按“2.4.1”项下色谱条件分别于制备后0、4、8、12、24 h进样测定,短叶苏木酚、柯里拉京和鞣花酸色谱峰的峰面积RSD分别为2.49%、1.24%和1.31%,结果表明在室温条件下该供试品溶液24 h内稳定性良好。
2.8.5 加样回收率试验
精密稱定9份已知含量的珠子草样品粉末(6号),每份1.0 g,平均分为3组,按“2.4.3”项下方法制备低、中、高浓度的供试品溶液,分别精密吸取10 ?L,注入高效液相色谱仪,以外标法进行测定,每个浓度测定3次,结果见表6。
2.8.6 样品测定
将10个不同产地珠子草样品按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件分别进样测定,每批平行测定3份,分别计算样品中短叶苏木酚、柯里拉京和鞣花酸的含量,结果见表7。
3 讨论
本研究分别从性状、鉴别、检查和浸出物、含量测定四方面对珠子草药材的质量标准进行研究,所建立的珠子草薄层色谱定性鉴别和指标成分(短叶苏木酚、柯里拉京和鞣花酸)含量HPLC同时测定方法操作简便、重复性好、专属性强,可用于该药材的质量控制和评价。
本研究以10个不同产地珠子草药材为对象,建立了珠子草HPLC指纹图谱,确定了8个共有峰,以对照品色谱图指认了其中2个色谱峰,分别为短叶苏木酚和柯里拉京。相似度评价结果表明,不同產地珠子草药材中化学成分存在的差异性与其产地具有一定的相关性。
主成分分析作为一种无监督模式识别法,利用降维思想,将多个变量简化为几个综合变量,最大限度保留原样本集所含的原始信息,建立的新变量为原变量的线性组合,寻求主成分,以达到数据的压缩和解释目的[9]。不同产地珠子草中化学成分组成及含量存在一定差异,主成分分析结果与样品地理分布结果吻合度较高,且与HPLC指纹图谱相似度评价结果及薄层鉴别结果也较为相似,能够反映出不同产地珠子草化学成分的差异性和相似性。此外,在所识别筛选出的6个用于区别产地差异的特征性物质中指认柯里拉京,初步推测其可作为区别产地差异的特征性物质。从本研究结果可以初步得出,不同产地珠子草中化学成分与其所在产地具有相关性,其原因可能与产地的气候、土壤等环境条件有关,具体还需进一步研究。
总之,本研究建立了同时测定珠子草中短叶苏木酚、柯里拉京和鞣花酸的HPLC方法,对不同产地珠子草样品进行测定。通过对测定结果进一步对比研究发现,不同产地珠子草中短叶苏木酚、柯里拉京和鞣花酸的含量差异较大,有同一省份珠子草中上述3种成分含量较为相似者,如1号和4号(云南景洪和云南个旧);也有地理位置较为相近但3种成分含量差异较大者,如6号和7号样品(甘肃省陇南市武都和陈县),以及4号和5号样品(云南个旧与云南蛮耗)。这一研究结果与主成分分析结果较为相似,从而进一步论证了化学模式识别技术(如主成分分析)可用于区别珠子草的来源(产地)。
本研究补充完善并拟定了珠子草质量标准草案,利用常规指纹图谱数据分析方法结合主成分分析对不同产地珠子草药材进行评价,可为建立珠子草药材整体性质量评价体系提供基础和依据。
参考文献:
[1] 程新平,牛晓峰,朱周才.珠子草生药学研究[J].西安医科大学学报(医学版),2001,22(2):162-163.
[2] 朱宇同,李秉滔,方宏勋.珠子草新亚种的发现和鉴定[J].广州中医药大学学报,1997,14(2):119-121.
[3] KODAKANDLA V S, BIKRAM S, RAGHUNATH S T, et al. Antihepatotoxic princinple of Phyllanthus niruri herbs[J]. Journal of Ethnopharmacoligy,1985,14(l):41-44.
[4] UENO H, HORIE S, NISHI Y, et al. Chemical and pharmaceutical studies on medicinal plants in Paraguay. Garaniin, an angiotensin-converting anzyme inhibitor from “paraparai mi,” Phyllanthus niruri[J].Journal of Natural Products,1988,51(2):357-359.
[5] SOMANABANDHU A. 1H- and 13C-nmr assignment of phyllanthin and hypophyllanthin:lingnans that enhance cytotoxic responses with cultured multidrug-resistant cells[J]. Journal of Natural Products,1993,56(2):261-267.
[6] SNATOS A R. Analgesic effects of callus culture extracts from selected species of Phyllanthus in mice[J]. Journal of Pharmacy and Pharmacology,1994,46(9):755-759.
[7] CIMANGA R K, TONA L, LUYINDULA N, et al. In vitro antiplasmodial activity of callus culture extracts and fractions from fresh apical stems of Phyllanthus niruri L.(Euphorbiaceae):part 2[J]. Journal of Ethnopharmacoligy,2004,95(2/3):399-404.
[8] 李彩东,吴斌,杨静.珠子草的生药鉴定[J].中药材,2000,23(9):522- 523.
[9] KARD D. Evaluation of trace metal concentration in some herbs and herbal teas by principal component analysis[J]. Journal of Food Chemistry,2009,114(1):347-354.

