血管内皮生长因子、基质细胞衍生因子-1基因对人微血管内皮细胞增殖、迁移、凋亡的影响
高静,李晓岚,王敏哲,刘贯英,杨雪松
作者单位:新疆医科大学第五附属医院内分泌科,新疆维吾尔自治区 乌鲁木齐 830054
近年较多动物模型在研究分析糖尿病视网膜病变发生、发展机制时,发现一些细胞因子参与调控了此过程[1-2],其中对新生血管生成有重要作用的血管内皮生长因子(VEGF)已成为学者们的研究热点。目前实验资料结果已经推测VEGF可能调控了视网膜病变的形成,可能与VEGF具有提高血管通透性、促内皮细胞迁移、增殖等功能密切相关[3],且最新研究发现在大鼠糖尿病模型实验中,一旦抑制VEGF的表达,大鼠视网膜病变会出现显著改善[4]。基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是最近发现的一种由骨髓基质细胞及其他组织基质细胞分泌的细胞因子,它具有趋化活性的功能。前有研究认为,SDF-1和VEGF一样,也参与了糖尿病大血管病变和微血管病变过程[5-7],但其在调控的作用机制目前尚不明确,而SDF-1和VEGF之间是否存在相互调节的作用以及其相互作用机制也尚无定论。本研究自2017年1—5月对人微血管内皮细胞HMEC-1进行体外培养,分别以siRNA介导低表达VEGF、SDF-1处理细胞,观察处理后细胞增殖、凋亡、迁移状况的变化情况,从而为进一步探讨VEGF和SDF-1在糖尿病视网膜血管病变中的可能作用机制提供理论依据。
1 材料与方法
1.1材料人微血管内皮细胞HMEC-1购自上海信裕生物技术有限公司。从GenBank中获得已知的人VEGF和mRNA的序列VEGF、SDF-1,VEGF165、SDF-1 siRNA由上海吉玛公司合成,非特异随机序列由上海吉玛公司赠送。DMEM培养基和10%胎牛血清购自北京方程生物公司,脂质体lipofectamineTM 2000购自美国Santa Cruz公司。BCA法蛋白定量测定试剂盒、VEGF、SDF-1兔抗人抗体均购自福建迈新生物工程公司、β-actin鼠单克隆抗体购自Anbo公司。
1.2方法
1.2.1细胞培养 人微血管内皮细胞HMEC-1培养于DMEM培养基内,其中含10%FBS,细胞传代至对数生长期开始实验。
1.2.2实验分组和转染 实验分成4组,分别为空白对照组(Ⅰ组),转染非特异性对照组(Ⅱ组),转染si VEGF165组(Ⅲ组),转染si SDF-1组(Ⅳ组)。对各组的转染操作过程如下:①在各组的6孔细胞培养板中加入生长状态良好的HMEC-1细胞;②对Ⅱ组,Ⅲ组和Ⅳ组分别加入Scramble RNA 20 nmol/L、si VEGF165 20 nmol/L、si SDF-1 20 nmol/L,三组均加入适量Lipofect 2000TM;③24 h后收集细胞;④对Ⅰ组的人微血管内皮细胞HMEC-1不作任何处理。
1.2.3Western印迹法 采用Western印迹法检测稳定转染细胞株中VEGF165、SDF-1蛋白表达变化。操作过程:(1)提取蛋白:将各组细胞接种于6孔细胞培养板,加3 mL 4℃预冷的PBS洗涤细胞,加入400 μL含PMSF的裂解液,使细胞充分裂解,于4℃下12 000 r/min离心5 min,吸取上清,放于-80℃保存。(2)Bradford法测定蛋白浓度:首先把不同浓度的标准品加进96孔板中,并将待测样品2.5 μL加进测试孔,均稀释10倍后在测定总蛋白浓度,计算出标准曲线方程。(3)Western Blot检测:缓慢地在样孔中加入样品,经过两种不同的SDS-PAGE电泳(浓缩胶60 V;分离胶100 V),分别为5%和10%各2 h;转印在Bio-Rad电转仪中进行,之后封闭硝酸纤维素膜,取出漂洗3次,保存于杂交袋中,内含有1∶1 000的一抗,保持温度4℃下,持续缓慢地摇动过夜。第二天先进行漂洗3次后将硝酸纤维素膜取出放进另外一个杂交袋中,内含有1∶2 000的二抗,温度为室温,缓慢地继续摇动1 h。取出漂洗3次后以actin为内参对照,进一步显影,感光,定影,均在暗室内操作;用Quatity One软件对得到的图片进行分析其条带灰度值。
1.2.4MTT增殖检测 取各组转染后细胞,调制成1×105/mL细胞悬液接种在96孔培养板内,每孔加入200 μL培养基,培养的48 h后去除培养基,加入含l mg/mLMTT的培养基,37℃继续培养4 h后,小心弃去孔内培养上清液,每孔加入150 μL二甲基亚砜(DMSO)液,室温下将平板在微孔板上震荡,使结晶物溶解后用酶联免疫检测仪检测波长490 nm处测吸光度OD值,取4个复孔的平均值。抑制率=(1-实验孔OD值/对照孔OD值)×100%。
1.2.5流式细胞仪(FCM)检测细胞凋亡变化 收集转染后各组细胞,调制浓度为2×105/mL的细胞悬液,500~1 000 r/min离心5 min,弃去培养液。PBS洗涤1次,离心去PBS,加入冰预冷的70%的乙醇固定 1~2 h,离心弃去固定液,PBS 重悬 5 min。400目的筛网过滤1次,500~1 000 r/min离心5 min,弃去PBS,收集悬浮细胞。加入1 mL PI染液染色,4℃避光30 min。细胞经过PI染色后,上流式细胞仪,荧光被PI激发氩离子而产生,激光光波波长为488 nm,发射光波波长大于630 nm,产生红色荧光分析PI荧光强度的直方图,用Cellquest软件分析处理荧光强度,得出各组细胞凋亡百分比。细胞凋亡指数(AI)=亚二倍体峰细胞数/总细胞数×100%。
1.2.6划痕愈合实验 收集转染后各组细胞,在24孔板每孔接种1×105个细胞,在37℃5%CO2环境下培养24 h,在孔板中央划一条宽度为0.8 mm的横线,并在横线等距离间隔作5个标记以为下一步测量做准备。继续置于37℃5%CO2环境下培养48 h,在培养前(0 h)和培养后(48 h)均采用相差显微镜观察,沿横线边缘作为数据测定点,测量横线两侧的细胞间距离(μm)变化,测量时取平均值。HMEC-1的迁移距离(迁移能力)=0 h横线边沿的距离-48 h后细胞迁移边沿的距离。
1.3统计学方法数据采用SPSS18.0统计软件进行整理分析,以±s来表示计量资料,多组间数据资料采用单因素方差分析(Anova),组间资料采用lsd-t检验。计数资料采用χ2检验。
2 结果
2.1Western印迹法检测VEGF165、SDF-1蛋白的表达转染了VEGF165-siRNA后,Ⅲ组VEGF165、SDF-1蛋白的表达强度均明显弱于Ⅰ组和Ⅱ组,差异有统计学意义(t=9.836,8.279,7.846,8.045,P<0.05);转染了SDF-1-siRNA后,Ⅳ组SDF-1蛋白的表达强度均明显弱于Ⅰ组和Ⅱ组,差异有统计学意义(t=7.381,7.984,P<0.05),而VEGF165蛋白表达变化差异无统计学意义(P>0.05)。Ⅰ组与Ⅱ组比较,VEGF165、SDF-1蛋白表达水平差异无统计学意义(P>0.05)。见图1,表1。

图1 si VEGF165和si SDF-1处理HMEC-1细胞24 h下调VEGF165、SDF-1的蛋白表达水平:I为空白对照组;Ⅱ为转染非特异性对照组;Ⅲ为转染si VEGF165;IV:转染si SDF-1
表1 转染后HMEC-1细胞中VEGF165、SDF-1蛋白的相对表达比较/±s

表1 转染后HMEC-1细胞中VEGF165、SDF-1蛋白的相对表达比较/±s
注:与Ⅰ组比较,aP<0.05;与Ⅱ组比较,bP<0.05
组别Ⅰ组Ⅱ组Ⅲ组Ⅳ组F值P值VEGF165 1.92±0.42 1.87±0.35 0.48±0.07ab 1.76±0.09 6.067 0.018 SDF-1 1.29±0.38 1.32±0.47 0.62±0.08ab 0.37±0.05ab 4.589 0.038
2.2VEGF165-siRNA、SDF-1-siRNA对人微血管内皮细胞HMEC-1增殖、凋亡的影响经siRNA转染后,Ⅲ组和Ⅳ组细胞均出现增殖抑制率和凋亡率明显增高,与Ⅰ组和Ⅱ组比较,差异有统计学意义(P<0.05)。但Ⅲ组和Ⅳ组之间比较,Ⅲ组细胞增殖抑制率和凋亡率增高更显著(t=6.217,5.487,P<0.05),差异有统计学意义。Ⅰ组与Ⅱ组比较,细胞增殖抑制率和凋亡率均差异无统计学意义(P>0.05)。表明经VEGF165 siRNA和SDF-1siRNA转染均对HMEC-1细胞增殖能力具有抑制作用,对细胞发生凋亡具有明显的促进作用,但VEGF165 siRNA转染的作用更显著。见表2,图2。
2.3VEGF165-siRNA、SDF-1-siRNA对人微血管内皮细胞HMEC-1体外迁移力的影响细胞迁移实验中,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组迁移距离分别为(579.65±11.59)μm、(553.76±9.47)μm、(234.72±10.28)μm、(318.36±9.95)μm,Ⅲ组和Ⅳ组细胞明显 少 于 Ⅰ 组 和 Ⅱ 组(t=10.972,9.894,8.426,7.904,P<0.05),差异有统计学意义,而Ⅰ组与Ⅱ组之间,差异无统计学意义(P>0.05),其中Ⅲ组和Ⅳ组之间比较,Ⅲ组细胞明显少于Ⅳ组(t=5.907,P<0.05),差异有统计学 意 义 。说明VEGF165、SDF-1表达的下调抑制了人微血管内皮细胞HMEC-1的迁移能力,且经转染VEGF165 siRNA后的人微血管内皮细胞HMEC-1的迁移能力下降更显著。见图3,表3。
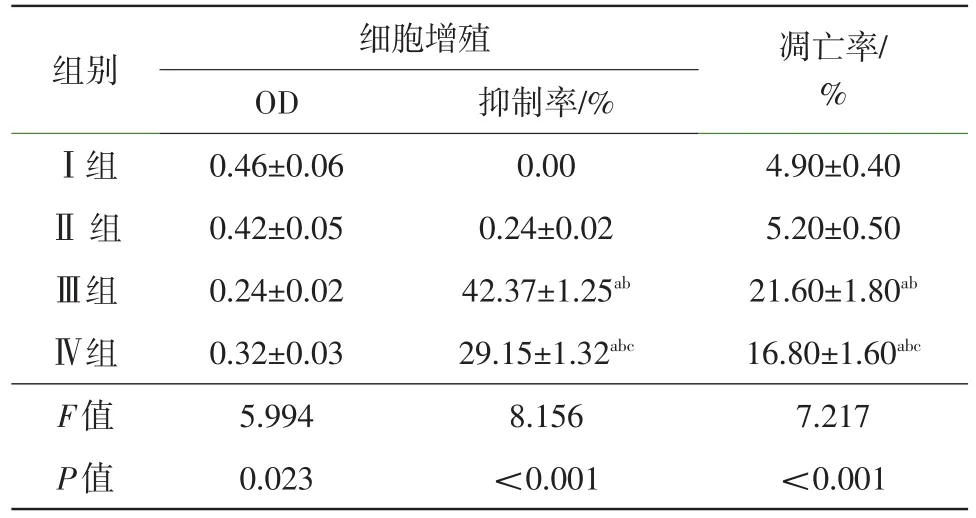
表2 转染后各组HMEC-1细胞的增殖能力、凋亡情况比较/xˉ± s
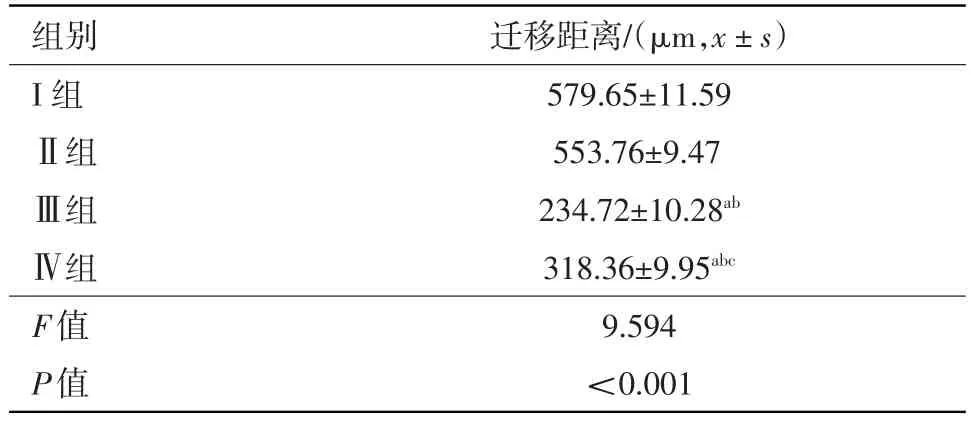
表3 VEGF165-siRNA、SDF-1-siRNA对人微血管内皮细胞HMEC-1体外迁移力的影响

图2 各组人微血管内皮细胞HMEC-1凋亡率的检测结果:A为Ⅰ组,B为Ⅱ组,C为Ⅲ组,D为Ⅳ组

图3 VEGF165-siRNA、SDF-1-siRNA对人微血管内皮细胞HMEC-1体外迁移力的影响检测:A为Ⅰ组,B为Ⅱ组,C为Ⅲ组,D为Ⅳ组
3 讨论
VEGF的促血管新生作用最初是1989年由研究者发现的,之后它一直是人们的研究热点。越来越多的动物实验以及体外实验均已经证明了,VEGF具有促进内皮细胞的生长增殖、促血管通透及诱导血管形成的作用。VEGF家族包括VEGF-A、B、C、D和PIGF,其中VEGF-A与生理/病理情况下的血管生成、血管形成密切相关[8]。VEGF基因根据不同剪接分为5种异构体:VEGF121、145、165、189及206,其中VEGF165是最为常见的形式,因其在生理病理反应中的重要作用被定义为优势异构体。目前实验结果推测VEGF对内皮细胞作用及新生血管形成的影响可能是糖尿病视网膜病变的发生、发展过程的机制之一[9]。SDF-1是CXC家族的趋化因子蛋白,也属于重要的血管生成蛋白之一,主要在低氧条件下由基质细胞分泌表达,对肿瘤的生长转移以及血管生成的调节起着重要作用[10-11]。以往研究表明[12]SDF-1能够促进血管新生部位邻近的血管内皮细胞迁移、增殖、形成管样结构,并通过动员募集血管前体细胞参与血管的生成,在修复损伤的过程中起到重要作用。最新研究发生,SDF-1能够诱导内皮祖细胞,促使它从骨髓向缺血的视网膜组织集聚,从而参与糖尿病病人视网膜血管病变发生[13-14]。现研究认为,SDF-1和VEGF的表达均参与了糖尿病大血管病变和微血管病变过程[4],但目前对于二者之间的关系以及作用机制尚无定论。
在基因研究领域中,将外源性或内源性双链RNA(dsRNA)导入细胞后,调节和关闭相应基因的表达,进而调控细胞的各种高级生命活动,这种发生在转录后的基因静寂现象被称之为RNA干扰[15-16]。本研究为探讨VEGF、SDF-1基因对人微血管内皮细胞HMEC-1增殖、迁移、凋亡中的作用,根据VEGF、SDF-1基因mRNA特点,设计了siRNA序列,分别转染了人微血管内皮细胞HMEC-1后,结果发现转染VEGF165-siRNA组和转染SDF-1-siRNA组细胞均出现增殖抑制率和凋亡率明显增高,与空白对照组和转染非特异性对照组比较,差异有统计学意义(P<0.05)。但转染VEGF165-siRNA组和转染SDF-1-siRNA组之间比较,转染VEGF165-siRNA组细胞增殖抑制率和凋亡率增高更显著。表明经VEGF165 siRNA和SDF-1siRNA转染均对HMEC-1细胞增殖能力具有抑制作用,对HMEC-1细胞发生凋亡具有明显的促进作用,但其中VEGF165 siRNA转染的作用更显著。推测VEGF、SDF-1基因均能促进HMEC-1的增殖能力,并抑制HMEC-1的凋亡,从而在糖尿病血管病变发生发展中发挥作用,而通过转染siRNA阻断它们的表达,能降低微血管内皮细胞的增殖,促进细胞凋亡,可推测两者对微血管内皮细胞的作用可能为糖尿病视网膜血病变治疗提供新的靶点[17-18]。
本研究采用Western Blot方法检测VEGF、SDF-1蛋白表达水平,结果发现转染了VEGF165-siRNA后,Ⅲ组VEGF、SDF-1蛋白的表达强度均明显弱于空白对照组和转染非特异性对照组(P<0.05);转染了SDF-1-siRNA后,Ⅳ组SDF-1蛋白的表达强度均明显弱于空白对照组和转染非特异性对照组(P<0.05),而VEGF蛋白表达变化差异无统计学意义。表明人微血管内皮细胞HMEC-1转染siRNA后,均出现相应基因表达的蛋白水平下降,而转染了VEGF165-siRNA后,不仅VEGF蛋白表达水平降低明显,同时伴随SDF-1蛋白表达下降。这与前面提到VEGF165 siRNA转染对HMEC-1细胞增殖、凋亡能力的作用更显著是相符的,证明了抑制VEGF表达可以下调SDF-1表达水平,两者之间可能存在密切联系,VEGF对SDF-1的表达具有调节机制。
本研究细胞迁移实验结果显示,转染VEGF165-siRNA组和转染SDF-1-siRNA组细胞迁移距离明显少于空白对照组和转染非特异性对照组(P<0.05),而转染VEGF165-siRNA组和转染SDF-1-siRNA组之间比较,转染VEGF165-siRNA组细胞迁移距离明显少于转染SDF-1-siRNA组(P<0.05)。说明VEGF、SDF-1表达的下调抑制了人微血管内皮细胞HMEC-1的迁移能力,且经转染VEGF165 siRNA后的人微血管内皮细胞HMEC-1的迁移能力下降更显著[19-20]。提示两者在对微血管内皮细胞迁移能力的调节过程中,VEGF对SDF-1表达具有调节机制,这可能为寻找预防及治疗糖尿病视网膜血管病变提供了新的策略[21-23]。

