食管鳞状细胞癌中SOX2和Slug的表达及与肿瘤出芽之间的关系
雍翔,宋瑞,胡怀远,武世伍,秦燕子,吴琼
(1皖北煤电集团总医院病理科,蚌埠,234000;2蚌埠医学院第一附属医院病理科,蚌埠 233000)
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是一种高度恶性肿瘤,外科手术切除是ESCC治疗的重要手段,但大量的患者手术切除后早期就发生局部复发或远处转移,从而导致其预后较差[1,2]。因此研究与其复发及转移相关的因素,具有重要的临床意义。
细胞丢失上皮特征获得间叶细胞特征称为上皮-间质转化(epithelial-to-mesenchymal transition,EMT),起初在胚胎发育过程中发现[3],越来越多的研究显示肿瘤细胞丢失上皮表型,获得间叶细胞表型可导致其迁移及侵袭的能力增加[4]。肿瘤组织内一小部分细胞具有自我更新及向多种方向分化的潜能称为肿瘤干细胞(cancer stem cells ,CSCs),其最初由Dick和coworkers等[5]在白血病中发现。多个研究证实刺激肿瘤细胞参与EMT过程与其获得CSCs表型密切相关[6,7]。
SOX2基因属于SRY相关高迁移组转录因子,位于染色体3q26.33。SOX2在胚胎干细胞自我更新及维持未分化状态中起关键作用[8]。在胶质瘤及髓母细胞瘤的研究显示,SOX2是CSCs的标志物之一,并且在维持CSCs的干细胞状态过程中起重要作用[9,10]。ESCC的染色体扩增发现部分病例具有染色体3q26.33扩增,导致SOX2蛋白的高表达。进一步的研究显示异常表达SOX2和FOXE1或FGFR2可以导致气管、支气管上皮永生化[11]。皮肤、子宫颈、肺、口腔、咽喉等部位的鳞状细胞癌的研究均发现SOX2的异常表达[12,13],基于这些研究目前认为SOX2是ESCC的致癌基因,并且可能成为潜在的靶向药物研究的新靶点[11-13]。
Slug是Snail家族的一员,最近的研究显示Slug可以结合E-cadherin启动子的近端E-box从而抑制E-cadherin的表达[14]。ESCC的研究显示Slug在肿瘤的转移过程中起关键作用,Slug表达与E-cadherin表达明显呈负相关,提示Slug表达可能与ESCC患者预后差有关[15,16]。
肿瘤出芽是指在浸润性肿瘤细胞巢的边缘出现单个或成簇的未分化细胞的形态学现象[17],ESCC的研究显示肿瘤出芽与高临床分期、血管侵犯、肿瘤分化差等明显呈正相关,高肿瘤出芽率明显降低患者生存率[18]。
SOX2,Slug及肿瘤出芽三者的关系在ESCC中的研究较少,本试验采用免疫组织化学染色技术检测89例食管鳞状细胞癌及癌旁组织中SOX2和Slug的表达情况,并且HE观察计数肿瘤出芽发生率,探讨三者之间的关系及其在ESCC浸润和转移过程中的作用。
材料和方法
1 一般资料
收集皖北煤电集团总医院病理科2016年至2019年存档的89例ESCC手术切除标本及癌旁组织的石蜡包埋块。患者术前患者未接受过放,化疗,临床资料完整。年龄46~79岁,平均61岁。依据2010版WHO食管鳞状细胞癌分期标准临床分期为I及Ⅱ期共58例,Ⅲ+Ⅳ期共31例。依据2010年WHO诊断标准,高分化29例,中分化48例,低分化12例;浸润肌层45例,浸润纤维膜44例;淋巴结转移的25例,未发现转移的64例。癌旁组织取自手术切缘。
2 主要试剂
SOX2兔抗人单克隆抗体(克隆号SP79,滴度1:100,Abcam公司),Slug鼠抗人多克隆抗体(克隆号sc-15391,滴度1:75, Santa Cruz 公司),Ultra-Sensitive试剂盒及DAB显色液均购自于福州迈新生物技术有限公司。
3 免疫组织化学染色与结果判定
石蜡切片经高温高压抗原修复后进行EnVision二步法免疫组织化学染色,DAB显色。PBS代替一抗做阴性对照,已知阳性切片做阳性对照。SOX2表达主要定位于细胞核,少数胞质阳性。Slug表达主要定位于细胞核及细胞质。阳性判读标准:阳性细胞率<5%为0分,6%-25%为1分,26%-50%为2分,>50%为3分;染色强度:无染色0分,浅黄色1分,棕黄色2分,棕褐色3分,两者乘积小于2分为阴性,大于2分为阳性表达[19]。
4 肿瘤出芽的判读
89例ESCC的HE切片均全部由2位作者重新阅片,肿瘤出芽定义为单个或少于5个细胞的肿瘤细胞团出现在浸润灶的前端。每例ESCC均在200倍放大倍数下选择肿瘤出芽最多处进行计数。肿瘤出芽数量>3为阳性(图1),<3为阴性[20]。
5 统计分析
采用Spass19.0统计软件进行统计分析。计数资料采用χ2检验,SOX2、Slug及肿瘤出芽之间的相关性采用Spearman等级相关分析,P<0.05为差异有统计学意义。

图1 HE染色检测ESCC组织中阳性肿瘤出芽(箭头)。比例尺,60μmFig. 1 Observation of tumor budding (arrows) in ESCC tissue by HE staining. Scale bar, 60μm
结 果
1 SOX2和Slug在ESCC中高表达
免疫组织化学检测显示,SOX2(图2A)和Slug(图2B)在ESCC中的表达率分别为53.93%和68.53%,显著高于癌旁组织中SOX2和Slug的阳性率(31.46%和31.46%)(表1)。
2 SOX2和Slug的表达及肿瘤出芽与ESCC临床病理因素的关系
卡方分析显示(表2),ESCC中SOX2的表达升高与浸润深度达纤维膜,淋巴结出现转移及高临床分期明显相关,SOX2表达升高与患者性别,年龄,肿瘤分化程度及肿瘤大小无明显相关性。在肿瘤分化较低,浸润深度达纤维膜,淋巴结出现转移及高临床分期的ESCC患者中,Slug表达明显升高,差异具有统计学意义,然而Slug表达明显升高与患者的性别,年龄及肿瘤大小无明显相关性。肿瘤出芽率增高明显与ESCC的分化程度,浸润至纤维膜,淋巴结出现转移及高临床分期明显相关,而与患者性别,年龄及肿瘤大小无明显相关性。
3 ESCC组织中SOX2,Slug表达与肿瘤出芽之间的相关性
Spearman相关性分析显示,ESCC组织中SOX2表达升高与Slug表达升高明显呈正相关关系,Slug表达升高与肿瘤出芽明显呈正相关关系(表3)。
讨 论
肿瘤细胞获得CSCs表型后促进EMT的过程在多个研究中均有证实[6,7],EMT过程是一个动态的过程,细胞丢失黏附分子、获得间叶性表型,增加了细胞运动、侵袭能力及抗凋亡的能力。肿瘤出芽是指在浸润性肿瘤细胞巢的边缘出现单个或成簇的未分化细胞的形态学现象[17],这些未分化的细胞是具有迁移及侵袭能力的非增值性、非凋亡及高侵袭性的肿瘤细胞[19]。因此了解肿瘤出芽内的细胞与CSCs及EMT的标志物之间的关系对理解肿瘤的侵袭具有重要意义。
SOX2作为CSCs的标志物之一,并在维持CSCs的干细胞状态过程中起重要作用[9,10]。ESCC中的研究显示SOX2高表达与ESCC预后差有关,提示SOX2在ESCC发生及发展过程中均起重要作用[13]。Slug是EMT的标志物之一,ESCC的研究显示Slug在肿瘤的转移过程中起关键作用[16]。多种肿瘤包括ESCC中的研究显示肿瘤出芽的发生率是独立的预后因素[18,20-23]。然而目前ESCC的研究中尚无SOX2、Slug及肿瘤出芽三者之间的关系的报道。本次实验结果显示48例Slug高表达的ESCC组织中,有83.33%(40/48)例SOX2高表达,62.50%(30/48)例肿瘤出芽率升高,而41例Slug表达降低的ESCC组织中,有48.78%(20/41)SOX2低表达,56.09%(23/41)肿瘤出芽降低,运用相关性分析表面SOX2和Slug表达呈正相关关系,Slug表达与肿瘤出芽存在正相关关系,并且SOX2高表达,Slug高表达及肿瘤出芽升高与浸润深度,淋巴结转移及高临床分期明显相关,提示ESCC中SOX2高表达可能促进Slug高表达从而提高肿瘤出芽的发生率。
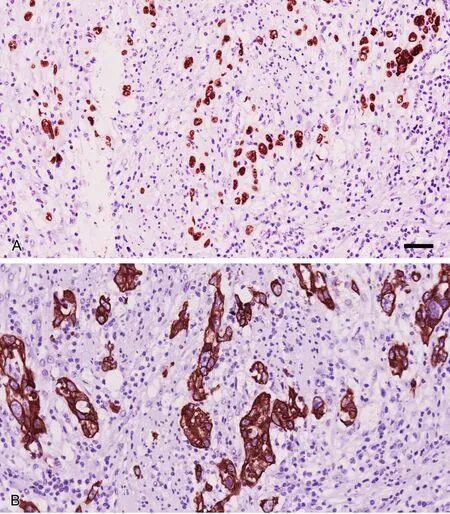
图2 SOX2(A)和Slug(B)在肿瘤出芽的组织内高表达(Elivision法)。比例尺,55μmFig. 2 High expression of SOX2 (A) and Slug (B) in tumor budding tissues (Elivision method). Scale bar, 55μm

表1 SOX2和Slug在ESCC组织和癌旁组织中阳性表达率比较Tab. 1 Comparison for positive expression rates of SOX2 and Slug in ESCC and adjacent tissues
本次研究仅初步探索了CSCs标志物SOX2及EMT标志物Slug与肿瘤出芽的关系,然而有关SOX2基因通过哪个信号通路促进Slug的表达及肿瘤出芽的发生尚需要进一步的研究。

表2 SOX2、Slug和肿瘤出芽与ESCC临床病理因素的关系Tab. 2 The association of SOX2, Slug, Tumor budding with clinicopathological features in ESCC

表3 ESCC组织中SOX2和Slug的表达与肿瘤出芽的关系Tab. 3 The correlation of SOX2, Slug expression with tumor budding in ESCC
本组实验提示ESCC中存在SOX2高表达现象,SOX2高表达可能诱导Slug表达升高,从而促进肿瘤出芽的发生,干扰SOX2/Slug途径可能对ESCC的治疗具有重要意义。

