表没食子儿茶素没食子酸酯抑制肥胖大鼠肝中TLR4炎症通路及胰岛素抵抗
侯慧敏,杨万里,暴素青,曹艳丽
(中国医科大学附属第一医院内分泌科,中国医科大学内分泌研究所,辽宁省内分泌疾病重点实验室,沈阳 110001)
肥胖是一种慢性疾病,逐年上升的发病率已成为世界性的健康问题。根据一项全国性的调查,肥胖的患病率在2000年为8.6%,在2014年已经上升为12.9%[1]。肥胖还是其它一系列疾病的重要危险因素,包括2型糖尿病、脂肪肝、心血管疾病等。肝脏是参与人体能量代谢过程的重要器官,是脂肪代谢、运输的枢纽。当个体处于超重或者肥胖状态时,全身脂肪代谢紊乱,过多的脂肪堆积于肝脏内形成脂肪性肝病,进而影响肝脏的多种代谢功能。
研究表明绿茶能够逆转肝细胞由于脂肪变性引起的损伤,在Mousumi Bose[2]的高脂饮食动物模型实验中,高脂饮食同时补充绿茶的主要成分表没食子儿茶素没食子酸酯(Epigallocatechin gallate, EGCG)与单纯高脂饮食相比,小鼠肝脏重量轻,血糖、胰岛素抵抗及胰岛素抵抗系数均低于单纯高脂组,提示长期的EGCG治疗能够减轻肥胖的发展、代谢综合征相关的症状以及脂肪肝,而短期的EGCG补充也会一定程度逆转由于高脂饮食带来的代谢方面的损伤,但其具体机制尚不清楚。
Toll样受体4(toll-like receptor 4, TLR4)属于模式识别受体[3],TLR4信号通路及其相关因子如TNF受体相关因子6(TNF receptor associated factor 6, TRAF6)的激活可以通过促炎性激酶与氧化应激的活化直接抑制胰岛素活性,还可通过细胞因子信号级联激活促炎性物质及胰岛素脱敏物质的释放,间接地抑制胰岛素的活性。TLR4还参与到许多肝脏疾病的进程中,比如原发性硬化性胆管炎、自身免疫性肝炎、肝细胞癌等。
EGCG能否通过调节肝组织中TLR4信号通路,改善胰岛素敏感性,目前尚未见报道。因此,本研究拟采用高脂饮食喂养的肥胖大鼠动物模型,给予EGCG干预,探讨肝组织中TLR4信号通路及胰岛素信号通路的变化情况。
材料与方法
1 主要试剂
甘油三酯(TG酶法)测试盒购于南京建成生物工程研究所,Trizol(Invitrogen,USA),油红O(Sigma,美国),PI-3K一抗、IRS-1一抗、IRS-2一抗、IKKβ及p-IKKβ一抗、p-NF-κB一抗均购于美国CST公司,Akt一抗、TLR4一抗购于美国abcam公司;TNF-α一抗(Santa,美国),β-actin一抗和辣根过氧化物酶标记二抗均购于北京中杉生物技术有限公司。
2 实验动物
雄性SD大鼠,共30只,SPF级,由中国医科大学实验动物部提供SPF级饲养条件,条件如下:室温22℃左右,相对湿度50%左右,12h明暗交替,自由摄食饮水,笼具、垫料、饮用水等定期更换清洁,适应性喂养1周。
3 动物模型建立
30只4周龄SPF级雄性SD大鼠,适应性喂养1周后,随机分为两组:普通饮食组(normal diet group as the control,NC组,n=10)、高脂饮食组(highfat diet group,HFD组,n=20)。普通饮食组给予普通饲料(蛋白质28.58%、脂肪9.59%、碳水化合物61.83%),高脂饮食组给予高脂饲料(含蛋白质15%,脂肪60%,碳水化合物25%)喂养。喂养期间大鼠摄食、摄水自由,每周称大鼠体重。
在喂养第16周时,普通饮食组和高脂饮食组大鼠体重出现差异后,将高脂饮食组随机分为两个亚组:①HFD组(高脂饮食喂养不变)和②EGCG组(在高脂饮食中加入3.2g EGCG/kg),即在后续实验中,动物分组分为3组:①NC组(n=10),②HFD组(n=10)和③EGCG组(n=10),继续喂养16周。喂养期间测量3组大鼠体重每周进行。
4 标本采集
喂养阶段结束后,进行标本采集,大鼠禁食16h,称量体重后进行麻醉,采用腹腔注射3%戊巴比妥钠的方法,麻醉后,留取心尖血,于4℃离心机中离心(3000r/min),离心后保存在-80℃冰箱中备用。留取肝脏,放入液氮中速冻,保存在-80℃冰箱中以备后续使用。
5 代谢相关指标检测
在每周的固定时间段,称量大鼠体重。采用碘(I125)胰岛素放免试剂盒检测空腹血胰岛素(fasting insulin, FINS);采鼠尾静脉血,罗氏血糖仪检测空腹血糖(fasting blood glucose, FBG);采用全自动生化分析仪测量大鼠血清游离脂肪酸(free fatty acid,FFA)水平。稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistanc, HOMA-IR)的计算公式为HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5,葡萄糖输注率(glucose infusion rate, GIR60-120)采用葡萄糖-高血浆胰岛素钳夹法,于大鼠麻醉状态下进行。
6 油红-O染色检测大鼠肝脏组织中脂肪浸润程度
制肝冰冻切片(厚10μm)于4%甲醛PBS中固定10min,取出后干燥20min,置于60%异丙醇中2min,油红-O染液染色10min。滤纸吸干染色液后,置于60%异丙醇中3min,之后放入自来水中终止分化,苏木素复染30s后,自来水返蓝,1% HCl酒精分化1s,与水中静置10min后取出干燥,甘油明胶封片。
7 大鼠肝脏组织中甘油三酯含量检测
采用甘油三酯(TG)测定试剂盒,检测大鼠肝脏中甘油三酯含量,按重量(g) :体积(ml)=1 :9加入匀浆介质,在冰水浴条件下进行机械匀浆(2500r/min,10min),取上清液进行酶标仪比色。甘油三酯含量(mmol/gprot)=(样本OD值-空白OD值)/(校准OD值-空白OD值)×校准品浓度(2.26mmol/L)÷待测样品蛋白浓度(gprot/L)。
8 Real-Time PCR检测大鼠肝脏组织中TLR4信号通路相关分子的mRNA 水平
取大鼠肝组织进行充分匀浆,按照Trizol试剂(Invitrogen公司)说明书提取肝组织总RNA,应用RNA反转录试剂盒将RNA反转录为cDNA,反应体系为20μl,反应条件37℃,15 min(反转录),85℃,5s(热灭活),4℃,∞。以GAPDH为参照基因对误差进行校正,各引物序列见表1,引物由宝生物工程(大连)有限公司合成。采用 SYBR 染料法进行实时定量PCR反应,反应体系为20μl,反应条件为95℃,30s(预变性),PCR循环为50个循环,95℃,5s,60℃,30s。PCR反应结束后所得的数据,采用LightCycler480 Software 1.5分析。

表1 Real-Time PCR引物序列Tab. 1 Primer sequence for Real-Time PCR
9 Western blot检测大鼠肝脏组织中TLR4信号通路相关因子与胰岛素信号通路相关因子蛋白的表达
于冰上配置一定量的蛋白裂解液,包括Lysis buffer、磷酸酶抑制剂、蛋白酶抑制剂和苯甲基磺酰氟(PMSF),加入称量后的组织标本进行匀浆(8min*2次 ),冰浴 30min,离心 15min(4℃,12000r/min)。取上清液进行蛋白浓度测量,定量,并行聚丙烯酰胺凝胶电泳(SDS-PAGE),PVDF膜转膜,室温封闭2h,TBST洗膜3次,每次5min。加入一抗,摇床上过夜封闭。洗膜,加入HRP标记的二抗,室温条件下孵育2h。再次洗膜,放置PVDF膜于ECL化学发光仪中,应用成像系统拍照保存图像,并用Image J软件分析,样本中目的蛋白的含量以目的蛋白光密度值/β-actin条带光密度值反映。
10 统计学分析
采用SPSS 19.0统计学软件处理分析数据,采用的是均数±标准差形式表示数据。均数之间的比较采用独立样本t检验和One-ways ANOVA 分析LSD法。以P<0.05表示差异具有统计学意义。
结 果
1 EGCG改善大鼠一般代谢指标
高脂喂养32周,HFD组大鼠体重、游离脂肪酸、空腹胰岛素较NC组均明显升高。EGCG干预16周后,FFA、FINS较HFD组均明显下降;EGCG组大鼠体重较HFD组有下降趋势,但没有统计学差异;3组大鼠空腹血糖水平比较后无统计学差异(表 2)。
2 EGCG改善高脂饮食大鼠的胰岛素抵抗
GIR60-120表示的是正常葡萄糖-高血浆胰岛素钳夹实验中60~120min的平均葡萄糖输注率,用以评价胰岛素敏感性(表3)。结果显示,HFD组GIR60-120与NC组相比明显下降,EGCG组GIR60-120与HFD组相比明显升高。
HOMA-IR通过FBG和FINS计算得出,HFD组HOMA-IR与NC组相比明显升高,EGCG组HOMA-IR较HFD组明显下降,而NC组与EGCG组之间相比差异无统计学意义。上述结果提示:EGCG干预可以改善高脂饮食大鼠胰岛素敏感性。

表2 EGCG对大鼠一般代谢指标的影响Tab. 2 Effect of EGCG intervention on body weight and other metabolic indexes

表3 EGCG干预后大鼠胰岛素抵抗评价指标结果Tab. 3 Results of insulin resistance evaluation index after EGCG intervention
3 EGCG减轻高脂饮食大鼠肝组织中的脂质集聚
对肝中甘油三酯含量(TG)测定显示,HFD组TG含量明显高于NC组,EGCG组TG含量明显低于HFD组,EGCG组与NC组之间差异没有统计学意义(图1A),提示EGCG干预后能够降低大鼠肝脏中TG含量。油红O染色表明,与NC组(图1B)相比,HFD组(图C)脂质红染更显著,EGCG干预后(图D),脂质聚集较HFD组有所改善。
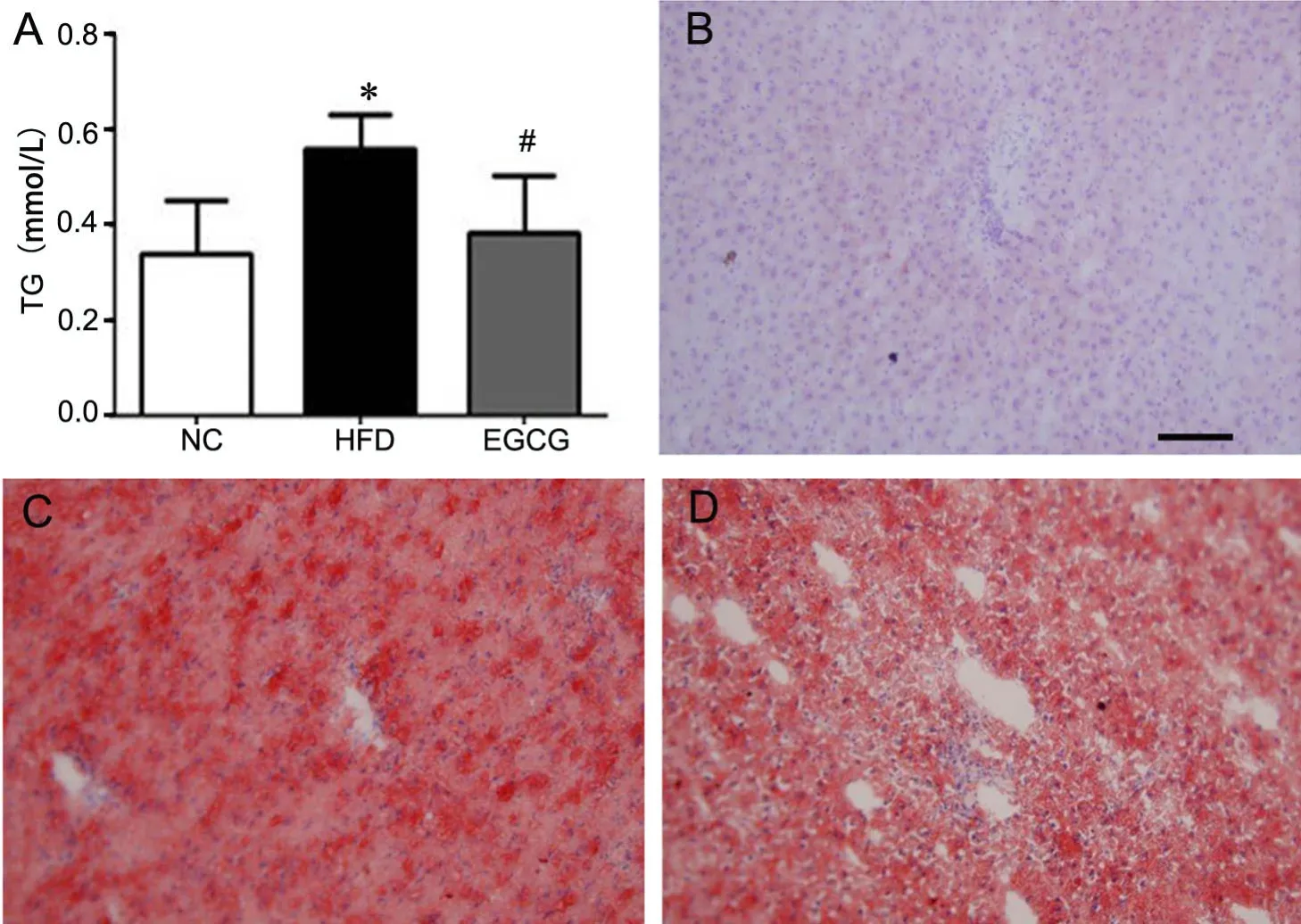
图1 EGCG减轻高脂饮食大鼠肝中的脂质聚集。A,TG水平;B-D,油红O染色观察脂质浸润;*0.01<P<0.05,HFD组与NC组比较,#0.01<P<0.05,EGCG 组与 HFD 组比较 ; n=10;比例尺:50μmFig.1 The effect of EGCG on hepatic lipid accumulation in the liver tissue of HFD rats. A, TG concentrations; B-D, detection of hepatic lipids by Oil Red O staining.*0.01<P<0.05, HFD vs NC; #0.01<P<0.05, HFD vs EGCG; n=10; scale bar: 50μm
4 EGCG抑制高脂饮食大鼠肝组织中TLR4信号通路相关因子的表达
EGCG干预16周后,Real-Time PCR测定肝脏组织中TLR4信号通路炎症相关因子的mRNA水平显示(图2),HFD组中TLR4和TRAF-6 mRNA较NC组表达含量上升,EGCG组TLR4和TRAF-6 mRNA较HFD组表达量明显下降。

图2 EGCG对高脂饮食大鼠肝组织中TLR4和TRAF-6 mRNA水平的影响。*0.01<P<0.05,HFD组与NC组相比;#0.01<P<0.05,EGCG组与HFD组之间比较;n=10Fig. 2 Effects of EGCG on mRNA levels of TLR4 signaling pathway-related molecules in HFD rats. *0.01<P<0.05, HFD vs NC; #0.01<P<0.05, HFD vs EGCG; n=10
提取肝脏组织中总蛋白,应用Western blot 方法检测 TLR4、IKKβ、p- IKKβ、p-NF-κB、TNF-α 等的蛋白水平显示(图3),HFD组TLR4、IKKβ、p-IKKβ、p-NF-κB及TNF-α蛋白表达水平较NC组明显升高,EGCG组TLR4、IKKβ、p-IKKβ、p-NF-κB及TNF-α蛋白表达水平较HFD组明显下降,与NC组TLR4、IKKβ、p-IKKβ、p-NF-κB及TNF-α与EGCG组之间比较差异无统计学意义。

图3 EGCG对高脂饮食大鼠肝脏组织中TLR4信号通路相关因子蛋白水平的影响。*0.01<P<0.05,HFD组与NC组比较;#0.01<P<0.05,EGCG组与HFD组比较;n=10Fig. 3 Effects of EGCG on the protein levels of TLR4 signaling pathway-related molecules in HFD rats. *0.01<P<0.05, HFD vs NC; #0.01<P<0.05,HFD vs EGCG; n=10
5 EGCG抑制高脂饮食大鼠肝脏组织中胰岛素信号通路相关因子蛋白的表达
提取肝脏组织中总蛋白,采取Western blot 方法检测IRS-1、IRS-2、PI-3K、Akt等的蛋白表达水平。HFD组IRS-1、PI-3K、Akt蛋白表达水平较NC组明显下降,IRS-2蛋白表达水平较NC组略有下降,但是差异没有统计学意义;EGCG组IRS-1、IRS-2、PI-3K、Akt蛋白表达水平较HFD组明显升高;NC组IRS-1、IRS-2、PI-3K、Akt与EGCG组之间比较,差异不具有统计学意义(图4)。

图4 EGCG对高脂饮食大鼠肝组织中胰岛素信号通路相关因子蛋白表达水平的影响。*0.01<P<0.05,HFD组与NC组之间比较;#0.01<P<0.05,EGCG组与HFD组之间比较;n=10Fig. 4 Effect of EGCG on protein levels of insulin signaling pathway-related molecules in the liver tissue of HFD rats. *0.01<P<0.05, HFD vs NC;#0.01<P<0.05, HFD vs EGCG; n=10
讨 论
本实验研究结果提示,经过EGCG干预后,FFA和FINS表达量下降,与既往研究结果一致[4,5]。然而与既往研究结果[6,7]不同的是:3组之间FBG水平没有差异,EGCG干预后大鼠的重量与高脂组相比也没有差异。我们推测出现这样的结果的原因可能与大鼠的种类、周龄,EGCG的干预剂量、干预方式、干预时间有关。研究表明,EGCG干预能够提高葡萄糖稳态,包括增加葡萄糖耐量,减轻胰岛素抵抗,降低胰岛素抵抗系数(HOMA-IR)[8,9]。与既往研究结果类似,本研究结果提示经过EGCG干预后,HOMA-IR下降,葡萄糖输注率(GIR)提高,而GIR所代表的是机体处理外源性葡萄糖的能力。
肝脏是参与人体中脂质代谢调节过程的重要器官。从肝脏TG含量和油红-O染色的结果可以看出,HFD组大鼠肝脏中脂质含量明显升高。肝脏中超负荷的TG和FFA引起血脂代谢紊乱,从而引起肝细胞膜结构和功能出现异常,异常的肝细胞表面胰岛素受体减少且具有受体缺陷,导致胰岛素抵抗[10]。
除了肝脏脂质聚集可以引起胰岛素抵抗,炎症因子的刺激也可以损伤胰岛素受体信号,最终导致胰岛素抵抗发生[11]。本实验研究结果表明,HFD组胰岛素信号通路相关指标IRS-1、IRS-2、PI-3K、Akt蛋白表达量下降。推测其可能的机制是:FFA含量增加激活TLR4/NF-κB信号通路,导致炎性因子(如TNF-α)产生和表达增加,这些炎性因子可作用于胰岛素受体底物1/2(IRS1/2),抑制PI-3K和Akt活性,最终导致胰岛素信号转导障碍和IR的发生。EGCG干预后IRS-1、PI-3K、Akt蛋白表达量上升,说明EGCG可以改善HFD对胰岛素信号的干扰。这一结果在之前脂肪组织实验中也得到了验证[12]。
综上所述,本研究探讨了EGCG对肥胖的改善作用机制,研究结果表明:EGCG可改善高脂饮食喂养大鼠肝组织中脂质聚集,影响肝组织中TLR4炎症信号通路及胰岛素信号通路的关键分子表达。本研究为绿茶缓解非酒精性脂肪性肝病的机制提供了研究依据,为改善肥胖相关代谢紊乱提供理论基础。

