高脂饮食引起小鼠心律失常及心肌纤维化
胥军,毕薇
(同济大学附属第十人民医院心内科心功能室,上海 200072)
心律失常(arrhythmia)是心脏窦房结激动异常、激动传导缓慢甚至阻滞而导致的心脏搏动频率或节律异常。心律失常是心血管疾病中重要的一组疾病,它可单独发病,亦可与其他心血管疾病伴发[1]。心律失常可增加栓塞性卒中、心力衰竭的风险[2]。现有的研究发现,不良饮食方式导致的相关疾病如高血压、肥胖、糖尿病和血脂异常等与心律失常的发病有关[3],而地中海饮食能降低心律失常发生率[4]。
心肌纤维化(myocardial fibrosis)指心肌组织中胶原纤维过量沉积,其主要特征是成纤维细胞数目增多和心肌细胞外间质胶原过度沉积[5,6]。心肌纤维化与高血压、心力衰竭、心肌病、心律失常及心脏猝死等多种心血管疾病密切相关[6-8]。
然而高脂饮食(high fatty diet, HFD)与心律失常、心肌纤维化的确切关系仍不明晰。为了明确HFD与心律失常的关系,我们采用HFD喂饲小鼠8周制作的高脂饮食动物模型,观察到HFD能够引起小鼠心律失常,并且能增加其心脏组织纤维化程度。
材料与方法
1 实验动物饲料及高脂饮食动物模型
20只8w左右雄性C57BL/6J小鼠购买自上海斯莱克实验动物有限责任公司【SCXK(沪)2017-0005】。小鼠均饲养在同济大学实验动物中心SPF级动物房【使用许可SYXK(沪)2014-0026】内,室温25±2℃,昼夜循环12/12h。所有动物实验遵从动物福利3R原则执行。本实验通过我校伦理委员会审查。本实验中小鼠分为标准饮食组(STD)和高脂饮食组(HFD),每组10只。其中,标准饮食饲料(STD)含有12%的脂肪,而高脂饮食饲料(HFD)含有50%的脂肪。小鼠在喂养10周后进行在体心电图检测。异氟烷麻醉后,腹腔注射氯胺酮/甲苯嗪混合物进行安乐死,采集心脏组织后立即磷酸盐缓冲液冲洗,-80℃储存用于后续的染色及RNA提取。
2 组织学分析
小鼠安乐死后快速分离其心脏组织并固定于4%福尔马林缓冲液中24h,然后用70%-100%的酒精对心脏组织进行脱水处理,随后进行石蜡包埋处理并制作石蜡切片(4μm)。石蜡切片放置在玻璃载玻片上,在60℃的烘箱中干燥过夜。心脏组织切片用苏木精-伊红(HE)染色 观察其心肌纤维,Masson染色观察其胶原纤维,利用Image-Pro Plus 6.0计算心肌纤维面积百分比(心肌纤维横截面积/心肌横截面积×100%)和胶原沉积比例(胶原沉积横截面积/心肌横截面积×100%)。
3 RNA提取和逆转录PCR
用TRIzol®试剂(TaKaRa Bio)从细胞中提取总RNA,随后使用PrimeScript™逆转录试剂盒(TaKaRa Bio)合成进行逆转录实验合成cDNA。在2×Power SYBR Green PCR体系中分别加入引物和cDNA,随后在实时荧光定量PCR仪(Bio-Rad)中进行实验,终体积为25μl。以GAPDH作为内参,用 2ΔΔCT方法计算相对表达水平。所有实验重复至少三次。引物序列为:TNF-α 正向引物5’-CATCTTCTCAAAACTCGAGTGACAA-3’,反向引物 5’-TGGGAGTAGATAAGGTACAGCCC-3’;IL-6 正向引物5’-ACAAGTGGGAGGCTTAATTACACAT-3’,反向引 物 5’-TTGCCATTGCACAACTCTTTTC-3’;IL-β正 向 引 物 5’-CCTCGTGCTGTCGGACCCATA-3’,反向引物 5’-CAGGCTTGTGCTCTGCTTGTGA-3’;GAPDH 正 向 引 物5’-GGCACAGTCAAGGCTGAGAATG-3’,反向引物:5’-ATGGTGGTGAAGACGCCAGTA-3’。
4 在体心电图检测
1.0%~1.5%异氟烷麻醉小鼠,并将电极附在四肢上。使用Bioamp(Ad-in-Instruments)三导联心电图记录,并转换为数字信号,随后使用Labchart(Ad-in-Instruments)进行分析。心电波形图中,三个以上的连续心跳将被用于分析。
5 统计分析
使用Graphpad Prism 7.0软件对数据进行分析。方差分析后进行非配对t检验。数据表示为均数±标准差。P<0.05认为有统计学差异。
结 果
1 HFD引起小鼠室性心动过速
小鼠正常饮食或高脂饮食喂养10w后记录其在体心电图(ECG),以评估其心律失常情况。结果显示,HFD喂养10w后的小鼠,在在体心电图实验中表现出明显的室性心动过速,而STD组表现正常(图1A)。随后我们对小鼠的心律失常发生的频率及严重性进行评分表明,HFD组小鼠心律失常评分明显升高(图1B)。由此可见,HFD能导致小鼠室性心动过速。
2 HFD引起小鼠QT间隔延长
QT间期指心电图Q波起点至T波终点的间距,代表心室肌除极和复极的过程[9]。QT间期延长表示心脏复极延迟,反映心电异常,通常与心律失常密切相关[10]。在体心电图实验显示,HFD喂养后的小鼠相比于STD组,其QT间隔明显延长(图2A)(图1B)。
3 HFD诱导小鼠心房传导阻滞和动作电位复极化延长
心房内传导阻滞(intra-atrial block)简称房内阻滞,正常窦房结发出激动是沿结间束传至房室结,同时沿房间(Bachmann)束从右心房传到左心房。结间束和(或)房间束发生传导障碍被称为心房内传导阻滞。冲动在心房内传导时间延长时称为不完全性传导阻滞,完全中断则为完全性传导阻滞[11]。一些研究认为,心房传导阻滞在快速房性心律失常的发生过程中起重要作用[12]。对信访传导速度和动作电位检测显示,HFD组小鼠心房传导速度相比于STD组明显降低(图3A),说明HFD诱导心房传导阻滞;相比于STD组小鼠,HFD组小鼠右心房动作电位持续时间显著延长(图3B),说明其复极化延长。由此进一步证明HFD可导致小鼠心律失常。

图1 高脂饮食后ECG变化。A,由HFD诱发的心律失常易损性试验中的代表性心电图记录显示HFD组小鼠室性心动过速,STD组小鼠室性心电图正常;B,心律失常评分;**P<0.01,与标准饮食组相比;n=10Fig. 1 ECG traces after HFD. A, representative ECG traces during arrhythmia vulnerability test induced by HFD showing ventricular tachycardia in HFD group mice and representative ECG traces in STD group mice showing a normal ECG; B, score quantification of arrhythmia incidence and severity; **P< 0.01 vs STD; n=10

图2 HFD对小鼠心电图QT间期的影响。A,在体心电图显示HFD组QT间期延长;B,校正后QT间期统计学分析;**P<0.01,与标准饮食组相比;n=10Fig. 2 Effect of HFD on QT interval of ECG in the mice. A, representative ECG traces highlighting QT interval prolongation; B, statistical analysis for the adjusted QT interval duration; **P< 0.01 vs STD; n=10

图3 HFD对小鼠心房传导速度和动作电位复极化的影响。A,小鼠心房传导速度统计;B,右心房动作电位持续时间统计;**P<0.01,与标准饮食组相比;n=10Fig. 3 Effect of HFD on atrial conduction velocity and action potential repolarization. A, quantification of the atrial conduction velocity in STD and HFD mice; B, quantification of the action potential duration at the right atrium in STD and HFD mice; **P< 0.01 vs STD; n=10
4 HFD导致小鼠心肌纤维化和炎症损伤
心脏病反复发作的根本原因是心脏组织反应性纤维化。当心脏出现炎症时,纤维化即可发生[13]。随后,我们通过HE染色和Masson染色观察小鼠心脏间质纤维化与胶原沉积程度。HE染色显示,HFD组小鼠心脏组织可见心肌细胞水肿呈细颗粒状,心肌细胞空泡变,并且心肌横纹消失、心肌灶状坏死、炎细胞浸润及间质纤维化(图4A),其纤维化面积也明显上升(图4C)。Masson染色显示,HFD组小鼠心脏组织可见心肌细胞排列明显紊乱、心肌间质纤维化程度较重(图4B),并且胶原沉积率也明显上升(图4D)。
RT-PCR检测显示,HFD模型小鼠心脏组织中白细胞介素-6(interleukin-6,IL-6)(图4E)、细胞介素 -1β(interleukin-1β,IL-1β)(图 4F)和瘤坏死因子 -α(tumor necrosis factor,TNF-α)(图 4G)等炎症因子表达水平明显升高,说明HFD造成了心脏的炎症损伤。
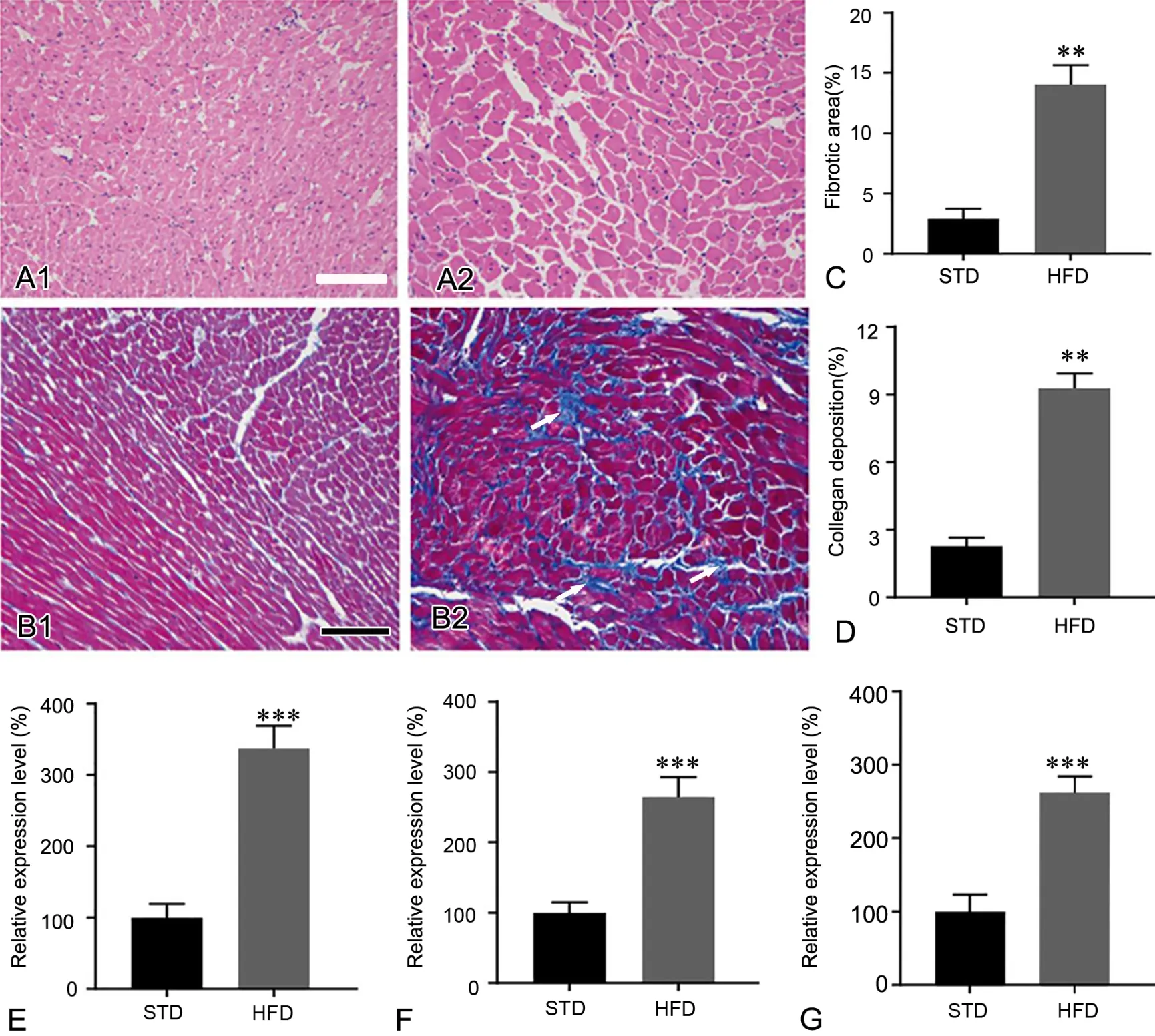
图4 HFD对心肌纤维化和炎症的影响。A,心脏组织HE染色;B,胶原纤维Masson染色;箭头,胶原纤维沉积;比例尺,100μm;C,心肌间质纤维化统计分析;D,心肌胶原沉积率统计分析;E-G,IL-6 (E)、IL-1β (F)和TNF-α (G) mRNA表达水平统计学分析;与标准饮食组比较:**0.001<P<0.01,***P< 0.001;n=10Fig. 4 Effects of HFD on the myocardiac fibrosis and inflammation. A, representative HE staining of cardial fiber ; B, Masson staining of collagen ;arrows, collagen deposition; scale bar, 100μm; C, statistical analysis for myocardiac fibrosis rate; D, statistical analysis for collagen deposition rate; E to G, statistical analysis for mRNA expression levels of IL-6 (E), IL-1β (F) and TNF-α; Compared with STD: **0.001<P< 0.01, ***P< 0.001; n=10
讨 论
心律失常是指心脏冲动的起源部位、心搏频率和节律以及冲动传导异常[14]。心律失常可由各种器质性心血管病、药物中毒、电解质和酸碱平衡失调等因素引起[15]。现在的研究显示,不良的饮食习惯与心律失常发生密切相关[16]。我们的实验证明了HFD可引起小鼠心律失常。
常见的心律失常,包括室性早搏(室早)、室性心动过速(室速)、心室颤动(室颤)等。在本研究中,我们发现HFD可引起小鼠室性心动过速。在心电图实验中,QT间期主要代表心室肌除极和复极的过程,其通常与心律失常密切相关[17]。而在我们的实验中,HFD喂养后的小鼠相比于STD组其QT间期明显延长。在心房传导方面,我们发现HFD组小鼠心房传导速度相比于STD组明显降低,说明HFD可导致心房传导阻滞。并且HFD组小鼠右心房动作电位持续时间显著延长。现在的一些研究认为,心房传导阻滞在快速房性心律失常的发生过程中起重要作用。以上这些结果证明了HFD可导致小鼠心律失常。
心脏疾病反复发作的根本原因是心肌组织纤维化[18]。当心脏发生炎症、创伤等刺激后,纤维化即可发生,逆转心肌纤维化能治疗心肌缺血、心律失常、心衰等[19]。我们的研究表明,HFD可导致心肌纤维化。HE染色结果显示,HFD组小鼠心肌纤维化水平显著升高。Masson染色结果显示,相比于STD组HFD组小鼠心肌组织胶原沉积率也显著升高。现在的研究表明,心肌纤维化可引起心律失常,然而HFD导致的心肌纤维化在心律失常中的作用及机制还需要进一步研究。TNF-α等炎症因子在心脏的病理变化中起着重要作用,这其中就包括心肌纤维化[20,21]。我们的数据也表明,HFD不仅可引起小鼠心脏组织纤维化,逆转录实验结果提示,HFD可显著增强IL-6、IL-1β和TNF-α的表达水平,这些结果进一步说明了HFD在心脏纤维化中的作用。然而炎症因子在HFD引起的心肌纤维化中的具体机制仍需进一步研究。

