膜荚黄芪查尔酮合成酶基因的克隆与表达分析
郑涵予, 袁 元, 金河延, 于 洋, 全雪丽, 吴松权
(延边大学农学院,吉林 延吉 133002)
黄芪是豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根的统称[1]。膜荚黄芪为多年生草本,高达50~100 cm,茎直立,上部多分枝,茎上有细棱,幼茎淡绿色,被白色长柔毛[2]。黄芪具有补气、利尿、保肝、祛痰等功效,有效成分主要包括皂苷类、黄酮类、多糖类和一些微量元素[3-4]。黄芪黄酮类化合物具有抗氧化、降血糖、抗病毒、保护神经和骨骼、抑制黑色素形成、改善疲劳等药理作用[5]及药用价值[6-7]。属我国传统中药材,分布于我国温带和暖温带地区,尤其以东北和华北地区分布广泛[8]。黄芪中黄酮类化合物主要是异黄酮,包括芒柄花素、芒柄花苷、毛蕊异黄酮和毛蕊异黄酮葡萄糖苷等[5,9];其中,毛蕊异黄酮葡萄糖苷是评价黄芪药材质量的“标记化合物”之一[1]。
查尔酮合成酶(Chalconesynthase,CHS)是黄酮类生物合成途径中的关键酶和限速酶,催化3分子丙二酸单酰CoA和1分子香豆酰CoA形成查尔酮[10]。此外,CHS还是与植物抗性相关的基因,CHS基因的表达受到草食动物、病菌等生物胁迫和紫外线、损伤和外源激素等非生物胁迫的诱导。而且,利用茉莉酸甲酯处理模拟环境胁迫时,不仅上调了毛喉鞘蕊花(Coleus forskohlii)中CHS基因表达,还增加了总黄酮的含量和抗氧化活性[11]。因此,CHS基因是与植物抗逆境和次生代谢产物紧密相关的基因,在植物的抗性胁迫中发挥着重要的作用,它的正确表达不仅有利于提高黄酮类含量,而且还可以改善植物的抗逆能力。本研究的目的是克隆膜荚黄芪CHS基因并分析其转录表达特性,为分子水平上了解异黄酮积累规律和发掘优良种质提供理论支持。
1 材料与方法
1.1 材料与仪器
1.1.1 植物材料
取新鲜的膜荚黄芪根、茎、叶,一部分用液氮速冻后保存于-80 ℃超低温冰箱中;另一部分于55 ℃烘干箱中烘干后,用于异黄酮类的提取。
1.1.2 药品和试剂
Trizol(Invitrogen);反转录试剂盒(Toyobo);超微量分光光度计(NanoDrop 2000 C);DNA凝胶回收试剂盒(Omega);PMD-19T载体(Takara);大肠杆菌Jm109;5′和3′RACE 试剂盒(Clontech);荧光定量试剂盒 SYBR Premix Ex TaqⅡ(Takara);芒柄花素、芒柄花苷、毛蕊异黄酮和毛蕊异黄酮葡萄糖苷等异黄酮对照品,购自上海融禾医药科技有限公司;色谱级乙腈和甲醇;超纯水;其它试剂均为分析纯。
1.1.3主要仪器
超低温冰箱(W-86L388A);干燥箱(BAO-250A);高速冷冻离心机(Hitachi);PCR仪(T100);凝胶成像系统(BioDoc-It220);实时荧光定量PCR仪(Mx3005P);RE-2000B型旋转蒸发仪;C18色谱柱(Acchrom);高效液相色谱仪(LC-10ATVP Plus)。
1.2 方法
1.2.1 总RNA提取与cDNA合成
采用Trizol一步法提取总RNA(Invitrogen),超微量分光光度计检测其质量和浓度,将总RNA稀释成0.5 μg/L,利用反转录PCR(RT-PCR)合成cDNA第1条链。
1.2.2CHS基因克隆
根据GenBank中发表的CHS基因序列的编码区设计1对简并引物AmCHS-DF和AmCHS-DR(表1)。
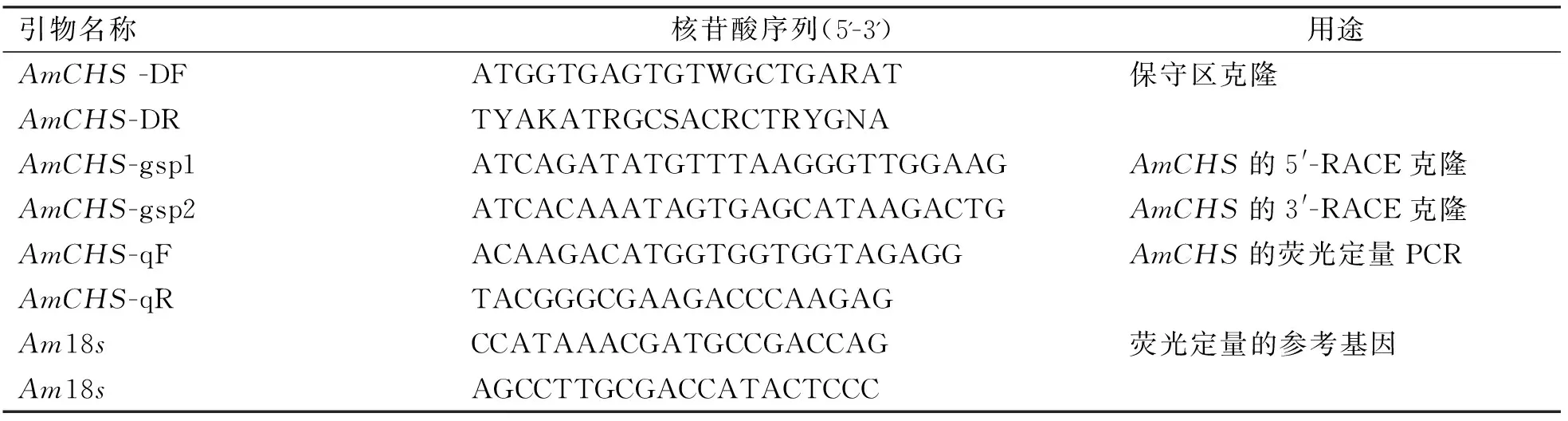
表1 引物序列
以合成的cDNA为模板,进行PCR反应,退火温度为52 ℃。根据所测得的AMCHS基因的保守区设计5′-RACE引物AmCHS-gsp1和3′-RACE引物AmCHS-gsp2(表1),按照Clontech公司RACE cDNA说明书进行RACE反应, 从膜荚黄芪的cDNA扩增得到RACE序列。PCR产物经琼脂糖电泳回收后,克隆到pMD19-T载体,筛选阳性克隆,测序由上海英俊生物有限公司完成并获得cDNA全序。
1.2.3 生物信息学分析
利用Lasergene软件包中EditSeq分析基因的开放阅读框(ORF);使用在线工具ProtParam(https://web.expasy.org/protparam/)分析蛋白质的理化性质;使用在线工具TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白跨膜结构域;使用在线工具Psipred(http://bioinf.cs.ucl.ac.uk/psipred)预测蛋白质二级结构,使用在线工具TargetP1.1(http://www.cbs.dtu.dk/services/TargetP/)和Wolf PSORT (https://wolfpsort.hgc.jp/)预测亚细胞定位情况;使用在线工具SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;使用NCBI在线工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)和Prosite(https://prosite.expasy.org/)分析保守结构域和活性位点;使用在线工具BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)检索同源性氨基酸序列;利用Lasergene软件包MegAlign构建CHS氨基酸序列的系统发育进化树。
1.2.4 实时荧光定量PCR
针对AmCHS基因序列设计1对特异引物,Am18S基因作为内参(表1),在荧光定量PCR仪(Mx3005P)进行实时定量PCR(qRT-PCR)反应。具体反应按照SYBR Premix Ex TaqⅡ说明书进行qRT-PCR,求出相对于内参基因Am18S的相对表达量。
1.2.5 异黄酮含量的测定
采用HPLC法[12]。异黄酮的含量等于芒柄花素、芒柄花苷、毛蕊异黄酮和毛蕊异黄酮葡萄糖苷的含量之和。
1.3 数据分析
应用SPSS19.0软件中的方差分析,多重比较采用Duncan新复极差法(P<0.05)。
2 结果与分析
2.1 AmCHS基因cDNA克隆
以膜荚黄芪cDNA第1条链为模板,用简并引物PCR扩增,获得了1条大约1 150 bp的保守区片断(图1泳道1)。依据保守区设计的特异引物进行5′-RACE 和3′-RACE结果,分别获得了1条大约300 bp的5′端(图1泳道2)和450 bp的3′端(图1泳道3)。经300 bp的5′端的和450 bp的3′端的引物扩增后的PCR产物,测序和拼接获得了长度为1 473 bp的AmCHS基因的全长cDNA序列,GenBank登陆号为KY086285。
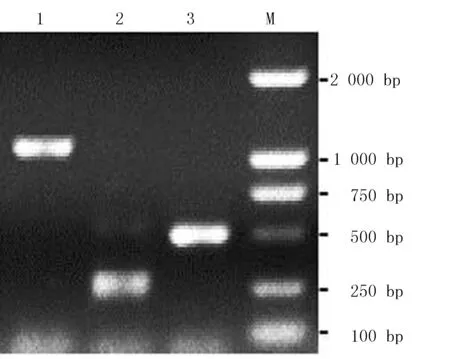
注:M.DL 2 000 标准;1.简并引物PCR;2. 5′-RACE;3. 3′-RACE
图1 膜荚黄芪CHS基因PCR结果
Fig.1 The PCR results ofCHSgene
2.2 AmCHS生物信息学分析
AmCHS的cDNA序列和氨基酸序列如图2所示。AmCHS的cDNA序列全长为1 473 bp,开放阅读框(ORF)长度为1 170 bp,5′-端非翻译区为151 bp,3′-端非翻译区为127 bp,还有25 bp的polyA尾,A+T含量为59.0%,G+C含量为41.0%(图2)。
AmCHS蛋白编码389个氨基酸,分子式为C1914H3053N509O564S19,分子量为42 828.51 Da,等电点为6.05;强碱性氨基酸43个,强酸性氨基酸47个,极性氨基酸87个,疏水性氨基酸143个;不稳定指数为37.16,属于稳定蛋白;亲水性指数为-0.075,属于可溶性蛋白;定位在细胞质。二级结构预测结果,AmCHS蛋白以α-螺旋(37.94%)和无规则卷曲(44.99%)为主,β-片层(16.20%)含量则较少。此外,AmCHS不存在跨膜结构域和信号肽,定位于细胞质。这些理化特性与其它植物CHS蛋白类似[5-6]。
NCBI在线工具CDD功能结构域分析表明,AmCHS属于查尔酮合成酶家族。Prosite活性位点分析结果,AmCHS蛋白的近中心位置附近有1个聚酮合成酶的催化活性位点(C164),此位点的功能是结合香豆酰CoA,并且这一位点区域(RYMMYQQGCFAGGTVLR)也非常保守(图2),是CHS和白藜芦醇合酶等聚酮合成酶的特征序列[13]。同时,AmCHS蛋白还包括CHS蛋白特有的保守残基F-215、H-303、N-336[14]。

图2 膜荚黄芪CHS基因的全长 cDNA序列及其氨基酸序列
同源性检索分析表明,AmCHS蛋白与其它植物CHS蛋白同源,相似性大于77.6%。为了进一步了解AmCHS和其它植物CHS进化关系,从Genbank中下载了不同植物的12个CHS蛋白序列,构建了系统进化树(图3)。
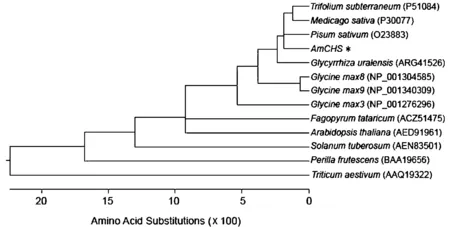
图3 膜荚黄芪CHS与其它植物CHS氨基酸序列的系统进化树
由图3可知,AmCHS与豆科植物地三叶(Trifolium subterraneum)、紫花苜蓿(Medicago sativa)、豌豆(Pisum sativum)、大豆(Glycine max)的CHS归为一类,而廖科植物苦荞(Fagopyrum tataricum)、十字花科植物拟南芥(Arabidopsis thaliana)、茄科植物马铃薯(Solanum tuberosum)、唇形科植物紫苏(Perilla frutescens)和禾本科植物小麦(Triticum aestivum)的CHS各归为一类,反应了CHS在进化上的保守性和不同科之间的多态性。
2.3 AmCHS组织特异性表达与总黄酮含量的变化
AmCHS荧光定量分析结果显示(图4),AmCHS基因在根、茎、叶中均表达,但表达水平显著不同,在叶中表达量最高,在茎中表达量次之,根中表达量最低。不同组织中总黄酮含量大小顺序(图5)与AmCHS基因的组织特异性表达结果一致,即叶>茎>根。
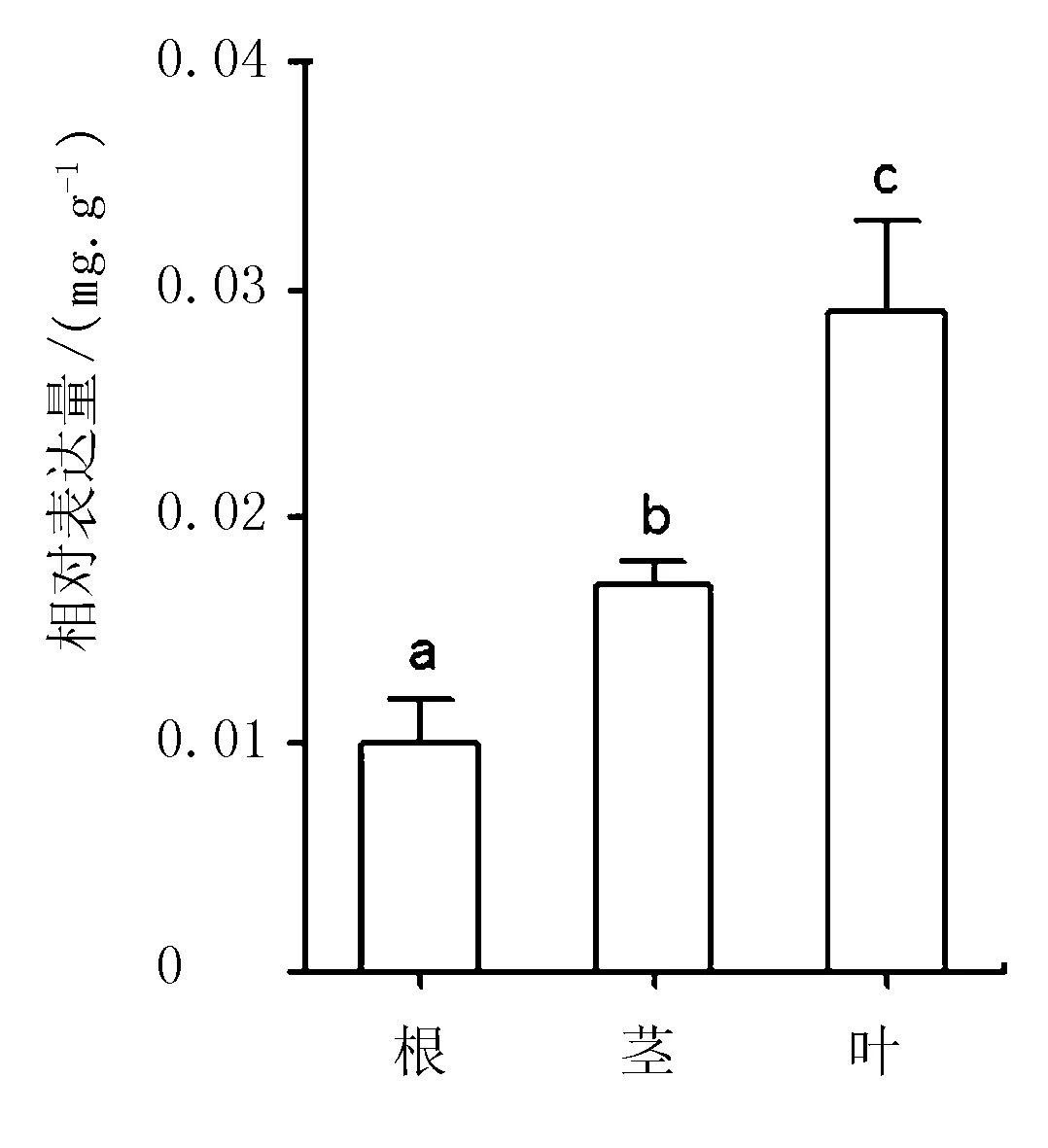
图4 膜荚黄芪AmCHs基因组织特异性表达
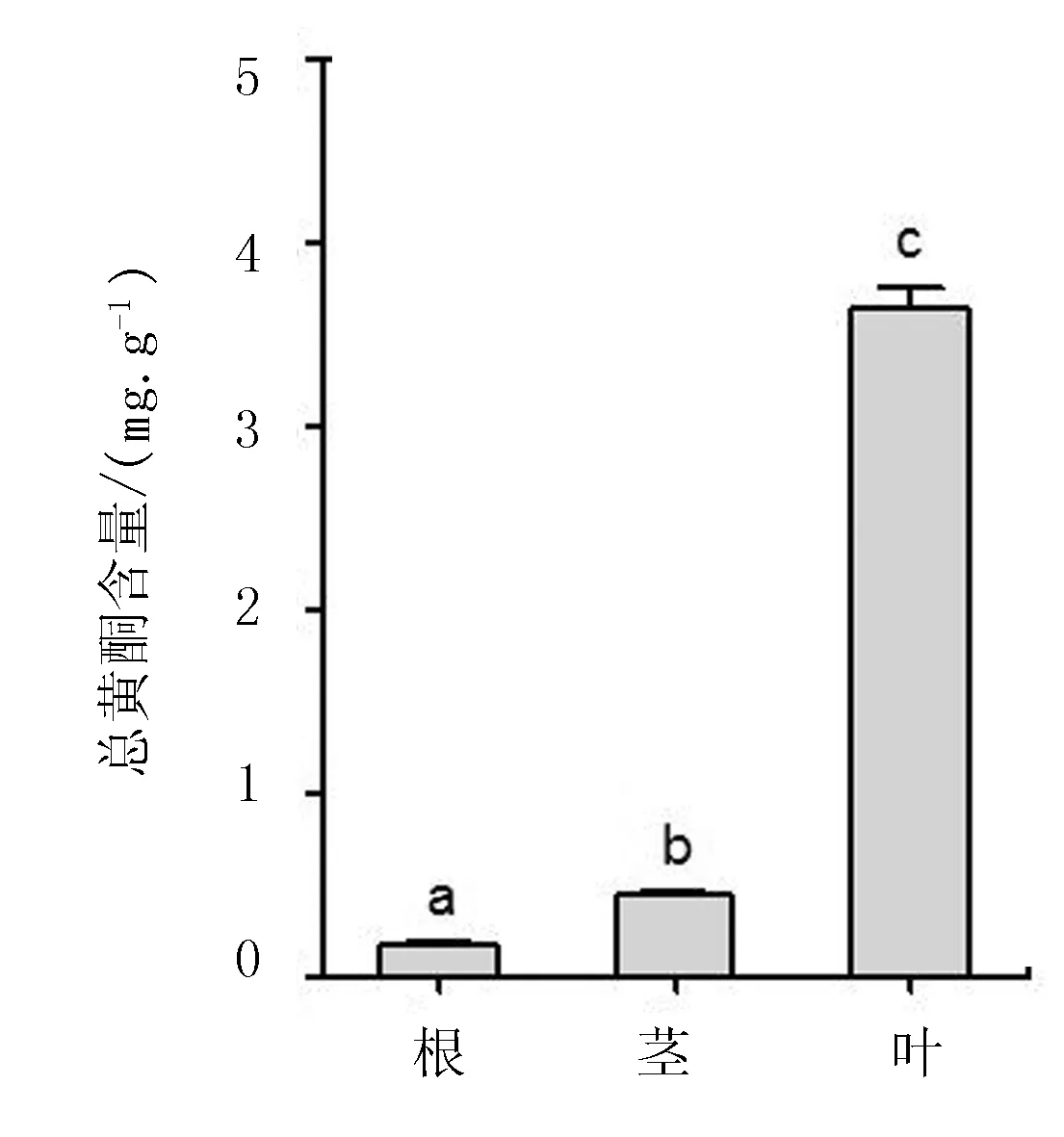
图5 膜荚黄芪不同组织中总黄酮含量
3 讨论与结论
商品黄芪主要来源于人工栽培,但是栽培的黄芪中异黄酮含量不稳定[15]。CHS基因是生物合成黄酮类化合物的关键基因[10-11]。但是,尚未发现基于同源克隆和RACE技术克隆膜荚黄芪CHS基因的报道。本研究在应用同源克隆方法时,针对起始密码子(ATG)和终止密码子(TAA)分别设置了上游和下游简并引物(表1),经RT-PCR和测序获得了含ORF在内的保守序列(图2),说明了这种方法的可行性,从而省略了后续克隆ORF的步骤,简化了整个实验过程。生物信息学分析结果显示,所克隆的AmCHS基因的编码区大小、理化性质等与其它植物CHS相似,具备查尔酮合成酶家族中4个氨基酸决定的活性位点(C164、F-215、H-303、N-336),而且与其它植物CHS基因同源,表明AmCHS基因是CHS基因家族的新成员。
CHS基因常以基因家族的形式存在[11]。在大豆中CHS基因家族聚为2大类,CHS7和CHS8基因聚为一类,其它CHS基因聚为另一类,其中,只有CHS7和CHS8基因的表达与异黄酮的生物合成相关[16]。在黄芪中,异黄酮类化合物作为植物防御系统的组分,具有很多药理作用,广泛分布于植物的根、茎和叶中[17]。本研究中,AmCHS基因在膜荚黄芪根、茎和叶中的表达水平与异黄酮在根、茎和叶中的积累变化一致(图4,5),而且相对于大豆CHS3基因,AmCHS与大豆CHS7和CHS8基因的亲缘关系较近(图3),推测AmCHS基因在膜荚黄芪异黄酮生物合成中发挥着重要的作用。有研究表明,CHS基因的表达与植物的抗性胁迫相关[11], 而且品种之间CHS基因的表达差异很可能是造成黄酮类含量差异的一个重要原因[16]。因此,考察CHS基因在黄芪不同种质之间的表达特性,还有利于筛选优良的黄芪种质。
总之,本研究从膜荚黄芪中克隆了AmCHS基因,证明AmCHS基因的表达与总黄酮的积累相关,从而为黄芪异黄酮类化合物生物合成机制的研究奠定了基础。

