白色紫锥菊不定根抑制LPS诱导的小鼠巨噬细胞促炎介质的产生
高 原, 修景润, 田 文, 朴炫春*, 廉美兰
(1.延边大学农学院,吉林 延吉 133002;2.延边州农业科学院,吉林 龙井 133400)
白色紫锥菊 [Echinaceapallid(Nutt.) Nutt.] 是菊科(Asteraceae)松果菊属(Echinacea)多年生草本植物[1],原产地北美地区,具有极高的药用价值和观赏价值[2]。白色紫锥菊含有丰富的活性物质,主要为菊苣酸、氯原酸以及紫锥菊苷等咖啡酸类衍生物[3],它具有抗癌、增强免疫力、抗炎、抗菌等多种药用功效[4],在欧美地区是常见的药用制剂材料之一[5]。近些年,紫锥菊(E.purpurea)和狭叶紫锥菊(E.angustifolia)等松果菊属植物已经被成功引种到我国的多个省份,但是白色紫锥菊因其种子休眠性强、萌发率低和育苗难度大等问题,人工栽培技术尚处于探究阶段,其产量难以满足产品生产的需求[6]。目前,已在许多植物种中通过培养植物细胞、组织、器官等方式获取了有用代谢产物,这种技术被认为是一种解决植物材料不足的有效途径[7]。对于白色紫锥菊,已有研究报道在生物反应器中大量培养不定根,并发现以这种方式生产的活性物质产量高于其母体植物[8]。然而,目前为止不定根未能应用于商品生产,其主要原因是不定根安全性、生物活性等尚未得到评价。
炎症是很多疾病的病理演变过程,最开始多是急性炎症,后来逐渐演变为慢性炎症。脂多糖(LPS)能够刺激巨噬细胞诱导形成多种炎症通路,从而产生促炎介质[9]。目前, MAPKs信号通路已经成为抗炎方面研究的热点,一般情况下,MAPKs信号通路被激活之后, p38、JNK、ERK都会产生一定程度的磷酸化,并且会进一步促进PGE2、NO、COX-2、iNOS和TNF-α等促炎介质的释放[10]。植物提取物有效成分来源于植物体,具有稳定和安全等优点,研究发现许多植物提取物都可以有效抑制炎症反应[11-13]。在相关研究中,对于松果菊属紫锥菊的抗炎方面研究相对较多[14]。但是,白色紫锥菊抗炎效果的研究甚少,对所培养的不定根抗炎研究更是无人问津。因此,为不定根今后作为一种新植物材料应用于白色紫锥菊相关产品的生产,此试验探究了白色紫锥菊的生物反应器不定根提取物,抑制在LPS-诱导后对小鼠巨噬细胞的促炎介质产生的影响;同时,对MAPK通路蛋白磷酸化程度进行了测定,旨在探明不定根提取物是否通过调控MAPK通路起到抗炎效果。
1 材料与方法
1.1 材料
白色紫锥菊不定根材料由大连市农业科学研究院提供。将培养至30 d的不定根切成约1 cm长,接种到含不定根增殖培养基的生物反应器中(图1)。反应器大小5 L,工作体积4 L,培养基为3/4 MS+IBA 1 mg/L+蔗糖50 g/L,pH值5.8。通气量为100 mL/min的气体,暗培养温度为(25 ± 1 ) ℃。培养35 d后,收获不定根,用清水清洗后,置于55 ℃烘干箱中,当不定根烘干至恒重(48 h)后作为试验材料。
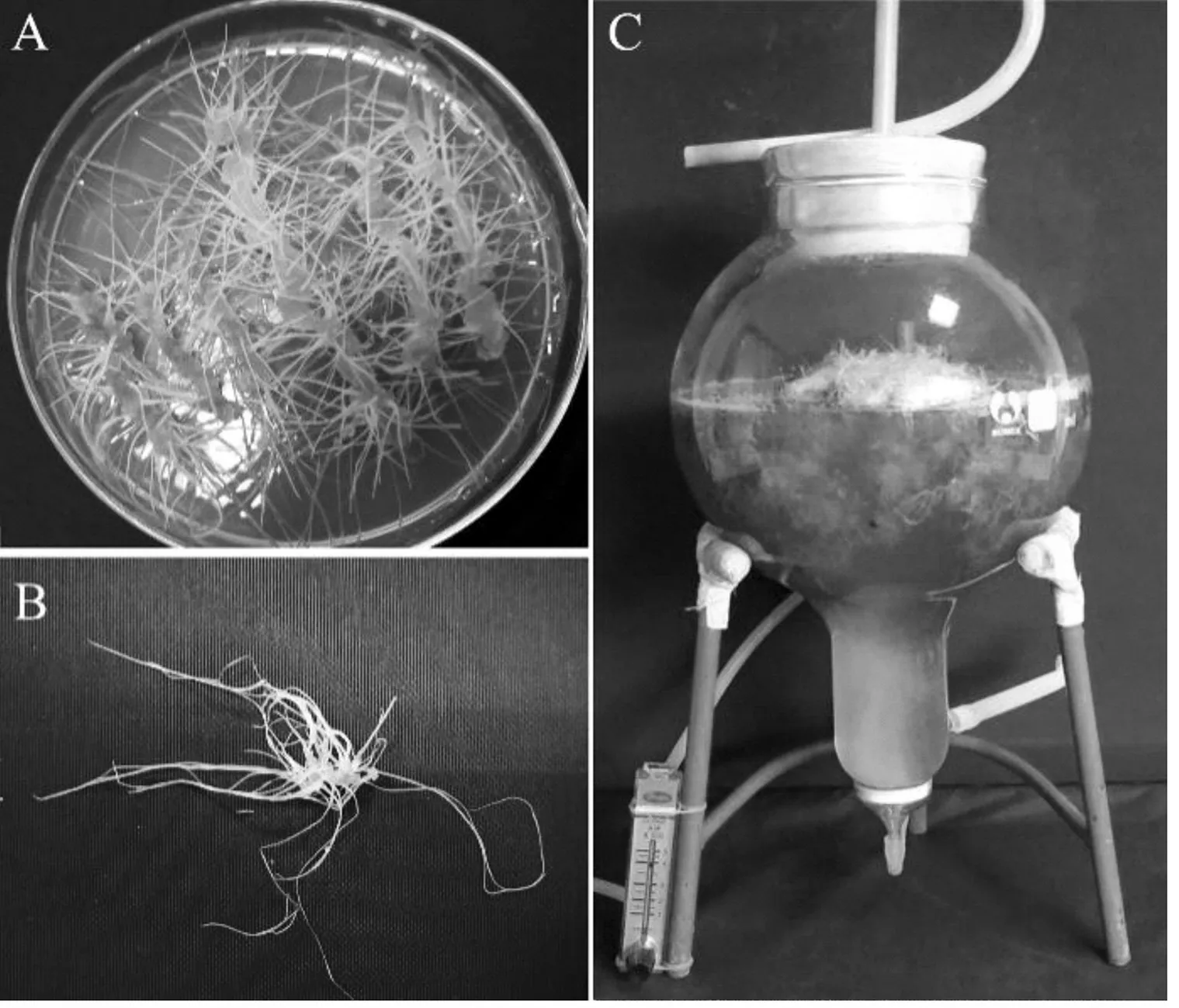
注:A.在培养皿中培养到35 d时的不定根;B.在培养皿中培养到35 d时的不定根形态;C.不定根生物反应器培养
图1 白色紫锥菊不定根
Fig.1 Adventitious roots culture ofE.pallida
1.2 试剂
DMEM(Thermo Scientific, USA)培养液和胎牛血清(FBS, Thermo Scientific, USA)和青霉素、链霉素和3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,Thiazolyl Blue Tetrazolium Bromide(MTT)(Sigma 公司,美国),COX-2 、TNF-α 、IL-6、IL-1β 等抗体(Cell Signaling Technology公司,美国),LPS和ATP(Invivogen公司,美国)。
1.3 仪器与设备
UV-2600型号酶联免疫检测仪(日本岛津公司,日本),Bio-Rad型号蛋白质电泳及转印设备(伯乐生命医学公司,中国),LAS-3000型号凝胶成像仪(FUJIFILM公司,日本)。
1.4 方法
1.4.1 巨噬细胞的获取
试验用小鼠腹腔巨噬细胞来自6~8周龄体重约为18 g的C57BL/6鼠(长春市亿斯实验动物技术有限责任公司,中国长春)。小鼠腹腔内注射4%巯基醋酸盐培养液,在温度25 ℃,相对湿度50%的环境中饲养4 d后牺牲小鼠。用10 mL预冷磷酸缓冲液(PBS)冲洗小鼠腹腔,吸出腹腔灌洗液。将腹腔灌洗液在离心机1 500 r/min离心4 min,弃上清后,即得巨噬细胞。将得到的巨噬细胞在DMEM培养液[包含1%(v/v)抗生素(青霉素和链霉素, 100 U/mL)和10%(v/v)胎牛血清]中,在相对湿度95%,CO2含量5%,温度37 ℃的条件下孵育12 h,然后用于试验。
1.4.2 提取物制备
将400 mL 的80%甲醇加入到称好的30 g不定根干品中,在37 ℃条件下超声1 h,收集滤液,重复3次,将收集的滤液在45 ℃减压浓缩干燥,得到不定根提取物,用DMSO溶解后用于实验。
1.4.3 白色紫锥菊不定根提取物对巨噬细胞活性的影响
采用MTT法测定白色紫锥菊不定根提取物细胞的毒性。在96孔板的每孔中接种细胞密度为8×104个的巨噬细胞,孵育12 h后弃掉原培养液并加入不同浓度的提取物(25、50、100、200、400g/mL),对照加入DMEM培养液,培养24 h后弃掉培养液,并在每孔中加0.1 mL含500g/mLMTT的DMEM培养基,处理2 h。弃上清液后,分别向每孔加入0.1 mL DMSO,震荡(300 r/min)培养5 min,在550 nm处测定吸光值。
1.4.4 试验组设计
试验共设计6个组。1) Cont:正常巨噬细胞;2) LPS:仅用LPS(0.1g/mL)处理;3) E100:仅用100 μg/L提取物处理;4) LPS+E25(低剂量):用25 μg/L提取物处理后再用LPS(0.1g/mL)处理;5) LPS+E50(中剂量):用50 μg/L提取物处理后再用LPS(0.1g/mL)处理;6) LPS+E100(高剂量):用100 μg/L提取物处理后再用LPS(0.1g/mL)处理。
1.4.5 NO和PGE2的测定
在48孔板中接种0.3 mL细胞密度为2.5×105的培养液,孵育12 h后,倒掉培养基,用温PBS冲洗两次,加入提取物处理1 h后,向每孔加入0.1 μg/mL LPS进行处理,24 h后收集细胞上清液,用于NO和PGE2的测定。用Griess试剂法测定NO,与细胞上清液的混合比例为1∶1,在酶标仪550 nm处测定吸光值。按ELISA试剂盒法测定PGE2,并在450 nm处测定吸光值。
1.4.6 iNOS和COX-2的测定
向6孔板中每孔加入2 mL细胞浓度为2.6×106细胞培养液,经过12 h孵育后,弃原培养液,用温的PBS冲洗3次,并加入提取物处理1 h,再加入0.1 μg/mL LPS处理24 h后,弃掉上清液。用预冷的PBS冲洗3次,向6孔板中分别加入裂解液100 μL,用细胞铲获得细胞后,冰浴30 min。在12 000 r/min离心机中离心15 min,获得的上清液用BCA法测定蛋白含量,进行免疫印迹分析。按照4∶1体积比将上清液和上样缓冲液混合,并在沸水中煮5 min后冷却至室温。在恒定电压为120 V的条件下进行70 min的SDS-PAGE电泳。结束后,设置恒压为70 V,冰浴3 h,进行转膜。转膜后,用PBS-T洗5 min,重复3次。在室温条件下,用10%脱脂奶封闭1 h。将一抗iNOS、COX-2稀释1 000倍后,在PVDF膜上孵育过夜,温度4 ℃。将二抗稀释5 000倍后,室温条件下孵育1 h。显影采用ECL化学发光法,并使用Image J软件分析蛋白的表达量。
1.4.7 TNF-α、IL-6和IL-1β的测定
用ELISA法测定TNF-α、IL-6和IL-1β。为了测定TNF-α和IL-6,细胞处理的方法与测定NO和PGE2一样。测定时均按照TNF-α和IL-6的ELISA试剂盒中的说明书操作,并在450 nm处测定吸光值。同样为了测定IL-1β,细胞处理与测定TNF-α和IL-6一样,加入白色紫锥菊提取物处理1 h,再加入5 mM ATP处理1 h,获得细胞的上清液。测定时均按照IL-1β试剂盒中的说明书操作,并在450 nm处测定吸光值。
1.4.8 p38、JNK和ERK测定
用免疫印迹法测定p38、JNK和ERK磷酸化水平。细胞处理方法与测定iNOS或COX-2方法相同。用0.1 μg/mL LPS处理,30 min后的操作与测定iNOS或COX-2相同。转膜后,用TBS-T(Tris-buffered saline, 0.1%Tween 20)洗膜5 min,重复3次。室温下,用10%脱脂奶封闭1 h。在4 ℃条件下,PVDF膜在稀释1 000倍的一抗(p-p38、p-JNK、p-ERK、p38、JNK、ERK和β-actin)中孵育过夜。室温条件下,将二抗稀释5 000倍后孵育1 h。采用ECL化学发光法,并利用Image J软件分析蛋白的表达量。
1.4.9 数据分析
所有的试验处理都进行3次重复,应用GraphPad Prism 5软件程序,并采用 t 测验法对数据进行比较分析。
2 结果与分析
2.1 不定根提取物对小鼠巨噬细胞活性的影响
当不定根提取物浓度低于400 μg/mL时对细胞活性表现出无抑制作用(图2),说明400 μg/mL浓度的不定根提取物没有毒性。因此,选用25、50和100 μg/mL的不定根提取物用于抗炎研究。
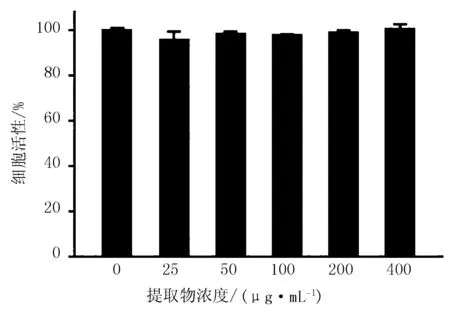
图2 白色紫锥菊不定根提取物对于细胞活性产生的影响
2.2 白色紫锥菊不定根提取物对NO、PGE2释放量产生的影响
由图3可知,加入LPS刺激后,巨噬细胞中的NO和PGE2水平均明显提高,但当提取物浓度为50 μg/mL时,显著抑制NO的产生。当浓度达到100 μg/mL,抑制率达到62%(图3A)。同时,显著抑制PGE2(图3B)。
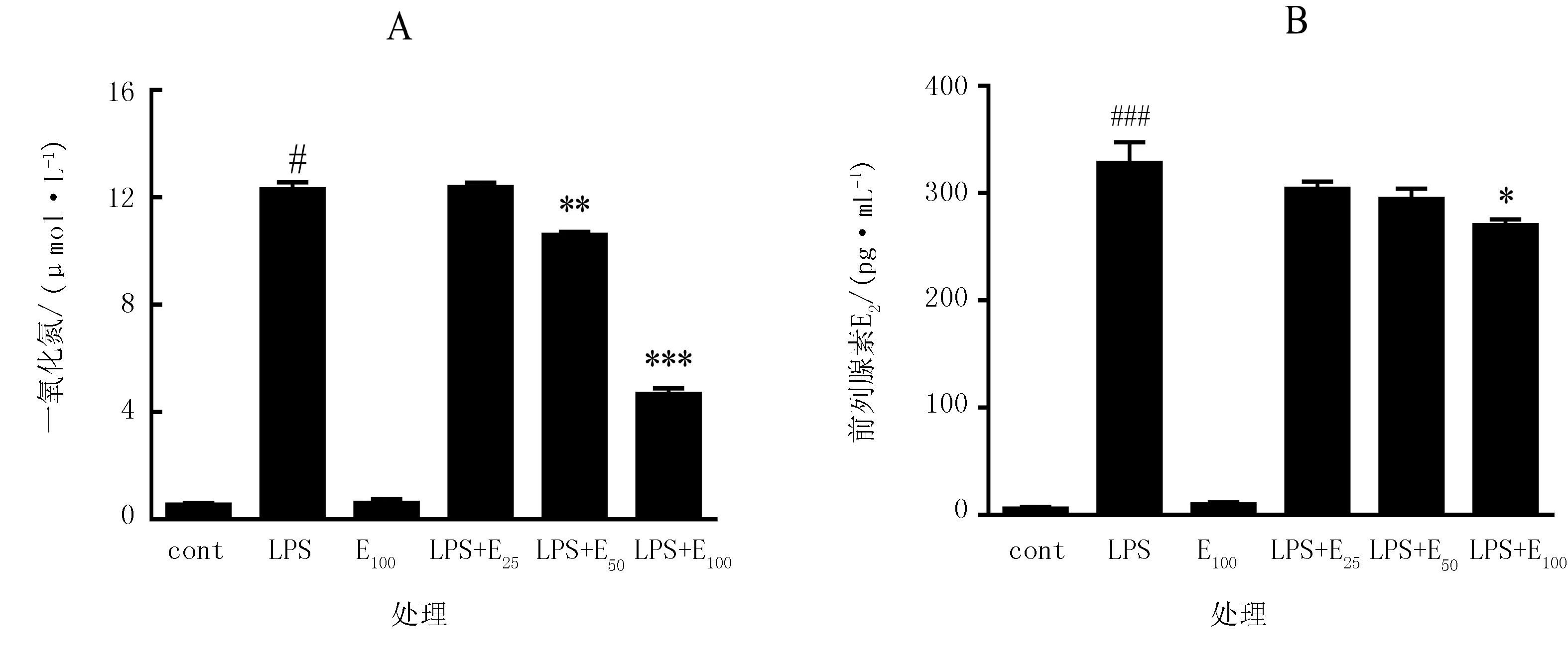
注:与Cont组相比,###表示P<0.001;与LPS组相比,*、**和***分别表示P<0.05,P<0.01和P<0.001。
图3 不定根提取物对NO和PGE2产生的影响
Fig.3 Effect of adventitious roots extract on NO and PGE2production
2.3 白色紫锥菊不定根提取物对iNOS、COX-2表达量的影响
由图4可知,白色紫锥菊不定根提取物对于iNOS、COX-2的释放表现出抑制效果,iNOS、COX-2的表达量在经过LPS的刺激后会显著地增加,而经过提取物处理后的试验组中却出现了下降趋势,并呈现出一定的剂量依赖性,在100 μg/mL的提取物浓度处,对iNOS和COX-2表达的抑制率分别达到了33%和30%(图5)。
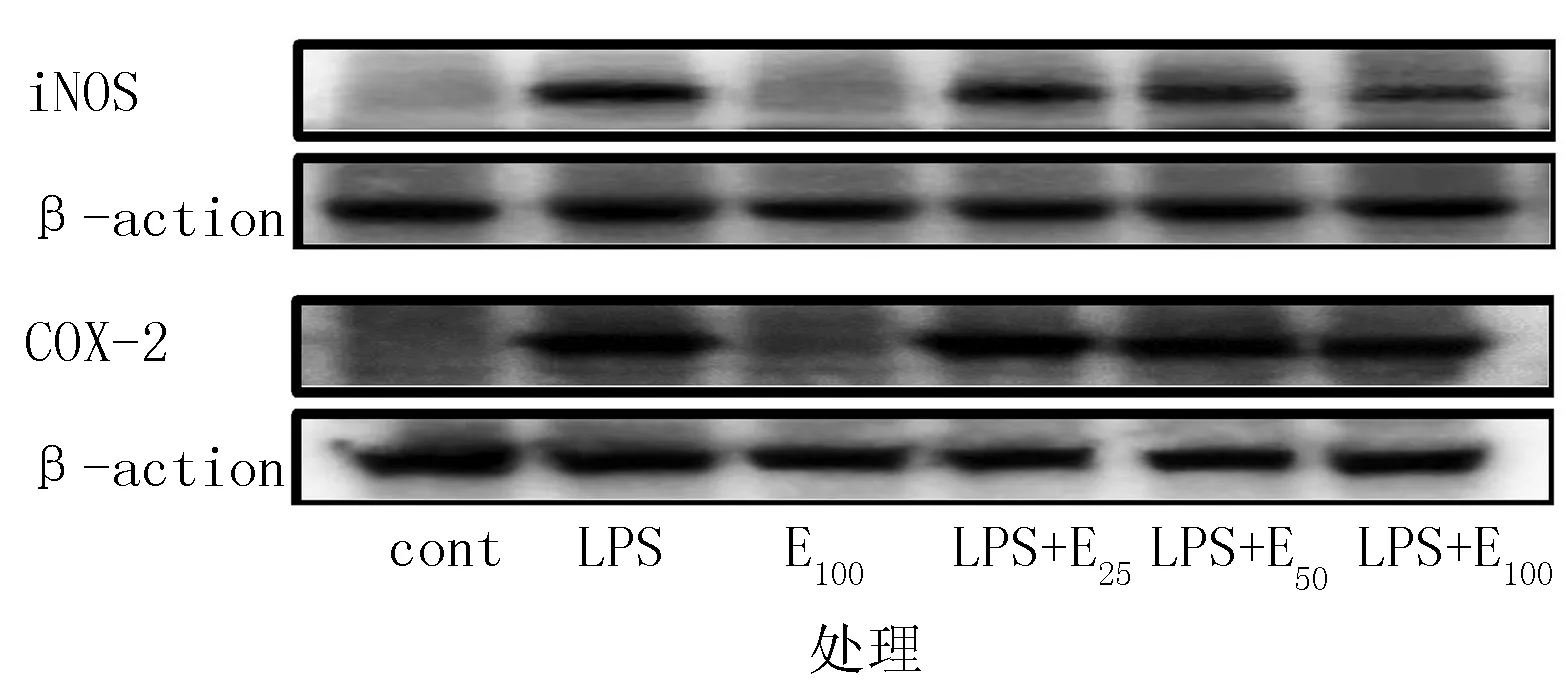
图4 不定根提取物对iNOS和COX-2蛋白表达量的影响
2.4 白色紫锥菊不定根提取物对IL-1β、IL-6和TNF-α释放量产生的影响
IL-1β、IL-6、TNF-α 3种炎症因子在炎症反应中起着关键性作用。经LPS刺激后的小鼠巨噬细胞中TNF-α和IL-6的释放量表现为显著增加。在100 μg/mL提取物浓度处,对TNF-α和IL-1β的抑制率分别达到51%和58%。而提取物对IL-6的释放量无明显抑制作用(图6)。

注:与Cont组相比,###表示P<0.001;与LPS组相比,*、**和***分别表示P<0.05,P<0.01和P<0.001。
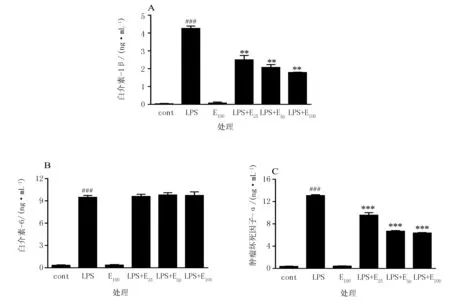
注:与Cont组相比,###表示P<0.001;与LPS组相比,**和***分别表示P<0.01和P<0.001。
2.5 白色紫锥菊不定根提取物对MAPKs信号通路中的信号蛋白磷酸化的影响
MAPKs作为细胞中的一类苏氨酸/丝氨酸蛋白激酶,主要包括p38、ERK、JNK等几种蛋白。由图7可知,小鼠巨噬细胞经LPS刺激后,促进了p38、ERK和JNK的磷酸化,但在加入白色紫锥菊不定根提取物处理后,巨噬细胞中p-p38、p-ERK、p-JNK的表达量呈明显下降的趋势,且表现出一定程度的浓度依赖性,在处理浓度为100 μg/mL时,p-p38、p-ERK和p-JNK抑制率分别达到78%、37%和60%(图8)。

图7 不定根提取物对p-p38、p-ERK和p-JNK蛋白表达量的影响

注:与Cont组相比,###表示P<0.001;与LPS组相比,***表示P<0.001。
3 讨论
生物反应器培养不定根具有培养时间短、安全性高、不受时间、气候和地点的局限、次生代谢物产量多等优点,显著加速了中药现代化进程。目前,已有许多植物成功地应用了生物反应器培养,李惠娟等探究了氧化锗对于生物反应器中人参的不定根生长产生的影响,发现氧化锗浓度为30和60 μmol是不定根生长的最适宜浓度[15]。左北梅等研究发现,120°圆锥型气升式的生物反应器培养的人参不定根,在第40天时干重总量和干重增殖倍数会达到峰值,总皂苷及多糖含量也达到最高[16]。松果菊属不定根培养研究也有许多报道,已成功地在生物反应器中培养了狭叶紫锥菊[17]和紫锥菊[18]不定根。本研究团队对白色紫锥菊也进行了生物反应器培养研究,并建立了培养体系[19]。目前,不定根培养研究在活跃的开展,但对其生物活性研究较少,其中研究较多的是抗氧化研究,但至今关于白色紫锥菊不定根抗炎作用相关的研究报道较少[20]。随着天然提取物在食品添加剂、医疗保健、化妆品等方面的更多应用,再加上市场需求的不断加大[21]。为了使培养白色紫锥菊不定根应用于产品生产,本研究对白色紫锥菊不定根的抗炎作用进行了初步探究,希望能够对白色紫锥菊生产应用提供科学依据。
NO是经过其合酶iNOS催化L-精氨酸后产生,是炎症反应检测的重要指标之一,对于炎症反应的产生起着非常重要的作用。NO的过量产生,通常会对细胞造成损伤,进一步导致组织坏死,加速炎症的发展。Zhai等对于白色紫锥栽培根的相关研究发现,栽培根的提取物浓度为100 μg/mL时,对NO的抑制率达到40%[22]。在本试验中,100 μg/mL的白色紫锥菊不定根提取物对NO的抑制率能够高达62%。说明白色紫锥菊不定根的抗炎效果要好于栽培根,且25 μg/mL提取物浓度下,对于iNOS的表达有显著的抑制效果。PGE2是一种强促炎因子,COX-2是PGE2生产的关键酶。相关研究证明,紫松果菊根的提取物显著地抑制了PGE2的释放[23],而且,还有研究发现,狭叶紫锥菊根的己烷提取物显著地抑制了COX-2表达,表现出较好的抗炎活性[24]。在本试验中发现,当不定根提取物浓度达到100 μg/mL时,显著地抑制了iNOS、COX-2的表达。在炎症反应的整个过程中,巨噬细胞、嗜酸性粒细胞、中性粒细胞等几种增殖细胞都参与到IL-1β、IL-6、TNF-α等多种细胞因子的合成和释放[25]。还有研究发现,紫松果菊挥发油能够显著地抑制TNF-α、IL-6的释放[26]。而在本试验中,白色紫锥菊不定根的提取物对TNF-α、IL-1β的释放也表现出显著的抑制效果,而对IL-6的释放却没有产生影响。
对于抗炎信号通路的研究,MAPKs信号通路在大多数炎症细胞内均有发现,在细胞生物学的反应过程中起着非常重要的作用。MAPKs主要包括p38、ERK、JNK,其活化途径具高度保守性,能够活化巨噬细胞释放促炎因子。ERK可被各类因子及神经递质等多种信使分子刺激而活化,主要发挥细胞增生和分化作用,在细胞凋亡方面也有相应作用,该活化后效应主要取决于转导信号的作用时间长短和强度大小[27]。相关研究表明,p38和JNK两种传导通路主要参与细胞凋亡过程,能够介导细胞对抗应激反应,可被多种信号活化[28]。通常情况下,植物多糖的毒副作用都非常小[29]。相关研究对紫锥菊多糖进行分析,探究其参与信号通路的调控机制,结果发现,紫锥菊多糖对于ERK、JNK 、p65、p38的磷酸化能够产生有效的抑制,且对MAPK信号通路的转导也会产生抑制[30]。徐歆[31]研究发现,紫锥菊的提取物可调控TLR及其衔接分子MyD88、TRIF的基因表达,并激活信号分子ERK、JNK、p38MAPK及NF-κB,以调节小鼠BMDM的细胞因子分泌和NO合成。而在本试验中,不定根提取物显著地抑制了MAPKs信号通路中的p38、ERK和JNK的磷酸化,从而说明白色紫锥菊不定根的提取物通过调控MAPKs信号通路的传导,进而起到抗炎作用。
4 结论
通过生物反应器培养的白色紫锥菊不定根,其提取物对经LPS诱导后的小鼠巨噬细胞中的促炎介质(TNF-α、NO、IL-lβ和PGE2)的释放以及COX-2、iNOS的表达具有显著的抑制作用;且能够显著地抑制MAPKs信号通路传导中的p38、ERK、JNK的磷酸化。因此,白色紫锥菊不定根作为一种新型的植物材料,可用于今后抗炎产品的开发和利用。

