基于EDTA功能化石墨烯的水质Cu(Ⅱ)电化学传感器
伊雯雯,李忠平*,王园琴,2,李俊芬,董 川
(1.山西大学环境科学研究所,化学化工学院,山西太原030006;2.鸿富晋精密工业有限公司,山西太原030006)
Cu(Ⅱ)易被人体吸收,在体内聚集,不易被降解,很容易引发各种疾病,如神经失调(阿尔茨海默病)[1-2],慢性病(糖尿病、心血管疾病和动脉硬化等)[3-4]、溶血性贫血疾病和肝炎,甚至癌症[5-6]等。我国对各类水体中Cu(Ⅱ)的排放量有着明确的规定[7],生活饮用水中的含Cu(Ⅱ)量不得超过1mg·L!1;地面水中最高排放量为0.1mg·L-1。因此,研究水质中重金属Cu(Ⅱ)的检测方法具有重要现实意义。目前,水环境中重金属Cu(Ⅱ)的常规检测方法,包括分光光度法[8]、荧光光谱法[9]、原子光谱法[10]、色谱法以及电化学法[11]、电感耦合等离子体质谱分析法[12]等。近些年,一些新的检测技术,如免疫分析法[13]、生物传感器法[14]、酶抑制法[15]等也得到了发展。
石墨烯(GN)是一种由单层碳原子紧密堆积成二维蜂窝状晶体结构的新型碳材料,具有较大的比表面积、优良的电子传输性能[16]、良好的化学稳定性以及和其他纳米材料或生物材料兼容性好等优异的物理性能[17]。这些优异的性能使它成为电化学、电催化和生物传感器等领域的研究热点。本文构建了一种基于EDTA功能化石墨烯的Cu(Ⅱ)电化学传感器。采用乙二胺还原氧化石墨烯(GO)的方法,构建EDTA功能化石墨烯纳米材料修饰玻碳电极(EDTA/rGO/GCE),并研究Cu(Ⅱ)在EDTA/rGO/GCE修饰电极上的电化学行为,采用差分脉冲法(DPV)建立测定水质中Cu(Ⅱ)浓度的方法。在已有的报道里尚未见到EDTA/rGO/GCE修饰电极测定Cu(Ⅱ),本文提出的电化学传感器具有方法简单、快速、环保等优点,所制备的EDTA/rGO/GCE具有较好的抗干扰性能及稳定性,具有一定的应用价值。
1 实验部分
1.1 仪器与试剂
CHI660C型电化学工作站(上海辰华仪器公司);三电极系统:玻碳电极(GCE,3mm)或修饰电极为工作电极,Ag/AgCl电极为参比电极,铂丝为辅助电极;pHS-3D型pH计(上海雷磁分析仪器厂)。
Cu(Ⅱ)标准储备溶液:0.01mol·L-1,用CuSO4·5H2O配制而成,用时再稀释至所需浓度。EDTA(北京化工厂),乙二胺(天津市北辰方正试剂厂),(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)(EDC)、KMnO4、NaNO3、30%H2O2(上海Aladdin试剂有限公司),石墨粉(天津市苏庄化学试剂厂),所用试剂均为分析纯。实验用水为超纯水。
1.2 GO、rGO、EDTA/rGO材料的制备
氧化石墨烯(GO)采用改进的 Hummers法[18-19]制备。冰浴条件下,将3g石墨和1.5g NaNO3加入到70mL的浓H2SO4中,在搅拌条件下缓慢地加入9g KMnO4,混合物在4℃冰水浴中反应90min。将冰水浴换成温水浴,中温反应,在搅拌下将温度控制在35℃,让其反应30min,溶液呈紫绿色。缓慢加入140mL水,加热保持温度95℃左右,高温反应,保持15min,再缓慢加入500mL水,随后加入一定量的30%H2O2,此时反应液变成金黄色,停止反应。将混合物离心,并用HCl(1+10)洗涤,最后用水洗涤,材料在60℃的条件下干燥6h,即得GO[20]。将合成的材料分散在水中,超声3h得到0.5mg·mL-1的GO溶液。还原氧化石墨烯(rGO)采用乙二胺还原GO。在5mL 0.5mg·mL-1GO溶液中加入25μmol·L-1的乙二胺,90℃下回流3h,洗涤干燥得到rGO。称取上述制备的0.1g rGO,分散在10mL水中,然后加入EDTA溶液(其包括0.1mol·L-1EDC和0.01mol·L-1EDTA,在pH=7.2磷酸缓冲溶液中配制),然后在室温下搅拌反应24h。得到EDTA/rGO复合材料。
1.3 修饰电极的制备
用0.02~0.05μm的Al2O3粉末悬浊液将GCE分别在白色尼龙抛光布和棕色绒料抛光布上抛光成镜面,之后依次在水、乙醇、水中各超声清洗1~2min,最后在氮气氛中进行干燥。取10μL的EDTA/rGO悬浮液小心滴涂在GCE表面,在红外灯下烘干,得到EDTA/rGO/GCE修饰电极。
1.4 电化学测定方法
将EDTA/rGO/GCE修饰电极浸入加有一定量Cu(Ⅱ)标准溶液的,0.2mol·L-1HAc-NaAc缓冲溶液(pH=4.5)中,选用循环伏安法(CV)、差分脉冲伏安法(DPV)考察Cu(Ⅱ)在EDTA/rGO/GCE表面的电化学行为。设定扫描电位范围为-0.2~0.6V,扫描速度为100mV·s-1。
2 结果与讨论
2.1 rGO和EDTA/rGO的扫描电镜(SEM)表征
利用SEM对制备的rGO和EDTA/rGO的形貌进行表征。由图1可以看得出,rGO的褶皱程度较大,堆积也较为严重,而EDTA/rGO的分散性更好,具有明显的单层结构。

图1 rGO(a)和EDTA/rGO(b)扫描电镜(SEM)图Fig.1 SEM images of rGO(a)and EDTA/rGO(b)
2.2 rGO及EDTA/rGO的红外光谱表征
图2 为 GO(a)、rGO(b)及 EDTA/rGO(c)的红外光谱图,可看到 GO在3 394.88cm-1处形成较宽峰,应该属于-OH的伸缩振动;1 724.41cm-1应该归属于C=O的弯曲振动;1 628.37cm-1归属于C=C的伸缩振动;1 399.32cm-1应归属于C-OH的伸缩振动;1 058.43cm-1归属于C-O-C的伸缩振动。rGO在3 445.30cm-1处出峰,此峰应归属于 N-H 的峰,与 GO相比,在1 724.41、1 628.37、1 399.32cm-1处的吸收峰明显减弱甚至消失,这说明本实验已成功地制备了乙二胺还原的氧化石墨烯[21-22]。EDTA/rGO在3 469.79、1 635.81、1 084.55cm-1处出峰,表明EDTA/rGO含有大量氮和氧官能团。
2.3 Cu(Ⅱ)在EDTA/rGO/GCE上的电化学行为
为了研究修饰电极的电化学性能,将裸GCE、rGO/GCE和EDTA/rGO/GCE作为工作电极,分别在含有40μmol·L-1Cu(Ⅱ)的电解质溶液中,在-0.2~0.6V电位范围,扫描速率为100mV·s-1条件下进行电化学测试。从图3(A)中可以看出,EDTA/rGO/GCE在0.05V左右出现了明显Cu(Ⅱ)的溶出峰电流,归因于rGO增加了电极的电催化活性和有效面积。修饰EDTA的纳米复合材料结构中EDTA有6个配位原子,具有环状结构,有助于选择性的与来自水性介质的特定金属离子结合。由图3(B)可以看出,在EDTA/rGO/GCE检测过程中,随着Cu(Ⅱ)浓度从40μmol·L-1到100μmol·L-1的不断增加,Cu(Ⅱ)的溶出峰电流也在不断增加,表明EDTA/rGO/GCE对Cu(Ⅱ)有很好的电化学响应。
2.4 检测Cu(Ⅱ)实验条件优化
2.4.1 支持电解质和pH的影响 根据文献报道[23],选择0.2mol·L-1HAC-NaAc作为支持电解质。考察了含有80μmol·L-1Cu(Ⅱ)的0.2mol·L-1HAc-NaAc溶液在不同pH值时的峰电流响应。从图4(a)中可知,在pH=4.5时,峰电流最高。实验选取0.2mol·L-1HAc-NaAc缓冲溶液(pH=4.5)为支持电解质溶液。

图2 GO(a)、rGO(b)及EDTA/rGO(c)的红外光谱图Fig.2 The infrared spectra of GO(a),rGO(b)and EDTA/rGO(c)
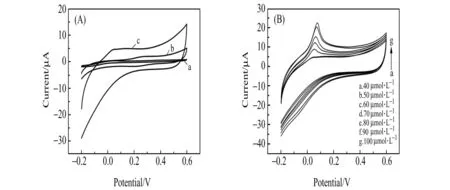
图3 (A)GCE(a)、rGO/GCE(b)和EDTA/rGO/GCE(c)在含40μmol·L-1Cu(Ⅱ)的电解质溶液中的循环伏安(CV)图;(B)不同浓度Cu(Ⅱ)在EDTA/rGO/GCE上的CV图Fig.3 (A)CVs of GCE(a),rGO/GCE(b)and EDTA/rGO/GCE(c)in electrolyte with 40μmol·L-1 Cu(Ⅱ);(B)CVs of Cu(Ⅱ)with different concentration at EDTA/rGO/GCE
2.4.2 沉积电位和沉积时间 在-0.2~-1.2V电位范围内考察了不同的沉积电位对Cu(Ⅱ)的溶出峰电流的影响(图4(b))。随着沉积电位的负移,Cu(Ⅱ)被还原趋于完全,溶出峰电流随之增大,但沉积电位若太负,背景电流也开始增加,溶出峰电流降低,峰形变差。相较而言,沉积电位为-1.1V时,Cu(Ⅱ)溶出峰信号最优,实验选择沉积电位为-1.1V。在选定的沉积电位下,沉积时间从50s增至400s时溶出峰电流逐渐增加,但到300s后增加幅度变小。综合考虑电极稳定性、时效性及灵敏度等因素。沉积时间选为300s。

图4 支持电解质pH(a)和沉积电位对峰电流的影响(b)Fig.4 The effect of supporting electrolyte pH(a)and deposition potential(b)on peak current
2.4.3 扫描速度 考察了EDTA/rGO/GCE在含有80μmol·L-1Cu(Ⅱ)的0.2mol·L-1HAc-NaAc缓冲溶液(pH=4.5)中,于不同扫速下的循环伏安(CV)行为。如图5所示,随着扫速的不断增加,峰电流也不断增加,并伴随着峰电位的正移。实验选择扫速为100mV·s-1,在此扫速下峰电流稳定,峰形较好。
2.4.4 修饰剂用量的选择 分别滴涂EDTA/rGO悬浮液3、5、7、10、12μL到GCE上,将修饰电极在电解质溶液中对40μmol·L-1的Cu(Ⅱ)溶液做CV测试。结果表明:EDTA/rGO用量在小于10μL时溶出峰电流随着修饰量的增加而增大,当用量继续增加时峰电流有所降低,电极修饰量增加反而阻碍了电子之间的交换与传递,材料脱落显现也较明显,峰电流值有所降低。故选用修饰剂用量10μL。
2.5 电化学测定Cu(Ⅱ)
在优化条件下,采用DPV法对Cu(Ⅱ)溶液进行电化学检测。从图6可见,随着Cu(Ⅱ)的浓度不断增加,Cu(Ⅱ)的溶出峰电流逐渐增加。Cu(Ⅱ)在4.0×10-5~2.0×1.0-4mol·L-1范围与对应峰电流值之间呈线性关系,线性回归方程为:Ipc(μA)=0.11707c(μmol·L-1)-4.26702,相关系数R2=0.9655,检出限为1.3×10-5mol·L-1。说明EDTA/rGO/GCE修饰电极可以实现对较低浓度Cu(Ⅱ)的快速定量分析。

图5 不同扫速下Cu(Ⅱ)在EDTA/rGO/GCE上的循环伏安(CVs)图Fig.5 CVs of Cu(Ⅱ)at different sweep speeds at EDTA/rGO/GCEa→e:20,50,80,100,120mV·s-1,respectively.buffer solution:0.2mol·L-1 HAc-NaAc(pH=4.6).

图6 不同浓度Cu(Ⅱ)在EDTA/rGO/GCE上的差分脉冲伏安(DPV)曲线Fig.6 DPV curves of Cu(Ⅱ)with different concentrations at EDTA/rGO/GCEa→h:40,50,80,120,140,160,180,200μmol·L-1,respectively.buffer solution:0.2mol·L-1 HAc-NaAc(pH=4.6).
2.6 修饰电极抗干扰能力和稳定性
抗干扰能力是决定传感器实用性的重要指标。在循环伏安法检测过程中,加入与Cu(Ⅱ)相同浓度的其它金属离子并进行检测,以评估修饰电极的抗干扰能力。图7是 EDTA/rGO/GCE 在0.2mol·L-1HAc-NaAc缓冲溶液(pH=4.5)中,对浓度均为80μmol·L-1的 Mn2+、Cr3+、Ni2+、Fe3+、K+、Pb2+、Mg2+、Ca2+、Co2+、Cu2+的电化学响应情况。结果表明,EDTA/rGO复合材料修饰电极对Cu(Ⅱ)表现出强的峰电流响应,对同浓度的其它金属离子检测的电化学信号较弱,表明基于DPV法的EDTA/rGO/GCE对溶液中Cu(Ⅱ)的检测具有较好的选择性。
稳定性亦是电化学传感器实际应用的一个重要的考察指标。为了考察制得的传感器对Cu(Ⅱ)检测的稳定性,通过使用同一根电极对0.2mol·L-1HAc-NaAc缓冲溶液中Cu(Ⅱ)(80μmol·L-1)连续测量了8次,8次连续测量的峰电流值变化很小,相对标准偏差(RSD)为2.29%。说明EDTA/rGO/GCE有较好的稳定性。

图7 EDTA/rGO/GCE对80μmol·L-1金属离子的电化学响应Fig.7 The electrochemical responses of EDTA/rGO/GCE for 80μmol·L-1 different metal ions
3 结论
本文构建的电化学传感器具有方法简单、快速、环保等优点,能够应用于水质中重金属Cu(Ⅱ)的快速检测,所制备的EDTA/rGO/GCE具有较好的抗干扰性能及稳定性,具有一定的应用价值。

