尼罗罗非鱼Hsc70的原核表达和多克隆抗体制备
潘传燕,林 勇,冯鹏霏,张永德,罗洪林
(广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
热休克同源蛋白Hsc70(heat shock cognate 70 ku protein)是热休克蛋白Hsp 70家族(heat shock proteins, Hsp70)的成员之一,也称Hsp73,是一种结合蛋白。Hsc70由两个结构域组成:一个结构域(N端)是相对分子质量为44 ku的三磷苷酶(ATPase)功能域,该区域高度保守,是ATP的结合位点;另一个结构域(C端)是一个25 ku的区域,该区域包含3个部分:多肽结合功能域、靠近C末端的可变区和C末端的基序。Hsc70和Hsp70具有高度的序列同源性(95%)和相似的生物化学特性。Hsc70在所有正常细胞内均能表达, 环境刺激(如细菌感染、高温等)后其表达量有不同程度的增加[1-2]。Hsc70存在于原核及真核生物细胞中,具有多种生物学功能:作为分子伴侣促进蛋白质折叠、定位、组装等[3];参与免疫调节[4];参与细胞的生命历程,如细胞分裂、分化和凋亡[5-7];参与细胞抗氧化,有效保护细胞免受氧化及炎症反应带来的伤害[8]等。此外,王宇萍[9]指出:Hsc70的表达水平与HBV的复制呈正相关,Hsc70可能成为抗HBV的新型药物靶点。Hsc70 在不同组织中的表达量具有差异性,这一特点已经在斑马鱼、鲤鱼、黄颡鱼和虹鳟等鱼类中得到证实[2,10-12]。
罗非鱼具有多种优良的养殖性状,受到世界各国养殖户和消费者的青睐。我国是罗非鱼养殖大国,但细菌性疾病的暴发给我国罗非鱼产业造成了巨大的经济损失,并冲击了我国罗非鱼产业的发展。罗非鱼自身的抗应激能力是抵御细菌感染、应对环境胁迫的关键因素,决定了养殖成活率和养殖效益。Hsc70基因作为一种重要的看家基因,与生物体的抗逆抗应激能力密切相关, 影响机体的存活能力和生长速率[5]。目前,部分鱼类的Hsc70已被成功克隆,如黄颡鱼、大菱鲆、南方鲇、虹鳟、青鳉、松江鲈、岩原鲤等。张娟等[2]发现黄颡鱼Hsc70呈组成型表达,在多种组织中均有表达,但表达量有差异。高海霞[13]成功构建了松江鲈Hsc70的原核表达载体,并获得了其重组蛋白。研究表明,Hsc70受到高温、重金属、细菌感染等外界刺激时,会被诱导表达,维持内环境稳态[14-15]。关于尼罗罗非鱼Hsc70的原核表达和多抗制备还未见报道。因此,本研究利用无缝克隆技术构建尼罗罗非鱼Hsc70表达载体,分析其重组蛋白的表达情况,制备多克隆抗体,以期为进一步研究尼罗罗非鱼Hsc70的功能奠定基础。
1 材料与方法
1.1 材料
尼罗罗非鱼cDNA、质粒均为本实验室制备;蛋白原核表达载体pET-B2m(由pET-28a改造而来)和转化表达宿主菌B21均为武汉金开瑞生物工程有限公司产品;T4 DNA Ligase、DNA聚合酶、蛋白marker、限制性内切酶购自美国Fermentas公司;诱导剂IPTG购自德国默克公司,弗式完全佐剂、弗氏不完全佐剂是美国Sigma公司的产品;PVDF膜购自ThermoFisher公司;羊抗兔-HRP抗体购自美国Jackson公司;DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技有限公司(北京);Ni-NTA亲和层析树脂购自GE Healthcare公司。
1.2 试验方法
1.2.1 抗原预测
采用在线分析工具ExPASy中的ProtScale(https://web.expasy.org/protscale/)预测Hsc70蛋白质疏水性,TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测Hsc70蛋白序列的跨膜区间。使用DNAstar软件预测Hsc70蛋白的亲水性、抗原指数等。采用Swiss-model在线分析软件(https://swissmodel.expasy.org)对Hsc70蛋白进行三级结构建模。
1.2.2Hsc70基因扩增与原核表达质粒构建
根据尼罗罗非鱼Hsc70基因序列(NCBI登录号:XP 003455104.1),利用Primer Premier 5.0软件设计引物,上游引物序列为5′-TCCACTGGGTTCTCGGACTATGAGCAAAGGTCCGG-3′;下游引物序列为5′-TAAGGCCGCACTCGAGCACCACATCAACTTCTTCAATT-3′。引物由生工生物工程(上海)股份有限公司合成。PCR扩增程序:94 ℃预变性4 min;94 ℃变性 45 s,52 ℃退火 45 s,72 ℃延伸 45 s,共28个循环;72 ℃延伸10 min。PCR产物用琼脂糖凝胶电泳检测后进行切胶回收。
将PCR产物和载体用SalⅠ与BamHⅠ进行双酶切处理后,将目的片段与载体连接,构建重组质粒pET-B2m-Hsc70,转入大肠埃希菌B21;筛选含有Amp+的阳性克隆,提取质粒进行PCR扩增,电泳检测扩增产物后送生工生物工程(上海)股份有限公司进行测序鉴定。
1.2.3 重组蛋白的原核表达及纯化
将重组质粒(pET-B2m-Hsc70)转化表达菌株B21,在含有Amp+(100 g·mL-1)的LB培养基上进行涂布,37 ℃振荡培养至D600为0.6,之后培养温度降至30 ℃;加入诱导剂IPTG至终浓度0.5 mmol·L-1,30 ℃诱导培养3 h。收集菌液,6 000g离心10 min收集菌体。用冰浴超声波破碎细菌,在4 ℃的低温条件下20 000g离心30 min,收集上清和沉淀,SDS-PAGE电泳检测目的蛋白的表达情况和可溶性。
在Ni-NTA树脂层析柱中缓慢加入收集的诱导表达菌,流速为0.5 mL·min-1,收集穿柱液体。层析用 10倍柱床体积的NTA-0缓冲液冲洗,流速控制在1 mL·min-1左右,接着分别用10倍柱床体积的NTA-20、NTA-60、NTA-200、NTA-500缓冲液洗脱,控制流速约1 mL·min-1,收集各洗脱液,通过SDS-PAGE电泳检测重组蛋白的纯度,紫外吸收法检测纯化蛋白的浓度。纯度达到要求的组分,于透析袋中4 ℃以1×PBS进行透析,最后于4 ℃超滤浓缩透析产物,用5 mL 8 mol·L-1的尿素溶液溶解目的蛋白。
1.2.4 多克隆抗体制备、效价检测
取2只日本大耳兔,耳静脉采血作为免疫前血清。纯化后的重组蛋白与等容积的弗氏完全佐剂混合,采用皮下多点注射法按每只500 μg的剂量免疫2只日本大耳白兔。每只兔子至少经过4次免疫,根据免疫效价,评估是否进行第5次、第6次的免疫,每次免疫中间隔14 d。免疫7 d后,耳静脉采血,用间接ELISA法检测血清中抗体的效价。
重组Hsc70蛋白(2 μg·mL-1)按每孔100 μL的量加入96孔板中进行抗原包被,4 ℃过夜;将待检血清按1∶2 000、1∶4 000作二倍梯度稀释至1∶32 768 000,稀释液作为一抗,各稀释梯度取100 μL至96孔板中,以免疫前血清作为阴性对照;HRP标记的羊抗兔IgG作为二抗。每个反应孔用TMB显色液100 μL显色20 min,之后加入50 μL H2SO4终止反应。用酶标仪检测450 nm处的D值。出现阳性反应的最大稀释度即是待测样品的效价。
1.2.5 抗体纯化
采用Protein G亲和层析柱对Hsc70蛋白多克隆抗体进行纯化,详细操作步骤见张永德等[16],将抗血清与2×PBS缓冲液等体积混合,经10倍柱体积以上的PBS洗涤,至流出液无蛋白检出,加入2倍柱体积0.1 mol·L-1柠檬酸(pH 2.7)洗脱,收集洗脱产物,纯化所得的抗体经SDS-PAGE电泳检测,-20 ℃保存备用。
1.2.6 Western blot检测
取25 ng和10 ng纯化后的重组蛋白进行SDS-PAGE电泳,电泳后将其转移至PVDF膜,于封闭液中封闭2 h。加入制备的多克隆抗体(1∶1 000),37 ℃孵育1 h;洗涤后再用HRP标记的羊抗兔IgG,37 ℃孵育1 h后进行显色反应,取出拍照分析抗体的特异性。
2 结果与分析
2.1 抗原分析结果
根据蛋白的二级机构、B细胞表位、跨膜序列、疏水性等参数的分析(图1),Swiss-model构建的Hsc70 3D模型见图2。结果显示,Hsc70基因编码蛋白由646个氨基酸组成,从重组蛋白表达来看,无跨膜区,无信号肽序列,亲水性好,抗原指数得分也适中,可以引起较好的免疫。
2.2 原核表达质粒的构建与鉴定结果
以重组质粒pET-B2m-Hsc70为模板,扩增Hsc70基因,扩增产物用琼脂糖凝胶电泳检测,获得一条1 938 bp的目的条带(图3),与预期大小一致。测序结果显示:连接到载体中的目的序列与NCBI上的序列一致,且方向正确,确定Hsc70基因已正确插入载体pET-B2m中,表明重组质粒构建成功。
2.3 目的蛋白的表达与鉴定结果
对重组蛋白进行大量诱导表达,诱导条件为:

图1 尼罗罗非鱼Hsc70抗原表位分析Fig.1 Analysis of epitope of Hsc70 in Nile tilapia

图2 Hsc70三级结构建模Fig.2 Hsc70 tertiary structure modeling
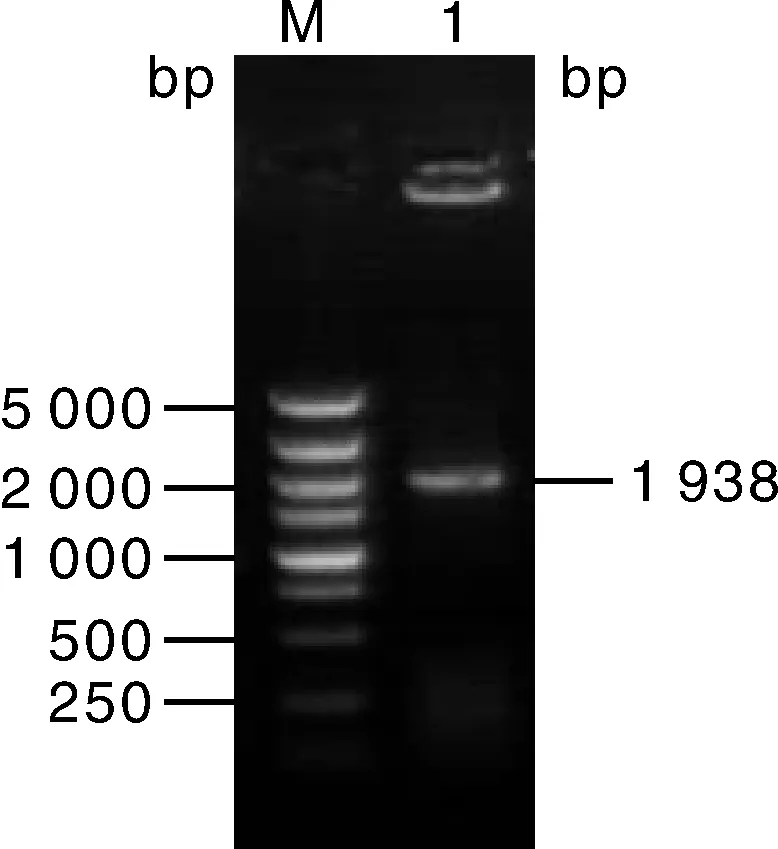
M,DL2000;1,Hsc70。图3 Hsc70基因扩增结果Fig.3 PCR amplification of Hsc70

M,蛋白标准;1~2,其他蛋白;3,表达菌上清;4,表达菌沉淀。M, Marker;1~2, Other proteins; 3, The supernatant of expressed proteins;4, The precipitate of expressed proteins.图4 重组蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of recombinant protein
诱导剂IPTG终浓度为0.5 mmol·L-1,诱导培养3 h后收集菌体进行SDS-PAGE电泳,结果如图4,上清液与沉淀均在75 ku处出现蛋白条带,且沉淀的蛋白条带较上清液粗,沉淀中的目的蛋白含量显著高于上清液(图4),说明重组蛋白主要存在于沉淀中,目的蛋白主要以包涵体的形式存在。
2.4 重组蛋白纯化结果
重组Hsc70蛋白主要以包涵体的形式存在,利用Ni-NTA树脂层析柱纯化目的蛋白。纯化后的重组蛋白经10倍稀释后进行SDS-PAGE电泳,结果显示,在75 ku处有一条清晰的条带(图5)。纯化后重组蛋白的纯度达到90%,浓度为2 mg·mL-1,是适合免疫日本大耳兔的抗原。

M,蛋白标准;1,Hsc70。M, Marker;1, Hsc70.图5 重组蛋白纯化产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of purified recombinant protein
2.5 多克隆抗体的效价测定
以免疫前血清作为阴性对照,免疫7 d后,耳静脉采血,用间接ELISA法检测多克隆抗体的效价。结果如图6,抗体的效价为 1∶2 048 000,说明该重组蛋白能诱导日本大耳兔产生良好的免疫反应。

图6 Hsc70多克隆抗体的ELISA曲线Fig.6 ELISA curves of Hsc70 polyclonal antibody
2.6 抗体纯化结果
收集的抗血清经Protein G亲和层析柱纯化后,通过SDS-PAGE电泳检测,结果显示,在约50 ku和25 ku处均出现一条清晰的蛋白条带(图7)。纯化后的抗体纯度大于85%,浓度为10 mg·mL-1,抗体纯化效果良好。
2.7 Western blot检测结果
纯化后的重组蛋白进行Western blot检测,结果见图8,25 ng和10 ng重组蛋白均在约75 ku处出现一条清晰蛋白条带,且25 ng蛋白条带较10 ng的蛋白条带粗,而免疫前血清对照组在相应位置无特异性条带,不存在特异性反应,表明Hsc70抗血清具有较高的特异性。

M,蛋白标准;1,Hsc70抗体。M, Marker; 1, Hsc70 polyclonal antibody.图7 Hsc70抗体纯化结果Fig.7 Analysis of purified products of Hsc70 polyclonal antibody
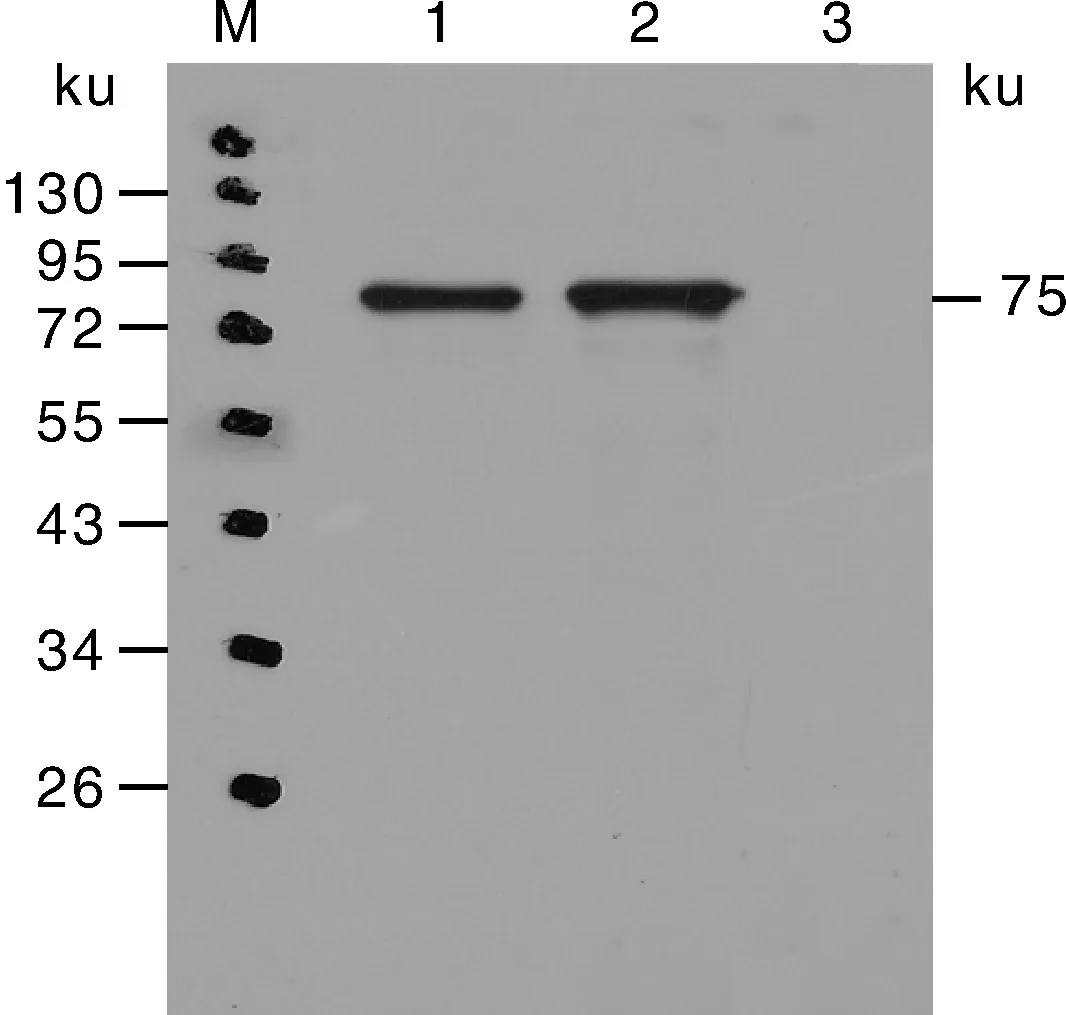
M,蛋白标准;1,10 ng Hsc70重组蛋白;2,25 ng Hsc70重组蛋白;3,阴性对照。M, Marker; 1, 10 ng Hsc70 recombinant protein; 2, 25 ng Hsc70 recombinant protein; 3, Negative control.图8 Western blot印迹分析多克隆抗体的特异性Fig.8 Specificity of polyclonal antibody by Western blot assays
3 讨论
Hsp70是热休克蛋白中最保守、最重要,也是研究最深入的蛋白质家族之一,能在各种外界刺激如温度胁迫、盐度胁迫、溶解氧胁迫、微生物感染等的诱导下表达。Hsc70是Hsp70家族的结构型蛋白成员之一,含有较多的内含子,具有管家基因的功能,研究发现,敲除小鼠体内的Hsc70基因,小鼠细胞无法存活[17]。在正常环境下,Hsc70为组成型表达[18],受到外界刺激时为诱导表达,这一点已在部分鱼类得到验证,如病原感染能诱导大菱鲆Hsc70表达[19],热刺激可诱导黄颡鱼Hsc70表达[2]。目前,已在多种生物中克隆出Hsc70,如近江牡蛎、草鱼、孔雀鱼、豆卜馍夜蛾、中华鳖、凡纳滨对虾等[4,20-24]。郑薇薇[25]首次克隆了棉铃虫Hsc70,并证实20-羟基蜕皮酮可诱导Hsc70入核表达。冯冰冰等[26]从缢蛏中获得了Hsc70亚家族基因并命名为ScHsc70,ScHsc70基因可能参与了对细菌感染的防御反应。章海滨等[5]克隆出岩原鲤Hsc70,其氨基酸序列与草鱼的有100%同源性,岩原鲤Hsc70基因的表达存在明显的组织差异性。Li等[27]报道,中国软壳海龟受热刺激后,Hsc70转录水平会迅速上调,其蛋白相对表达量增加数十倍。
多克隆抗体是用一种包含多种抗原决定簇的抗原免疫动物,该动物机体所产生的抗体就是多克隆抗体,所获得的免疫血清实际上是含有多种抗体的混合物。制备多克隆抗体过程较简单,直接用抗原免疫动物,经过3~4次免疫,ELISA检测效价,收集抗血清,纯化后即可得到多克隆抗体。制备高效价的抗体是检测基因表达和研究基因功能的重要前提[28]。多克隆抗体具有制备周期短、技术要求不高、稳定性较好、能识别多个表位、制备成本较低等优点,广泛使用于多个科研领域[29],如常用于变性蛋白的检测,石蜡包埋组织切片的染色,相应抗原的标记,农药残留现场监测,病原物的检测、疾病的诊断及治疗等。多克隆抗体因制备较简单和用途广泛而在细菌、病毒、动植物等多种生物开展研究,通过制备多克隆抗体为进一步研究相关蛋白的功能做准备。洪伟鸣等[30]制备了单增李斯特菌溶血素(listeriolysiono,LLO)多克隆抗体;毕庄莉等[31]获得了效价高、特异性好的新型鸭呼肠孤病毒σC蛋白的多克隆抗体;彭琪琪等[32]制备了一个植物半胱氨酸蛋白酶的多克隆抗体等。本研究利用大肠埃希菌原核表达系统成功表达尼罗罗非鱼Hsc70蛋白,通过纯化包涵体蛋白并免疫日本大耳兔获得了效价高、特异性强的多克隆抗体。
在制备抗体前对目的蛋白进行生物信息学分析,有利于提高抗体制备的成功率。Hsc70基因结构上高度保守,经生物信息学软件分析,编码646个氨基酸,无跨膜区,无信号肽序列,亲水性好,抗原表位较好,适合用于抗原抗体制备。本研究在对Hsc70进行生物信息学分析的基础上,表达全长蛋白进行多抗免疫,实验结果表明,全长表达的蛋白具有良好的免疫原性,获得的多克隆抗体,效价达1∶2 048 000,且能特异性的识别尼罗罗非鱼Hsc70蛋白。本研究获得的重组蛋白和多克隆抗体为Hsc70功能研究提供了物质基础。

