一株分离自鸡肉样品的多重耐药大肠埃希菌的全基因组测序及耐药性研究
常 江,罗 怡,唐 标,张 玲,戴贤君,裘罕琦,杨 华,夏效东
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100; 2.浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021; 3.中国计量大学 现代科技学院,浙江 杭州 310018)
大肠埃希菌(Escherichiacoli)是一种常见的革兰氏阴性短杆菌,周生鞭毛和菌毛,是一种重要的水源和食品粪便污染指示菌[1]。大肠埃希菌常见于人与动物肠道中,是一种条件致病菌,部分大肠埃希菌可以产生肠毒素,使婴幼儿出现严重的腹泻[2]。目前活禽买卖交易已经在国内大多数城市被禁止[3],冷鲜鸡因其肉质鲜嫩、口感细腻、营养保留完整等优点日益受到消费者的欢迎[4]。然而,抗生素因其促生长及预防疾病的作用被广泛应用于禽类养殖中,在提高禽肉产品质量和产量的同时也导致了细菌耐药性问题的出现,引起了人们极大的关注[5]。大肠埃希菌作为重要的耐药基因储藏库,其携带的耐药基因可以通过食物链或直接接触的方式进行传播。同时,存在于大肠埃希菌中的耐药基因可以通过水平基因元件(包括质粒、转座子、整合子等)等发生垂直和水平传播,使得细菌耐药性发生进一步的扩散[6-7]。鸡肉从养殖到屠宰、运输再到消费者餐桌上的产业链中会携带大量的耐药细菌,对食品安全和人们的健康产生很大的威胁[8-10]。
本实验以在对鸡肉样本大肠埃希菌监测中分离到的一株多重耐药大肠埃希菌为研究对象,获得了其全基因组完成图并进行了序列分析,预测了其可能的多重耐药机制。实验结果将为鸡肉污染微生物耐药性评估提供有力依据。
1 材料与方法
1.1 大肠埃希菌分离
在浙江省宁波市具有代表性的几个大型超市及农贸市场中采集冷鲜鸡样品20份,根据《GB4789.38—2012食品安全国家标准 食品微生物学检验 大肠埃希氏菌计数》初步分离鉴定大肠埃希菌。将采集到的冷鲜鸡样品放入含有10 mL缓冲蛋白胨水(BPW)的无菌袋中,充分混匀,36 ℃培养24 h;将培养得到的BPW增菌液划线于伊红美蓝(EMB)平板上,36 ℃培养24 h;随后挑取绿色、具有金属光泽的单菌落再次划线于EMB平板,36 ℃培养24 h;之后选取绿色、带金属光泽的单菌落划线于LB平板,36 ℃培养18~24 h,收集菌体于25%甘油中,-80 ℃条件下保藏备用。
1.2 大肠埃希菌鉴定
将-80 ℃保藏的大肠埃希菌疑似菌株划线接种于LB平板,36 ℃培养18 h后挑取单菌落,按照VITEK®2 COMPACT 全自动微生物分析系统仪的标准操作流程鉴定大肠埃希菌。首先使用无菌棉签在LB平板上刮取适量菌落于0.45%氯化钠中,调整浊度至0.50~0.63麦氏浊度,然后将菌液放置于充填机中,通过真空泵以负压形式使菌液均匀分布于细菌鉴定卡片。最后取出细菌鉴定卡放置于系统培养室,同时启动相关程序。分析结果大概在8~10 h后显示[11]。细菌鉴定实验质控菌株为大肠埃希菌ATCC 25922。
1.3 细菌药敏试验
使用Biofosun®革兰阴性需氧菌药敏检测板(Fosun Diagnostics,Shanghai,China),选择较常见的16种抗生素。采用美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute of America,CLSI)的M100-S26/M45-A2/M31-A2等文件中推荐的微量肉汤稀释法测试具有多重耐药表型的大肠埃希菌分离株对氨苄西林(AMP)、奥格门丁(A/C)、庆大霉素(GEN)、大观霉素(SPT)、四环素(TET)、氟苯尼考(FFC)、磺胺异恶唑(SF)、复方新诺明(SXT)、头孢噻呋(CEF)、头孢他啶(CAZ)、恩诺沙星(ENR)、氧氟沙星(OFL)、美罗培南(MEM)、安普霉素(APR)、粘杆菌素(CL)、乙酰甲喹(MEQ)的耐药能力,参考CLSI(M100-S26/M45-A2/M31-A2)的相关药敏折点判定标准将耐药能力分为耐药(R)、中介(I)、敏感(S)。
1.4 基因组DNA的提取
菌株接种至LB琼脂培养基于36 ℃活化培养18 h,转接至LB液体培养基于36 ℃、180 r·min-1培养4 h,收集菌体。使用上海捷瑞细菌基因组DNA提取试剂盒按照说明书步骤提取基因组DNA。
1.5 菌株基因组的测序、组装与注释
基因组DNA提取后进行质量鉴定,在浓度和纯度达到测序要求后,对样品构建1个20 k大片段文库,使用第三代测序仪PacBio RS Ⅱ对DNA进行非扩增长片段测序[12]。原始数据经过预处理过滤接头以及去除低质量的数据后,采用Celera Assembler组装软件[13]用OLC组装算法,调试参数进行序列组装,利用quiver对组装结果进行优化[14]。使用NCBI Prokaryotic Genome Annotation Pipeline对基因组进行基因预测与功能注释[15]。将测序得到的全基因组序列及注释结果上传至美国国家生物技术信息中心(NCBI)核酸数据库GenBank上,获得登录号(accession number)分别为CP033635(染色体)、CP033632(pTB-nb1质粒)、CP033633(pTB-nb2质粒)、CP033634(pTB-nb3质粒)、CP033636(pTB-nb4质粒)。
1.6 菌株全基因组序列分析
使用PlasmidFinder-1.3(https://cge.cbs.dtu.dk/services/PlasmidFinder/)[16]鉴定菌株携带质粒的复制子类型。使用ResFinder(https://cge.cbs.dtu.dk/services/ResFinder/)[17]预测菌株染色体基因组及质粒中的获得性耐药基因。VirulenceFinder(https://cge.cbs.dtu.dk/services/VirulenceFinder/)用于鉴定菌株染色体基因组及质粒中携带的毒力因子[18]。oriTfinder(http://202.120.12.134/oriTfinder/oriTfinder.html)用于预测菌株质粒基因组中的水平转移元件[19]。
1.7 S1-PFGE
根据S1-PFGE的标准实验方法[20],将ECCNB12-2菌株包埋于琼脂糖凝胶中,使用S1酶进行酶切,使用XbaⅠ酶酶切沙门氏菌H9812作为marker,电泳参数设置为2.16~63.8 s,电泳时间为16 h。电泳后胶块经EB染色,脱色后使用凝胶成像仪观察电泳结果。
2 结果与分析
2.1 药敏结果
细菌耐药表型鉴定结果如表1显示,ECCNB12-2表现对氨苄西林、庆大霉素、大观霉素、四环素、氟苯尼考、磺胺异恶唑、复方新诺明、头孢噻夫、恩诺沙星、氧氟沙星这10种抗生素耐药,仅对奥格门丁、头孢他啶、美罗培南及粘杆菌素敏感。
2.2 基因组分析结果
大肠埃希菌ECCNB12-2的全基因组序列全长5 539 489 bp,GC含量为50.37%,编码5 742个蛋白,平均覆盖深度为122.0×,包含8个5S rRNA、7个16S rRNA、7个23S rRNA和93个tRNA。此外,ECCNB12-2菌株携带有4个质粒。pTB-nb1质粒的大小为147 451 bp,复制子类型为p0111,GC含量为51.38%;pTB-nb2质粒的大小为139 752 bp,复制子类型为IncB/O/K/Z,GC含量为51.62%;pTB-nb3质粒的大小为82 252 bp,复制子类型为IncFⅡ,GC含量为51.44%;pTB-nb4质粒的大小为253 793 bp,复制子类型为IncHI2,GC含量为46.80%。S1-PFGE的结果与全基因组测序结果相符合(图1)。
2.3 获得性耐药基因预测
使用ResFinder工具预测ECCNB12-2菌株中可能存在的获得性耐药基因。如表2所示,在ECCNB12-2的基因组序列中共检测到40个获得性耐药基因。其中,6个耐药基因位于染色体基因组上,13个耐药基因位于pTB-nb1质粒上,21个耐药基因位于pTB-nb4质粒上,pTB-nb2和pTB-nb3质粒上未检测到耐药基因。
表1 ECCNB12-2菌株药敏试验结果
Table 1 Antibiotic resistance phenotypes of ECCNB12-2

抗生素名称Antibiotic最小抑菌浓度MIC/(μg·mL-1)抗生素折点标准Breakpoint standard of antibiotic/(μg·mL-1)SIR耐药结果Antibiotic resistanceresult (R/I/S)氨苄西林Ampicillin512≤816≥32R奥格门丁Augmentin8/4≤8/416/8≥32/16S庆大霉素Gentamicin128≤48≥16R大观霉素Spectinomycin>512≤3264≥128R四环素Tetracycline64≤48≥16R氟苯尼考 Florfenicol256≤48≥16R磺胺异恶唑 Sulfisoxazole512≤256≥512R复方新诺明Compound sulfamethoxazole>32/608≤2/38≥4/76R头孢噻呋Ceftiofur>256≤24≥8R头孢他啶Ceftazidime1≤48≥16S恩诺沙星Enrofloxacin>32≤0.250.5~1≥2R氧氟沙星Ofloxacin64≤24≥8R美罗培南Meropenem≤0.03≤12≥4S安普霉素Apramycin16————粘杆菌素Colistin0.25≤24≥8S乙酰甲喹Maquindox32————
S,I,R分别表示敏感、中介、耐药。
S, I, R represented susceptible, intermediate, resistant, respectively.
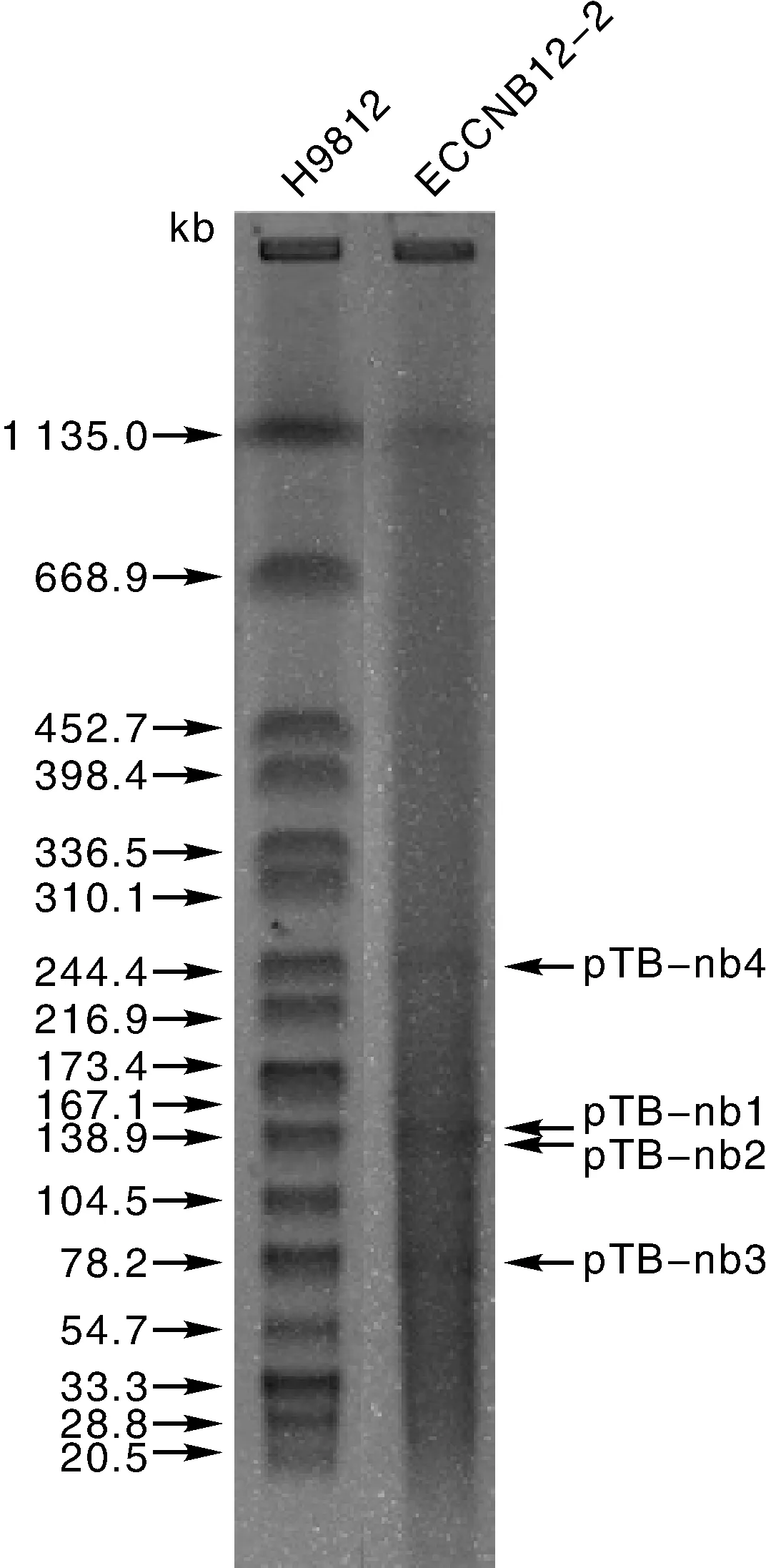
图1 ECCNB12-2菌株S1-PFGE电泳结果Fig.1 S1-PFGE result of ECCNB12-2
2.4 毒力因子预测
研究使用VirulenceFinder工具分析ECCNB12-2基因组序列中可能存在的毒力因子。如表3所示,ECCNB12-2基因组共有12个毒力因子被检出,其中9个存在于染色体基因组中,2个存在于pTB-nb2质粒上,1个位于pTB-nb3质粒上,pTB-nb1及pTB-nb4质粒无毒力因子检出。结果表明,ECCNB12-2菌株中含有多种毒力因子存在,具有对机体造成多种毒力作用的潜力。
2.5 水平转移元件
使用oriTfinder工具,预测了ECCNB12-2菌株的4个质粒的水平转移元件,包括转移区起点(oriT),松弛酶,细菌Ⅳ型分泌系统基因簇(T4SS)和Ⅳ型偶联蛋白(T4CP)基因。结果发现,pTB-nb1质粒仅含有oriT位点,缺乏松弛酶,T4CP和T4SS;质粒pTB-nb2含有oriT位点、松弛酶及T4SS,但缺乏T4CP;质粒pTB-nb3含有oriT位点、T4CP与T4SS,但缺乏松弛酶,表明质粒pTB-nb1、质粒pTB-nb2及质粒pTB-nb3具有被诱动转移的潜力[21]。预测结果发现,pTB-nb4质粒具有完整的包含oriT位点、松弛酶,T4CP和T4SS的水平转移元件,反映了质粒pTB-nb4高度的可自主转移潜力[21]。
表2 ECCNB12-2菌株获得性耐药基因预测结果
Table 2 Acquired antimicrobial resistance genes prediction results of ECCNB12-2
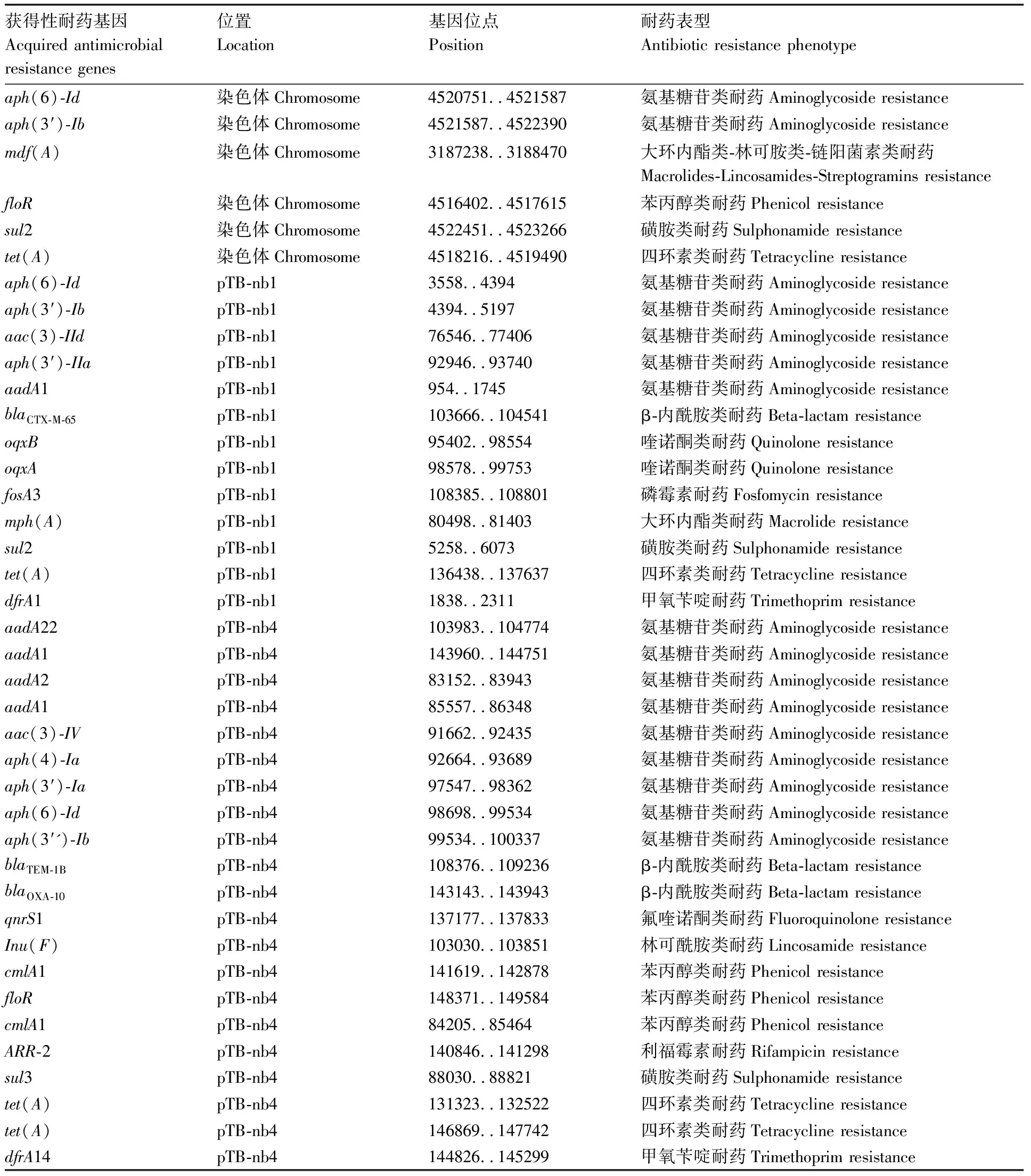
获得性耐药基因Acquired antimicrobialresistance genes位置Location基因位点Position耐药表型Antibiotic resistance phenotypeaph(6)-Id染色体Chromosome4520751..4521587氨基糖苷类耐药Aminoglycoside resistanceaph(3′)-Ib染色体Chromosome4521587..4522390氨基糖苷类耐药Aminoglycoside resistancemdf(A)染色体Chromosome3187238..3188470大环内酯类-林可胺类-链阳菌素类耐药Macrolides-Lincosamides-Streptogramins resistancefloR染色体Chromosome4516402..4517615苯丙醇类耐药Phenicol resistancesul2染色体Chromosome4522451..4523266磺胺类耐药Sulphonamide resistancetet(A)染色体Chromosome4518216..4519490四环素类耐药Tetracycline resistanceaph(6)-IdpTB-nb13558..4394氨基糖苷类耐药Aminoglycoside resistanceaph(3′)-IbpTB-nb14394..5197氨基糖苷类耐药Aminoglycoside resistanceaac(3)-IIdpTB-nb176546..77406氨基糖苷类耐药Aminoglycoside resistanceaph(3′)-IIapTB-nb192946..93740氨基糖苷类耐药Aminoglycoside resistanceaadA1pTB-nb1954..1745氨基糖苷类耐药Aminoglycoside resistanceblaCTX-M-65pTB-nb1103666..104541β-内酰胺类耐药Beta-lactam resistanceoqxBpTB-nb195402..98554喹诺酮类耐药Quinolone resistanceoqxApTB-nb198578..99753喹诺酮类耐药Quinolone resistancefosA3pTB-nb1108385..108801磷霉素耐药Fosfomycin resistancemph(A)pTB-nb180498..81403大环内酯类耐药Macrolide resistancesul2pTB-nb15258..6073磺胺类耐药Sulphonamide resistancetet(A)pTB-nb1136438..137637四环素类耐药Tetracycline resistancedfrA1pTB-nb11838..2311甲氧苄啶耐药Trimethoprim resistanceaadA22pTB-nb4103983..104774氨基糖苷类耐药Aminoglycoside resistanceaadA1pTB-nb4143960..144751氨基糖苷类耐药Aminoglycoside resistanceaadA2pTB-nb483152..83943氨基糖苷类耐药Aminoglycoside resistanceaadA1pTB-nb485557..86348氨基糖苷类耐药Aminoglycoside resistanceaac(3)-IVpTB-nb491662..92435氨基糖苷类耐药Aminoglycoside resistanceaph(4)-IapTB-nb492664..93689氨基糖苷类耐药Aminoglycoside resistanceaph(3′)-IapTB-nb497547..98362氨基糖苷类耐药Aminoglycoside resistanceaph(6)-IdpTB-nb498698..99534氨基糖苷类耐药Aminoglycoside resistanceaph(3′')-IbpTB-nb499534..100337氨基糖苷类耐药Aminoglycoside resistanceblaTEM-1BpTB-nb4108376..109236β-内酰胺类耐药Beta-lactam resistanceblaOXA-10pTB-nb4143143..143943β-内酰胺类耐药Beta-lactam resistanceqnrS1pTB-nb4137177..137833氟喹诺酮类耐药Fluoroquinolone resistanceInu(F)pTB-nb4103030..103851林可酰胺类耐药Lincosamide resistancecmlA1pTB-nb4141619..142878苯丙醇类耐药Phenicol resistancefloRpTB-nb4148371..149584苯丙醇类耐药Phenicol resistancecmlA1pTB-nb484205..85464苯丙醇类耐药Phenicol resistanceARR-2pTB-nb4140846..141298利福霉素耐药Rifampicin resistancesul3pTB-nb488030..88821磺胺类耐药Sulphonamide resistancetet(A)pTB-nb4131323..132522四环素类耐药Tetracycline resistancetet(A)pTB-nb4146869..147742四环素类耐药Tetracycline resistancedfrA14pTB-nb4144826..145299甲氧苄啶耐药Trimethoprim resistance
3 讨论
细菌耐药性问题是目前存在的非常严重的公共安全问题,已经不断有从临床、食品和环境中分离到多重耐药大肠埃希菌的报道。本研究从宁波市市售鸡肉样品中分离到一株大肠埃希菌,药敏结果显示,其对氨苄西林、庆大霉素、大观霉素、四环素、氟苯尼考、磺胺异恶唑、复方新诺明、头孢噻夫、恩诺沙星、氧氟沙星这10种药物耐药,确定其为一株具有较强危害性的多重耐药大肠埃希菌。
表3 ECCNB12-2菌株毒力因子预测结果
Table 3 Virulence factors prediction results of ECCNB12-2

毒力因子Virulence factor位置Location基因位点Position蛋白功能Protein functionair染色体Chromosome5140659..5149460肠聚集性免疫球蛋白重复蛋白Enteroaggregative immunoglobulin repeat proteinastA染色体Chromosome5210002..5210118EAST-1热稳定毒素EAST-1 heat-stable toxinastA染色体Chromosome4255711..4255827EAST-1热稳定毒素EAST-1 heat-stable toxineilA染色体Chromosome5149512..5151209门氏菌同系物Salmonella HilA homologgad染色体Chromosome2289917..2291317谷氨酸脱羧酶Glutamate decarboxylasegad染色体Chromosome5433270..5434670谷氨酸脱羧酶Glutamate decarboxylaseiha染色体Chromosome2580237..2582324粘附蛋白Adherence proteiniss染色体Chromosome2794043..2794351提高血清存活率Increased serum survivallpfA染色体Chromosome5062316..5062888长极性菌毛Long polar fimbriaeastApTB-nb269664..69780EAST-1热稳定毒素EAST-1 heat-stable toxinastApTB-nb260775..60891EAST-1热稳定毒素EAST-1 heat-stable toxinastApTB-nb322596..22712EAST-1热稳定毒素EAST-1 heat-stable toxin
鸡肉是多重耐药菌株的重要载体。只帅等[22]研究表明,鸡肉源大肠埃希菌中,多重耐药大肠埃希菌的分离率高达92.1%,高于猪肉源的75.3%,羊肉源的67.8%以及牛肉源的52.2%。同时,鸡肉源高风险多重耐药菌株的占比相较其他肉类也较大,11重及以上耐药菌株全部来自于鸡肉样品。本研究的实验结果进一步证实了鸡肉食品中细菌耐药问题的严重性,相关结果将为鸡肉食品的安全评估提供参考数据。
获得性耐药基因预测结果显示,ECCNB12-2菌株携带的获得性耐药基因高达40个,与药敏实验得到的ECCNB12-2菌株的耐药表型具有一定对应性,例如aph(6)-Id、aph(3′')-Ib、aac(3)-IId等多个可导致氨基糖苷类耐药表型的耐药基因的存在可能是介导菌株表现对庆大霉素和大观霉素耐药的主要原因;sul2、sul3等耐药基因的存在可能是导致菌株表现磺胺异恶唑耐药表型的主要原因。此外,获得性耐药基因预测结果显示ECCNB12-2可能具有除监测抗生素之外的耐药表型,例如菌株携带的ARR-2耐药基因的表达可能导致对利福霉素的耐药性、fosA3耐药基因可能导致菌株表现磷霉素耐药表型。这些结果表明,ECCNB12-2菌株可能具有更广谱的耐药表型存在,表明了鸡肉样品中细菌耐药问题的严重性。
ECCNB12-2菌株携带有多个高风险的耐药基因例如blaCTX-M-65、blaTEM-1B。blaCTX-M-65与blaTEM-1B基因会导致菌株获得超广谱β-内酰胺类耐药表型。近年来,超广谱β-内酰胺类耐药问题十分严重,已呈全球流行趋势[23-24]。本实验的研究对象ECCNB12-2菌株同时携带有两个导致超广谱β-内酰胺类耐药表型的耐药基因,可能加重该耐药表型的严重性。
菌株质粒的水平转移元件预测结果显示,所有质粒都具有转移至其他菌株的能力,其中pTB-nb4质粒携带有完整的水平转移元件,具有高度的自主转移潜力。同时获得性耐药基因预测结果表明pTB-nb1质粒和pTB-nb4质粒是耐药基因的主要携带质粒,特别是属于IncHI2类型的pTB-nb4质粒,共携带有21个耐药基因。IncHI2型质粒是主要的流行性质粒之一,在肠杆菌科中非常常见,具有较高的接合转移效率。同时相关研究报道IncHI2型质粒与多重耐药表型具有一定的相关关系,也是携带blaNDM-1、mcr-1等高风险耐药基因的主要质粒类型之一[25-27]。因此,pTB-nb4质粒携带的耐药基因具有随着pTB-nb4质粒的接合转移而发生广泛水平传播的潜力,并可能同时随着鸡肉的产业链发生广泛垂直传播,严重危害公共卫生健康。
病原性大肠埃希菌会通过毒力因子作用引起局部或全身感染性疾病,对畜禽养殖及人类健康带来了严重的危害,造成了极大的经济损失[28]。毒力因子预测结果表明,ECCNB12-2菌株携带有多个毒力因子,说明该菌株具有潜在的毒力能力。例如,ECCNB12-2菌株携带的iss毒力因子被证明与大肠埃希菌的毒力密切相关,iss基因可以增强大肠埃希菌的血清抵抗力,使菌株在宿主体内迅速增殖[29]。同时,ECCNB12-2菌株自身的多重耐药性增加了其本身对不利环境的耐受性。因此,ECCNB12-2菌株具有较高的传播风险性。

