双孢蘑菇内参基因的筛选与矫正
赵建霞,沈颖越,冯伟林,金群力,宋婷婷,范丽军,蔡为明,*
(1.浙江省农业科学院 园艺研究所,浙江 杭州 310021; 2.浙江师范大学 化学与生命科学学院,浙江 金华 321004)
实时荧光定量PCR (real-time quantitative PCR,RT-qPCR)是在传统聚合酶链式反应基础上发展起来的一项新核酸定量技术,目前已广泛应用于分子诊断学、农学、微生物、医学等众多研究领域[1-3]。尽管RT-qPCR是一种强有力的工具,但是RT-qPCR数据处理和分析结果往往会受到不同变量的影响,与目标基因特异性表达的真实值存在一定的误差,这些变量包括起始材料、RNA质量(纯度、完整性、DNA的污染)、反转录效率、扩增效率和内参基因等[4]。在基因表达分析中,通常利用在多个差异样本中稳定表达的内参基因对测试基因表达量进行校正和标准化[5],从而控制样品内部或样品间不必要的误差[6]。在不同细胞组织、发育阶段或试验条件下,个别传统内参基因表达水平是不稳定的[7]。因此,在使用RT-qPCR进行基因表达分析时,内参基因的选择不仅需要多个基因共同参与,且应根据特定的试验材料、试验条件进行选择。
双孢蘑菇是世界上人工栽培最广泛、产量最高、消费量最大的食用菌,具有重要的经济价值[8]。中国自20世纪30年代引入栽培双孢蘑菇以来,已在全国各地推广种植,种植面积较大的有福建、山东、河南、浙江等省[9]。随着双孢蘑菇基因组测序结果的公布,越来越多研究关注双孢蘑菇的功能基因,因此功能基因的表达分析也变得越来越重要,然而基因的表达分析与内参基因的选择密切相关。目前。双孢蘑菇内参基因的筛选研究却未见相关报道。在其他农作物与食用菌物种的基因表达研究中,核糖体RNA基因(18s)[10]、核糖体蛋白基因(RPL14)[11]、肌动蛋白基因(actin)[12]、转录延伸因子(EF1)[13]、磷酸甘油醛脱氢酶基因(GADPH)[14]、泛素基因(ubiquitin)[15]、真核翻译起始因子(Eif5)[16]、核糖体RNA基因(40s)等常被用作内参基因,且大部分研究以单个基因作为内参基因,但单个基因大的表达稳定性有限且更易受到不确定性因素影响。本研究目标是在双孢蘑菇的5个不同发育时期、3个不同组织结构、4个不同温度处理的特定试验背景下进行最佳RT-qPCR内参基因的选择。通过RT-qPCR反应获取以上8个候选内参基因的Ct值,并综合使用geNorm[17]、NormFinder[18]软件和ΔCt[19]法评估单个基因及其双基因组合和3基因组合在不同试验组别中的表达稳定性。由于它们的分析原理和侧重点不同,分析结果往往存在差异,本研究对3种分析方法所得结果进行综合排序,以期减少分析误差,不仅弥补了目前双孢蘑菇内参基因缺乏的不足,也克服了不同分析方法导致的分析误差,同时采用组合基因的方法有效提高了最佳内参基因的稳定性,为双孢蘑菇相关基因差异表达分析的研究提供参考。
1 材料与方法
1.1 供试菌株、培养基和试剂
双孢蘑菇菌株为英秀一号。
固体培养基(1 L):PDA培养基中加入20 g发酵稻草、20 g麦粉浸汁。
液体培养基:食药用菌-液体菌种培养基,购自雅康生物科技。
原种培养基:98%麦粒,1%石灰,0.5%酵母粉,0.3%蛋白胨,0.1% KH2PO4,0.1% MgSO4。
栽培种培养料:50%蔗渣,30%棉籽壳,18%麸皮,0.5%酵母粉,0.3%磷酸二氢钾,0.1%轻质碳酸钙,0.1%硫酸镁,pH 8。
主要试剂有RNeasy Plant Mini Kit(Qiagen)、RNase-Free DNase Set(Qiagen)、SuperScriptTMIII First-Strand Synthesis SuperMix for qRT-PCR(Invitrogen)、Power SYBR® Green PCR Master Mix(Applied Biosystems)。
仪器有高速冷冻离心机(Sigma),紫外分光光度计(Beckman),恒温金属浴(国产),CFX384多重实时荧光定量PCR仪(美国Bio-Rad)。
1.2 试验方法
不同发育时期样品:在双孢蘑菇的菌丝期(麦粒种)、菇蕾期、幼菇期、小菇期、采摘期进行整菇取样,如图1,每个时期3个生物学重复。不同组织样品:对采摘期菌盖、菌柄、菌褶进行取样,各3个生物学重复。不同温度处理样品:将双孢蘑菇菌丝接种至液体培养基,25 ℃培养10 d,分别放置5、15、25、30 ℃静置12 h后对菌丝进行取样。每个温度进行3个生物学重复。

自左至右依次为菇蕾期、幼菇期、小菇期、采摘期。From left to right were mushroom bud stage, young mushroom stage, small mushroom stage and picking stage, respectively.图1 双孢蘑菇子实体不同发育时期Fig.1 The different developmental stages of Agaricus bisporus
1.3 总RNA提取与质量检测
所有样品的总RNA按照Qiagen试剂盒说明书要求进行提取,所获得的总RNA经过DNA酶处理,去除DNA污染。利用紫外分光光度计(Beckman)测定总RNA的浓度、纯度,通过琼脂糖凝胶检验RNA完整性。
1.4 内参基因引物设计与cDNA第一链的合成
所有候选内参基因序列来自GJIAgaricusBisporusH97基因组序列[20]。利用Primer5.0软件设计引物,由上海擎科生物科技有限公司合成,引物序列如表1所示。预计所有扩增片段长度在103~160 bp,引物退火温度在55.7~57.6 ℃。反转录cDNA采用快速反转录试剂盒(Invitrogen),具体操作依据试剂盒说明,将RNA反转录为cDNA,-20 ℃保存备用。
1.5 荧光定量PCR反应条件
RT-qPCR反应按照Power SYBR® Green PCR Master Mix试剂说明书进行。RT-qPCR反应在CFX384型多重实时荧光定量PCR仪(Bio-Rad)上运行,扩增体系20 μL: Power SYBR® Green Master Mix 10 μL,上下游引物各0.5 μL,cDNA模板(≈10 ng)1 μL,ddH2O 8 μL。反应程序为:95 ℃ 1 min;95 ℃ 15 s,63 ℃ 25 s,40个循环;从55 ℃到95 ℃,每个循环增加0.5 ℃,持续0.05 s获得解链温度,采集融解曲线荧光信号。
1.6 候选内参基因的扩增效率与特异性
将反转录的cDNA混合样品用ddH2O以10倍浓度梯度稀释4个梯度(1,1∶10,1∶100,1∶1 000),以此为模板进行RT-qPCR扩增后制作内参基因的标准曲线[21-22]。每个样品3个重复,统计其循环阈值(Ct值)。以cDNA稀释浓度为横坐标,Ct值为纵坐标,经对数拟合做标准曲线,计算各内参基因的回归系数,依据计算公式E=10-1/slope-1计算扩增效率(E为扩增效率,slope为回归直线斜率)。RT-qPCR反应产物在4%琼脂糖凝胶中电泳,检测鉴定内参基因引物特异性。
1.7 管家基因表达水平及其稳定性
有4种算法广泛应用于qRT-PCR数据分析:geNorm、NormFinder、BestKeeper[4]、ΔCt法。因为BestKeeper程序最多只能比较10个内参基因的表达水平,本研究中除8个候选单基因外,还有双基因组合及三基因组合,共92个候选内参基因需要比较计算,因此该方法此处不适用。本研究将5个不同发育时期、3个不同组织、4个不同温度处理菌丝的cDNA作为模板,对8个候选内参基因进行RT-qPCR定量分析,每个生物学重复的样本进行3次技术重复,获取8个候选内参基因的Ct值。由于Ct值是指数型数据,此处组合基因的Ct值用参与组合的单个基因Ct值的算数平均数表示[23]。然后对单基因、双基因组合和3基因组合的Ct值运用Genorm、Norm Finder软件和△Ct法进行分析。
表1 八个候选内参基因RT-qPCR引物
Table 1 RT-qPCR primers for eight candidate internal reference genes

基因Gene联合基因组研究所编码Joint Genome Institute Identity引物序列(5’-3’)Primer sequence (5’-3’)产物长度Product length/bp40s191562GCATCCGTTCTGGAGGTGAGGGACTGGCGCATACAACATTTAC15918s186957CGTGCGGTTCTATTTTGTTGGTTTCGCTTTCGCAGTAGTCGGTCTTG126actin148219GCAGGTTATGATGCTCGTGTTAGCATGAGTGCCTCTTGTTCTATTCG150EF1189244GGCAGGGATTGATGGACTTTGAGTTGGAACGCCCGCTTAATTTCTT160GAPDH192199GAGCAAGGAAATTAGCAAGAGTAGCGACGACGATATGGTCAGGGTGTT133ubiquitin133168GATCTTTGCTGGCAAACAACTCGACATACCACCACGCAGACGGA103RPL14189164CCCCTACAAACACCTTCTTCTCACCTCCGCTTCTCCTTCATCAC3160Eif5191428CTCTATTCACTGACGAAGCTACCACGAGACGCTCCAAACCACCA114
2 结果与分析
2.1 RNA质量检测
用于实时荧光定量分析的RNA质量是非常重要的影响因素[5]。本研究提取的RNAD260/D280均在1.91~2.0,RNA浓度为121~156 ng·μL-1,RNA电泳图如图2。
2.2 候选内参基因引物扩增效率与特异性
以4个稀释梯度的混合cDNA为模板进行RT-qPCR扩增,得到候选内参基因的扩增曲线和标准曲线,结果表明,各内参基因的熔解曲线有明显的单一信号峰,重复样品间扩增曲线重复性高,且不加模板的阴性对照检测不到荧光信号,说明RT-qPCR反应具有较高的专一性。RT-qPCR结果(表2)显示各内参基因的线性关系决定系数R2≥0.990,引物的扩增效率为85.6%~105.7%,符合RT-qPCR对扩增效率的要求。8个候选内参基因的引物均可以扩增出单一且与目的片段大小一致的条带,没有出现引物二聚体和非特异性扩增(图3)。

1,双孢蘑菇的菌丝期(麦粒种);2,菇蕾期;3,幼菇期;4,小菇期;5,采摘期;6,采摘期菌盖;7,采摘期菌柄;8,采摘期菌褶;9,5 ℃处理12 h的菌丝;10,15 ℃处理12 h的菌丝;11,25 ℃处理12 h的菌丝;12,30 ℃处理12 h的菌丝。1, Agaricus bisporus mycelium period (wheat); 2, Mushroom bud stage; 3, Mushroom young stage; 4, Mushroom small stage; 5, Harvest stage; 6, Harvest pileus; 7, Harvest lid; 8, Harvest gills; 9, 5 ℃ treatment 12 h of hyphae; 10, 15 ℃ treatment 12 h of hyphae; 11, 25 ℃ treatment 12 h of hyphae; 12, 30 ℃ treatment 12 h of hyphae.图2 RNA完整性检测电泳图Fig.2 RNA integrity detection
2.3 Ct值比较
基因表达丰度越高,Ct值越小,反之,Ct值越大。8个候选内参基因的Ct值比较表明,在不同发育时期、不同组织、不同温度处理的各个样品中,每个内参基因的表达水平都有一定的变化,且表达丰度变化呈现相近趋势。18s表达丰度最高,Eif5表达丰度最低,40s、GAPDH、EF1、RPL14、ubiquitin、actin的Ct值居中(图4)。
2.4 qRT-PCR数据分析
2.4.1 geNorm软件分析
本研究中使用的geNorm是免费的Excel加载项,根据计算出的候选内参基因在不同样品中的平均变异值M(average pairwise variation)来确定最稳定的内参基因,M值越大,表明稳定性越低;M值越小,稳定性越高,M=1.5是上限。计算组合基因时,以组合基因的几何平均值计算候选基因的表达稳定性因子(M值)。结果(表3)表明:不同发育阶段最适内参基因组合为40s+GAPDH;不同组织组中最适内参基因组合为40s+actin+ubiquitin,最适的双内参基因组合为actin+RPL14,排名第5位;不同温度处理中最适内参基因组合为EF1+ubiquitin+PL14,最适的双内参基因组合为EF1+ubiquitin。
2.4.2 Norm Finder软件分析
表2 RT-qPCR分析中8个内参基因相关参数
Table 2 Parameters of eight reference genes derived from RT-qPCR analysis

基因名称Gene name斜率Slope决定系数R2Correlation扩增效率PCR efficiency/%40s-3.1920.996105.718s-3.5080.99792.8actin-3.4090.99096.5EF1-3.2860.990101.5GAPDH-3.7210.98985.7ubiquitin-3.3940.98787.6RPL14-3.7250.99885.6Eif5-3.6460.99788.1

M, DNA marker 2 000.图3 八个候选内参基因的RT-qPCR产物Fig.3 RT-qPCR products of eight candidate internal reference genes

图4 八个候选基因在不同处理双孢蘑菇样品中平均Ct值比较Fig.4 Average Ct values of eight candidate genes of Agaricus bisporus samples in different treatments
表3 双孢蘑菇候选内参基因及其组合的表达稳定性(Genorm软件)
Table 3 Expression stability of candidate reference genes ofAgaricusbisporusand their combinations(Genorm software)
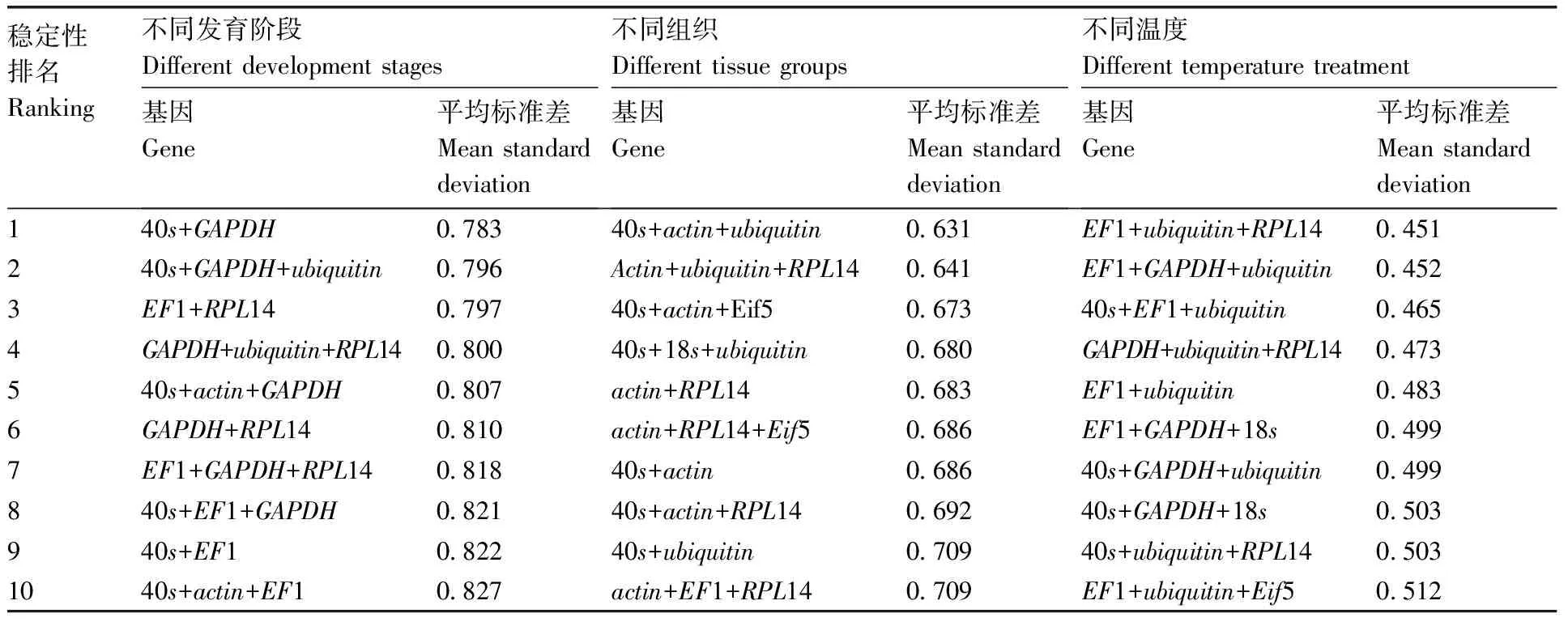
稳定性排名Ranking不同发育阶段Different development stages基因Gene平均标准差Mean standarddeviation不同组织Different tissue groups基因Gene平均标准差Mean standarddeviation不同温度Different temperature treatment基因Gene平均标准差Mean standarddeviation140s+GAPDH0.78340s+actin+ubiquitin0.631EF1+ubiquitin+RPL140.451240s+GAPDH+ubiquitin0.796Actin+ubiquitin+RPL140.641EF1+GAPDH+ubiquitin0.4523EF1+RPL140.79740s+actin+Eif50.67340s+EF1+ubiquitin0.4654GAPDH+ubiquitin+RPL140.80040s+18s+ubiquitin0.680GAPDH+ubiquitin+RPL140.473540s+actin+GAPDH0.807actin+RPL140.683EF1+ubiquitin0.4836GAPDH+RPL140.810actin+RPL14+Eif50.686EF1+GAPDH+18s0.4997EF1+GAPDH+RPL140.81840s+actin0.68640s+GAPDH+ubiquitin0.499840s+EF1+GAPDH0.82140s+actin+RPL140.69240s+GAPDH+18s0.503940s+EF10.82240s+ubiquitin0.70940s+ubiquitin+RPL140.5031040s+actin+EF10.827actin+EF1+RPL140.709EF1+ubiquitin+Eif50.512
Norm Finder是基于Excel的VBA(visual basic for applications)程序,可以在一组候选者中鉴定最佳内参基因,该算法根据候选内参基因的稳定值大小来筛选出最合适的内参基因,它不仅能评估候选参考基因在总体样本集中的表达稳定性,还能评估候选参考基因在样本集亚组之间的差异。表4显示,不同发育时期Eif5+18s的基因组合表达最稳定,不同组织中RPL14+Eif5+EF1的基因组合表达最稳定,其中表达最稳定的双基因组合为actin+RPL14。不同温度处理中40s+18s+GAPDH表达最稳定。
2.4.3 ΔCt法分析
相对表达稳定性算法为:首先获得每个候选基因与剩余所有单个候选基因所对应的Ct值的差值(ΔCt值),再计算每个组合中ΔCt值的标准差(StdDevΔCt值),最终得到平均SDΔCt值标准差(Mean StdDevΔCt值),以Mean StdDevΔCt值对每个候选基因进行排序,Mean StdDevΔCt值最小的基因为最稳定的内参基因。利用ΔCt法比较所有样品中单个候选内参基因与所有剩余单个候选内参基因间的相对表达稳定性,来评估最稳定的参考基因。ΔCt法分析结果如表5所示,不同发育时期中40s+actin+EF1的基因组合表达最稳定,其中表达最稳定的双基因组合为40s+EF1。不同组织中40s+actin+Eif5组合表达最稳定,其中表达最稳定的双基因组合为actin+RPL14。不同温度处理中EF1+ubiquitin+RPL14组合表达最稳定。
表4 双孢蘑菇候选内参基因及其组合的表达稳定性(Norm Finder软件)
Table 4 Expression stability of candidate reference genes ofAgaricusbisporusand their combinations(Norm Finder software)
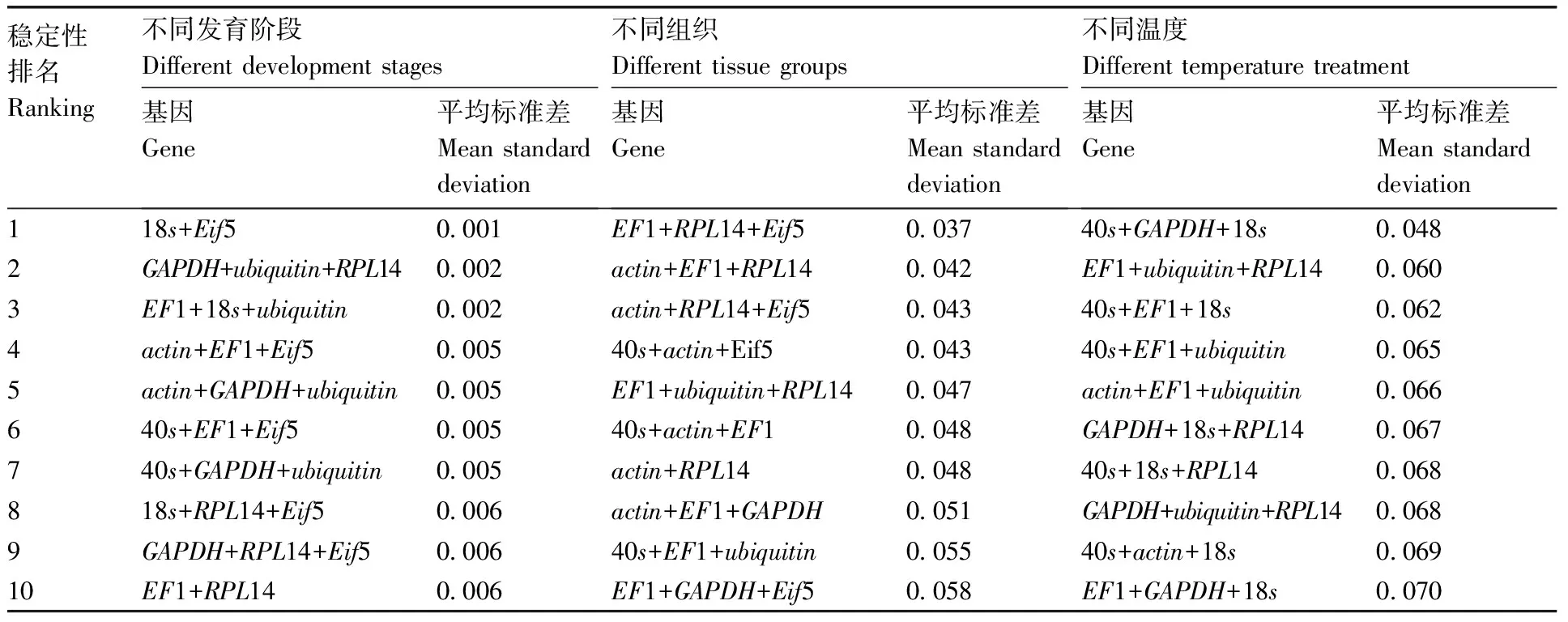
稳定性排名Ranking不同发育阶段Different development stages基因Gene平均标准差Mean standarddeviation不同组织Different tissue groups基因Gene平均标准差Mean standarddeviation不同温度Different temperature treatment基因Gene平均标准差Mean standarddeviation118s+Eif50.001EF1+RPL14+Eif50.03740s+GAPDH+18s0.0482GAPDH+ubiquitin+RPL140.002actin+EF1+RPL140.042EF1+ubiquitin+RPL140.0603EF1+18s+ubiquitin0.002actin+RPL14+Eif50.04340s+EF1+18s0.0624actin+EF1+Eif50.00540s+actin+Eif50.04340s+EF1+ubiquitin0.0655actin+GAPDH+ubiquitin0.005EF1+ubiquitin+RPL140.047actin+EF1+ubiquitin0.066640s+EF1+Eif50.00540s+actin+EF10.048GAPDH+18s+RPL140.067740s+GAPDH+ubiquitin0.005actin+RPL140.04840s+18s+RPL140.068818s+RPL14+Eif50.006actin+EF1+GAPDH0.051GAPDH+ubiquitin+RPL140.0689GAPDH+RPL14+Eif50.00640s+EF1+ubiquitin0.05540s+actin+18s0.06910EF1+RPL140.006EF1+GAPDH+Eif50.058EF1+GAPDH+18s0.070
表5 双孢蘑菇候选内参基因及其组合的表达稳定性(ΔCt法)
Table 5 Expression stability of candidate reference genes ofAgaricusbisporusand their combinations(ΔCt method)

稳定性排名Ranking不同发育阶段Different development stages基因Gene平均标准差Mean standarddeviation不同组织Different tissue groups基因Gene平均标准差Mean standarddeviation不同温度Different temperature treatment基因Gene平均标准差Mean standarddeviation140s+actin+EF10.49940s+actin+Eif50.451EF1+ubiquitin+RPL140.313240s+EF1+ubiquitin0.503actin+EF1+RPL140.45440s+GAPDH+Eif5s0.314340s+GAPDH+ubiquitin0.510actin+RPL14+Eif50.46140s+EF1+ubiquitin0.3184EF1+ubiquitin+RPL140.51140s+actin+EF10.46440s+ubiquitin+RPL140.324540s+EF10.52040s+actin+ubiquitin0.471actin+RPL14+Eif50.3246EF1+RPL140.528actin+RPL140.47340s+actin+Eif50.3267actin+EF1+RPL140.530EF1+GAPDH+Eif50.474GAPDH+18s+RPL140.328840s+actin+GAPDH0.53440s+18s+ubiquitin0.48040s+actin+ubiquitin0.330940s+EF1+GAPDH0.53540s+actin0.481actin+EF1+ubiquitin0.33110GAPDH+ubiquitin+RPL140.535actin+ubiquitin+RPL140.48340s+18s+RPL140.331
2.4.4 综合排名
由于以上3种内参基因的评定方法与原理存在一定差异,得出3种相似但不同的排序结果,对3种计算结果排名的几何平均数进行综合排名[15,24],综合排序前10名的如表6、表7、表8。不同发育时期EF1+actin+40s的三基因组合表达最稳定;不同组织中以Eif5+actin+40s的三基因组合表达最稳定,其中表达最稳定的双基因组合为actin+RPL14;不同温度处理组以EF1+ubiquitin+RPL14的三基因组合表达最稳定。
表6 不同发育时期最适内参基因前10名
Table 6 The top ten most suitable genes for internal reference at different developmental stages

不同发育阶段Different development stagesGenorm结果排名Rank by GenormNorm Finder结果排名Rank by Norm FinderΔCt法结果排名Rank by ΔCt method3种排序的几何平均数Geometric average ofthe three rangking综合排名Overallranking40s+actin+EF110112.154435140s+GAPDH+ubiquitin21334.272659240s+actin+GAPDH5284.308869340s+EF1+ubiquitin19926.993191440s+EF1+GAPDH8797.958114540s+GAPDH159149.382675640s+actin+Eif51561210.259867EF1+RPL14373610.95297840s+actin+ubiquitin3141311.725249GAPDH+ubiquitin+RPL144501012.5992110
表7 不同组织最适内参基因前10名
Table 7 The top ten of the most suitable internal reference genes in different tissues

不同组织Different tissueGenorm结果排名Rank by GenormNorm Finder结果排名Rank by Norm FinderΔCt法结果排名Rank by ΔCt method3种排序的几何平均数Geometric average ofthe three rangking综合排名Overallranking40s+actin+Eif54132.2894281actin+EF1+RPL1422103.4199522actin+RPL14+Eif53363.779763340s+actin+ubiquitin11513.8029524actin+RPL147624.379519540s+actin+EF164126.6038546actin+ubiquitin+RPL14151026.694330740s+18s+ubiquitin23849.028715840s+actin14979.5900949EF1+RPL14+Eif5124399.78194610
表8 不同温度处理的菌丝最适内参基因前10名
Table 8 The top ten of the most suitable internal reference genes in mycelia treated with different temperatures

不同温度Different temperature treatmentGenorm结果排名Rank by GenormNorm Finder结果排名Rank by Norm FinderΔCt法结果排名Rank by ΔCt method3种排序的几何平均数Geometric average ofthe three rangking综合排名OverallrankingEF1+ubiquitin+RPL141211.259921140s+GAPDH+18s8122.519842240s+EF1+ubiquitin3433.301927340s+ubiquitin+RPL1491247.5595264GAPDH+18s+RPL1411677.7306145GAPDH+ubiquitin+RPL1448157.829735640s+EF1+18s153117.9104607EF1+ubiquitin214198.1028398actin+EF1+ubiquitin12598.1432539EF1+GAPDH+18s610139.20516410
3 结论与讨论
目前,有关内参基因筛选的研究大多是评估单个基因的表达稳定性[25-27],本研究不仅评估了8个候选内参基因的稳定性,还评估了8个候选基因的全部双基因组合和三基因组合的稳定性。组合基因的Ct值用参与组合的单个基因的几何平均数表示,不同组别中不同评估方法所得研究结果表明,除个别候选基因外,三基因组合的稳定性高于双基因组合,双基因组合稳定性优于单基因,与Pabuayon等[23]的报道一致,同时也证明了选用组合基因作为内参进行RT-qPCR的校正和标准化很有必要。
目前最佳内参基因的评价方法还没有统一,因此,通过3种广泛使用的算法(GeNorm、Norm Finder、ΔCt法)评估候选基因在双孢蘑菇不同发育时期、不同组织、不同温度处理等多个测试组内的稳定性,能有效中和计算误差。这3种算法分别预测了相同组别内候选基因的稳定性排序,但是3种处理候选基因的排序存在一定差异,这可能是由于3种算法的原理不同导致的,也说明了不同算法对研究结果存在干扰与误导。因此,本研究使用3种排序的几何平均数来获得所选内参基因的相对排名,这样可以大大减少由于算法不同导致的计算偏差[28]。
3种算法的综合分析结果表明,双孢蘑菇不同发育时期样本中最佳内参基因组合为40s+actin+EF1,最佳双基因组合为40s+GAPDH;不同组织中最佳内参基因组合为40s+actin+Eif5,最佳双基因的组合为actin+RPL14;不同温度处理菌丝样品中最佳内参基因组合为EF1+ubiquitin+RPL14。所有组合基因(92个组合)中排前10名的多数为三基因组合,最佳基因组合均为三基因组合,但个别双基因组合也名列其中,由于以双基因作为内参基因能节约时间、降低成本,因此位列前10名的双基因组合也是可选组合,可根据试验需求选择合适的组合基因。另外,最佳的组合基因不一定是最佳单基因的简单组合,可能是相对不稳定基因间的互补协作。
本研究结果可为双孢蘑菇不同发育阶段、不同组织器官,以及不同温度处理中相关基因表达分析提供内参基因的筛选提供参考,同时也可为其他食用菌内参基因的筛选提供参考和借鉴。
——记上海志磊食用菌种植专业合作社

