硫酸酯化沙棘叶多糖的制备及其解酒作用
汤威威,张宇,王宇亮,王丽红,王瑞瑶,王伟铧,张凯,赵宏,2,*
(1.佳木斯大学药学院,黑龙江佳木斯154007;2.黑龙江中医药大学中药学教育部重点实验室,黑龙江哈尔滨150040)
沙棘(Hippophae rhamnoides L.)是胡颓子科沙棘属的落叶灌木或小乔木,《中国药典》中记载沙棘具有健脾消食,止咳祛痰,活血散瘀的功效[1]。目前沙棘的应用主要集中在果实,其叶尚未得到有效开发和利用,通过前期对沙棘叶进行初步总结和研究发现,其叶含有丰富的黄酮、多糖等化合物,黄酮类化合物具有抗菌、保肝及调节血脂等作用[2-4],多糖具有抗菌、抗氧化、抗突变等作用[5-7]。
中药多糖具有良好的抗氧化[8]、解酒[9]、保肝[10]等活性,且活性大小取决于其分子结构和其他物理化学性质,包括水溶性,羟基的取代类型和程度等[11]。因此,对多糖进行适当修饰能够改善其分子结构和理化性质,从而增强其原有活性或增加新活性。目前中药多糖的修饰方法主要集中在硫酸酯化[12]、磷酸酯化[13]及硝酸酯化[14]等修饰方法,其中硫酸酯化是目前最重要的中药多糖修饰手段。
急性酒精中毒(俗称醉酒)是指患者大量饮酒后发生的机体损伤的过程[15]。目前临床上用于防治急性酒精中毒的药物,其主要成分为兴奋剂、氨基酸、维生素等,无实际解酒效果或解酒效果不佳。通过前期试验已经证实沙棘叶多糖对急性酒精中毒小鼠具有一定的解酒作用,且对乙醇脱氢酶(alcohol dehydrogenase,ADH)具有一定的激活作用。本研究拟建立可食用酒精对小鼠致急性酒精中毒模型,探究硫酸酯化沙棘叶多糖解酒作用,为沙棘叶的有效利用及沙棘叶产品保健价值的进一步研究提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
清洁级KM小鼠6周龄,体重18 g~22 g,90只,购自哈尔滨医科大学,实验单位使用许可证编号:SYXK(黑)2013-001,饲养于SPF级动物室。
沙棘叶购于佳木斯民生药行,批号170719,经佳木斯大学药学院张宇教授鉴定为胡颓子科植物沙棘的干燥叶,符合2015年版《中国药典》规定,现样品保存于佳木斯大学药学院(编号171604)。
氯磺酸、吡啶、无水N,N-二甲基甲酰胺:上海阿拉丁试剂有限公司;红星牌56度二锅头白酒:北京红星股份有限公司产品;海王金樽:深圳海王药业公司产品;乙醇脱氢酶试剂盒:南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
FA-2004型电子天平:上海舜宇恒平科学仪器有限公司;DF-101S型恒温磁力搅拌器:郑州长城科工贸公司;FDU-1200型冷冻干燥机、WFO-420W定温干燥箱:日本东京理化株式会社;DL-5-B型高速离心机:上海安亭科学仪器厂;765紫外可见分光光度计:上海光谱仪器厂;FTIR-8400S型红外光谱仪:日本岛津公司。
1.3 方法
1.3.1 沙棘叶多糖的制备
沙棘叶粉碎、干燥后,采用石油醚回流脱脂,阴干。取干燥沙棘叶,蒸馏水提取,减压浓缩,加入无水乙醇至上清液浓度为80%,冷藏静置24 h,离心得沉淀,采用活性炭脱色,冷冻干燥即得沙棘叶多糖(seabuckthorn leaf polysaccharide,SLP)。
1.3.2 硫酸酯化沙棘叶多糖(sulfated seabuckthorn leaf polysaccharide,SSLP)的制备
1.3.2.1 SLP硫酸酯化
在附有磁力搅拌装置的干燥三颈瓶中,加入10 mL无水吡啶,置于冰浴中冷却至0℃后,搅拌下缓慢加入3 mL氯磺酸,约1 h滴完,得到淡黄色固体酯化试剂,-20℃冷冻备用[16]。
精密称取SLP 200 mg于20 mL无水N,N-二甲基甲酰胺中,溶解后加入上述酯化试剂中,60℃反应3 h,反应结束冷却至室温(25℃),20%的NaOH调节pH值至中性,加入无水乙醇至上清液浓度为80%,冷藏静置24 h,离心收集沉淀,双蒸水透析72 h,冷冻干燥得SSLP。
1.3.2.2 氯化钡-明胶浊度法测定SSLP取代度
分别移取 1 mg/mL 硫酸钠溶液 0.2、0.4、0.6、0.8、1.0、1.2mL放入洁净试管中,用1 mol/L盐酸补至2 mL,各试管分别加入3.8 mL 3%三氯乙酸和1 mL氯化钡-明胶溶液(氯化钡1%,明胶0.5%),静置20 min。在360 nm下测定反应吸光度值A,绘制硫酸基标准曲线[17]。
精密称取SSLP5mg于10mL容量瓶中,加入1mol/L HCl溶液水解,取水解液2 mL按上述步骤操作测定吸光度,计算硫酸基含量。

式中:S为待测样品硫酸基的含量,%;WS为糖解液吸光度对应下的硫酸基质量,mg;W为所取多糖的质量,mg;DS为待测样品硫酸基取代度。
1.3.2.3 红外光谱分析
称取SLP和SSLP各1 mg分别与KBr混合研磨、压片,以KBr为扫描背景,在4 000 cm-1~500 cm-1范围内扫描检测[18]。
1.3.3 SSLP的解酒作用
1.3.3.1 SSLP和SLP对ADH活性的影响
选取浓度为 0.1、0.5、1.0 mg/mL的 SSLP溶液,采用瓦勒-霍赫(Valle&Hoch)法并稍加改良后检测乙醇脱氢酶活性,各试剂混合后在25℃下,温育5 min。温育后立即加入乙醇脱氢酶0.1 mL,摇匀后用分光光度计测定在340 nm处的吸光度值,以后每隔30 s读数1次,连续测定5 min,记录数据[19]。
根据生成的还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)在340 nm时摩尔消光系数为6.2,计算ADH的活性,ADH的活性以每分钟生成NADH的纳摩尔数(nmol/min)表示,按公式(3)计算 ADH 活性,并按公式(4)计算激活率:

式中:ΔA340nm为平均每分钟的吸光度变化值;6.2为NADH在340 nm处的摩尔消光系数。

1.3.3.2 SSLP对急性酒精中毒小鼠影响
选取健康雄性昆明种小鼠90只,随机分为空白组、模型组、阳性药物组(0.607 g/kg)、SSLP 高(1.214 g/kg)、中(0.607 g/kg)、低(0.303 g/kg)剂量组、SLP 高(1.214 g/kg)、中(0.607 g/kg)、低(0.303 g/kg)剂量组,每组10只,适应性喂养7 d。对SLP及SSLP各组小鼠分别灌胃给予相应药物,空白组及模型组给予等体积的蒸馏水,1次/d,连续14 d,每周称重2次。第14天各组灌胃完成后禁食不禁水12 h,于第15天对SLP及SSLP各组小鼠按照上述剂量进行灌胃,模型组和空白组灌胃等体积蒸馏水。30 min后,各组分别灌胃给予红星二锅头14 mL/kg,空白组给予同体积的蒸馏水[20]。
以小鼠的翻正反射消失为标准,判断小鼠是否处于急性酒精中毒状态,记录小鼠醉酒潜伏时间(即从灌酒到翻正反射消失的时间)及持续醉酒时间(即从翻正反射消失到清醒的时间)[21]。
每组小鼠在灌酒后1 h取血,3 500 r/min,低温离心10 min,分离血清,-20℃冰箱保存,测定并计算血液中ADH的活性,检测步骤严格按照试剂盒说明方法进行。

1.3.4 数据处理
采用SPSS 20.0统计软件,实验数据结果以平均值±标准差(±S)来表示,组间差异比较采用配对样品T检验,用P<0.05表示差异显著,判断组间是否存在着差异性。
2 结果与分析
2.1 硫酸酯化多糖试验结果
2.1.1 SLP及SSLP性状
SLP提取率为5.5%,且SLP呈现淡黄色粉末(左图),SSLP较SLP颜色深,呈棕褐色絮状粉末(右图),结果见图1。

图1 SLP与SSLP实物图Fig.1 The picture of SLP and SSLP
2.1.2 SSLP硫酸基取代度
硫酸基标准曲线回归方程为y=0.590 7x+0.177 3,R2=0.990 6,结果见图 2。
根据公式(1)和(2)得SSLP硫酸基含量为15.90%,取代度为1.63。
2.1.3 红外光谱分析
沙棘叶多糖(SLP)在3 435.17 cm-1处的宽峰为OH键的伸缩振动峰;2 918.18 cm-1处的峰为C-H键的伸缩振动峰,这些区域的吸收峰为糖类的特征吸收峰。硫酸酯化沙棘叶多糖(SSLP)3 440.96 cm-1处的宽峰为多糖中-OH的伸缩振动峰;2 933.69 cm-1处的峰为C-H键的伸缩振动峰;在1 244.07 cm-1处有一明显的吸收峰该峰为的S=O伸缩振动吸收峰;808.16 cm-1处为C-O-S的伸缩振动峰,表明硫酸基被转移到沙棘叶多糖上,形成了新的化学键。SSLP与SLP主体特征吸收波形、吸收峰等特征指标基本相同,表明氯磺酸-吡啶法未破坏多糖的糖环结构,结果见图3。

图2 硫酸基含量测定标准曲线Fig.2 Calibration curve for the determination of sulfate conten

图3 SLP与SSLP红外图谱Fig.3 The infrared spectrum(IR)spectra of SLP and SSLP
2.2 SSLP的解酒作用
2.2.1 SSLP和SLP对ADH活性影响
各浓度的SSLP及SLP溶液对ADH均具有激活作用,随着浓度的增加而增加,且同浓度的SSLP溶液激活作用优于SLP,结果见图4。
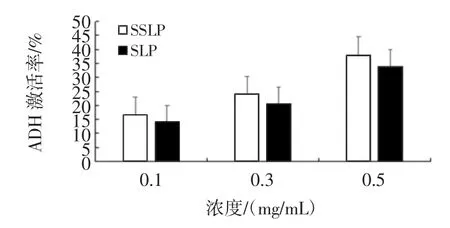
图4 SSLP和SLP对ADH活性的影响Fig.4 The effect of SSLP and SLP on ADH acticity
2.2.2 SSLP对急性酒精中毒小鼠的解酒作用
小鼠急性酒精中毒模型建立过程中,空白组小鼠未出现翻正反射消失的情况,模型组小鼠出现翻正反射消失的情况,表明小鼠急性酒精中毒模型建立成功。
与模型组比较,阳性药物组、SLP高剂量组、SSLP中剂量组小鼠醉酒潜伏期显著延长(P<0.05),SSLP高剂量组小鼠醉酒潜伏期极显著延长(P<0.01);与阳性药物组比较,SSLP高剂量组小鼠醉酒潜伏期显著延长(P<0.05)。与模型组比较,阳性药物组、SLP高剂量组和SSLP中剂量组持续醉酒时间极显著缩短(P<0.05),SSLP高剂量组持续醉酒时间极显著缩短(P<0.01);与阳性药物组比较,SSLP高剂量组小鼠醉酒潜伏期显著缩短(P<0.05)。说明SLP与SSLP均具有良好的解酒效果,SSLP的解酒作用优于SLP,结果见表1。
表1 SSLP对急性酒精中毒小鼠的影响(±S,n=10)Table 1 The effect of the SSLP of acute alcoholism mice(±S,n=10)

表1 SSLP对急性酒精中毒小鼠的影响(±S,n=10)Table 1 The effect of the SSLP of acute alcoholism mice(±S,n=10)
注:与模型组比较,a表示在0.05水平显著差异,b表示在0.01水平显著差异;与阳性药物组比较,c表示在0.05水平显著差异,d表示在0.01水平显著差异。
ADH活性/(U/mL)空白组 0 0 27.35±14.96模型组 20.70±4.62 369.38±48.63 17.60±9.38阳性药物组 0.607 24.30±5.01a 332.50±36.69a 24.03±6.76a SSLP 组 0.303 23.80±4.77 346.63±57.49 21.75±6.98a 0.607 26.30±6.57a 298.50±24.97a 25.20±4.98bc 1.214 27.12±7.56bc 280.00±41.23bc26.49±5.32bd SLP 组 0.303 22.58±3.64 354.70±28.62 20.61±5.62 0.607 24.19±5.14 324.19±31.20 23.15±4.58a 1.214 26.45±4.28a 300.49±42.11a 25.42±6.12a组别 剂量/(g/kg)醉酒潜伏时间/min持续醉酒时间/min
2.2.3 SSLP对急性酒精中毒小鼠体内乙醇脱氢酶活性影响
与模型组比较,阳性药物组、SLP高剂量组、SSLP低剂量和中剂量组小鼠ADH活性显著增强(P<0.05),SSLP高剂量组小鼠ADH活性极显著增强(P<0.05);与阳性药物组比较,SSLP中剂量组小鼠ADH活性显著增强(P<0.05),SSLP高剂量组小鼠ADH活性极显著增强(P<0.01)。说明SLP与SSLP对ADH均具有激活作用,SSLP的激活作用优于SLP。结果见表1。
3 结论与讨论
人体摄入酒精后,经胃肠道吸收,少量直接通过肺、尿液和汗液排出体外,90%以上通过肝脏代谢[22]。当肝脏内代谢过程中,乙醇经乙醇脱氢酶(ADH)氧化为乙醛,乙醛通过乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)氧化为乙酸,乙酸经三羧酸循环,彻底氧化为水和二氧化碳排出体外[23]。机体大量摄入乙醇后,在乙醇脱氢酶的催化下大量脱氢氧化,同时乙醇能激活氧分子,产生大量氧自由基,使机体清除自由基的能力减弱。因此,解酒药物主要通过提高ADH活性加速乙醇的氧化代谢、清除酒精代谢产生的自由基等方面进行解酒[24]。
本文结果表明,SLP和SSLP均能够提高ADH活性,同剂量下SSLP对ADH的激活作用优于SLP,推断其原因是多糖经硫酸酯化修饰后,硫酸基和糖环上的羟基形成氢键,阴离子间的相互排斥作用使糖苷链链段适当伸长,形成螺旋结构,降低多糖黏度,从而使其对ADH的激活作用增强,加速乙醇氧化代谢。SLP高剂量组和SSLP中、高剂量组均能够显著延长急性酒精中毒小鼠醉酒潜伏时间,缩短持续醉酒时间,提高ADH 活性(P<0.05,P<0.01)。但相同剂量下 SSLP 对急性酒精中毒小鼠的解酒作用优于SLP。有研究表明,硫酸基等吸电子基团,能够影响O-H键的解离能力,硫酸基存在糖链上越多,O-H键的解离能力就越弱,对超氧阴离子等自由基的清除作用就越强[25]。因此推断,SSLP较SLP具有更强的清除酒精代谢产生自由基的能力。
综上所述,SSLP与SLP能够显著提高ADH活性,加速乙醇氧化代谢,清除酒精代谢产生的自由基,保护肝细胞免受酒精代谢毒物和自由基的损害,从而起到解酒作用,其中SSLP活性更优,可以作为解酒的中药物质基础开展深入研究,为开发高效、低毒且具有解酒、护肝功效的天然植物类保健品和药物奠定基础。

