新资源食品提取物辅助降血糖配方的确定
刘同方, 于燕波, 李淑娟, 沈起兵, 张国文, 李亦凡, 陈 斌
(深圳市绿航星际太空科技研究院, 广东 深圳 518117)
随着对糖尿病基础研究的深入,越来越多的治疗药物研制成功并投入临床使用。西药降血糖作用明显、起效快,但往往缺乏整体的协调性,具有明显的副作用,不利于糖尿病患者长期使用[1]。近年来,诸多研究表明中药对糖尿病具有多途径、多靶点、多环节的综合治疗作用,且中药治疗疾病的毒副作用较小[2-4]。所以,从天然的植物中寻找降血糖的有效成分是开发治疗糖尿病食品的一条重要的途径。已有研究表明,白子菜[5]、苦瓜[6]、青钱柳[7]、桑叶[8]、甜茶叶[9]、玉竹[10]、葡萄皮[11]、枇杷叶[12]等植物中的活性成分具有降低血糖和促进胰岛素分泌等作用。本研究主要通过对植物提取物进行筛选,并进行配方优化,最后进行体外降血糖功能评价实验,以期为研制具有辅助降血糖功能的配方提供支持。
1 实验部分
1.1 材料与试剂
MTT细胞增殖及细胞毒性检测试剂盒(MTT cell proliferation and cytotoxicity assay kit),美国Amrecso公司;二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma公司;4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG),上海晶纯生化科技股份有限公司;α-葡萄糖苷酶(酵母源),美国Sigma公司;阿卡波糖片,拜耳医药保健有限公司;MEM低糖培养基及胰蛋白酶(含0.25%乙二胺四乙酸),美国Gibco公司;地特胰岛素,丹麦诺和诺德公司;HepG2细胞株购于北京协和医院;葡萄糖测定试剂盒,南京建成生物工程研究所;磷酸二氢钾、磷酸氢二钾、碳酸钠、葡萄糖等均为分析纯,购于国药集团化学有限公司;提取物原料为固体粉末状,由张家界至诚生物有限公司提供。
1.2 仪器与设备
DK-8B型电热恒温水浴锅,上海精宏试验设备有限公司;UV-2600型紫外-可见分光光度计,尤尼柯(上海)仪器有限公司;AL204型电子天平,瑞士梅特勒-托利多仪器有限公司;BCL-1000A型超净工作台,北京亚太科隆公司;MCO-15AC型CO2培养箱,美国SANYO仪器有限公司。
1.3 实验方法
1.3.1α-葡萄糖苷酶活性抑制率的测定
取10 mL试管,依次加入pH=6.8磷酸缓冲液1.85 mL,0.40 U/mL酶溶液100 μL,加入100 μL样品溶液,涡旋振荡混合均匀,37 ℃恒温水浴15 min,再加入0.011 6 mol/LpNPG溶液50 μL,涡旋振荡混合均匀,37 ℃恒温水浴20 min,再加入8.00 mL 0.20 mol/L Na2CO3溶液终止反应,405 nm处测定吸光度值,α-葡萄苷酶活性抑制率计算见式(1)。
(1)
式(1)中,E抑制率为α-葡萄苷酶活性抑制率,A空白为不加样品反应后的吸光度值,A样品为加入样品反应后的吸光度,A背景为只加样品的吸光度值,设阿卡波糖片为阳性对照组,每个样品做3个平行,取平均值,计算抑制率。
1.3.2不同提取物原料体外酶抑制率活性比较
通过对不同浓度桑叶提取物、苦瓜提取物、葡萄皮提取物、甜茶叶提取物、白子菜提取物、玉竹提取物、青钱柳叶提取物和枇杷叶提取物等8种植物提取物原料(见表1)进行体外酶抑制率活性比较,筛选出活性较强的普通食品、新食品或药食同源原料提取物进行配方优化设计。
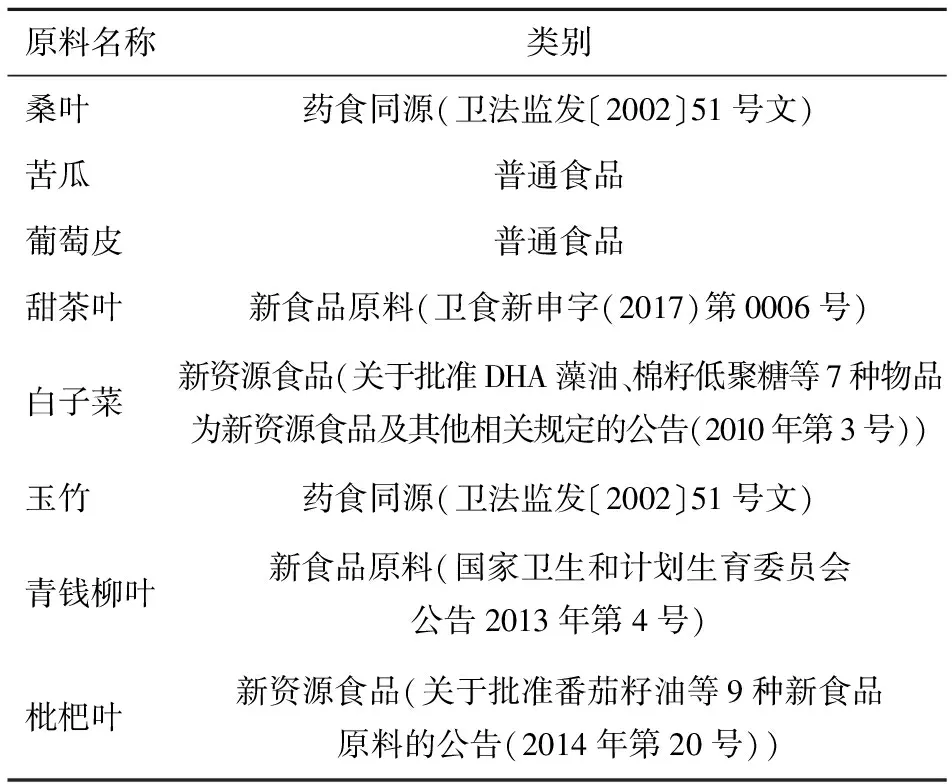
表1 用于降血糖配方设计的8种植物提取物
1.3.3配方优化设计
通过不同原料活性比较实验,选取活性高于阳性对照组的提取物原料,采用Design Expert 8.0.6中D-optimal限制成分上下界的方法,对组分用量范围进行人为限制,然后通过对回归方程及各组分等高线图和响应曲面的分析,确定最优配方。
1.3.4HepG2细胞体外模型降血糖效果评价
1.3.4.1 胰岛素抵抗HepG2细胞模型建立
参考文献[13]方法建立体外细胞模型,HepG2细胞1×105个/mL接入细胞培养板,贴壁生长24 h后,加入终浓度为30 mmol/L的葡萄糖溶液,孵育24 h,再加入终浓度为1×10-7mmol/L的胰岛素刺激10 min,即建立高浓度葡萄糖诱导的胰岛素抵抗HepG2细胞模型。
1.3.4.2 细胞存活率的测定
采用MTT法测定细胞存活率[14],当细胞生长至可传代后用胰蛋白酶溶液消化,用MEM低糖培养基调整细胞密度为1×105个/mL,接入96孔板,每孔180 μL。贴壁生长24 h后向细胞中加入20 μL待测样品,同时设添加20 μL 磷酸盐缓冲液的细胞孔作为空白对照组,做6个平行实验。孵育24 h后添加20 μL 5 mg/mL MTT,继续培养4 h,随后吸尽培养基并添加150 μL DMSO,室温放置10 min后于570 nm处测定吸光度值。将空白组细胞存活率设置为100%,细胞存活率计算见式(2)。
(2)
式(2)中,γ细胞存活率为细胞存活率,A实验组为添加待测样品处理后测得吸光度值,A空白组为添加磷酸盐缓冲液处理后测得吸光度值。
1.3.4.3 葡萄糖利用率的测定
根据葡萄糖氧化酶-过氧化物酶法[15]测定葡萄糖含量,实验组细胞同时添加葡萄糖溶液和样品溶液,模型对照组添加葡萄糖溶液和等体积磷酸盐缓冲液,空白组仅添加等体积无菌磷酸盐缓冲液,添加葡萄糖终浓度为30 mmol/L,继续孵育24 h,添加胰岛素(终浓度为1×10-7mmol/L)刺激细胞10 min,随后立即吸取上层培养基,用葡萄糖测定试剂盒测定葡萄糖浓度,葡萄糖利用率计算见式(3)。
(3)
式(3)中,c1为原培养基中葡萄糖浓度,5.55 mmol/L,c2为葡萄糖添加终浓度,0或30 mmol/L,c3为上层培养基中葡萄糖浓度,mmol/L。
2 结果与分析
2.1 不同提取物对α-葡萄苷酶抑制活性比较结果分析
不同提取物原料对α-葡萄糖苷酶抑制活性的比较结果见图1。
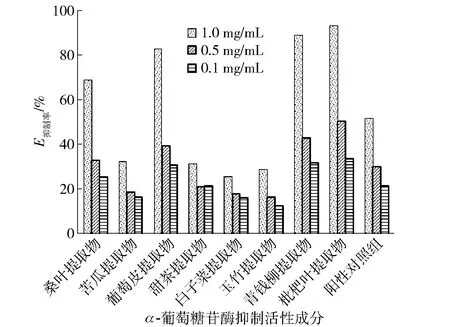
图1 不同提取物原料对α-葡萄糖苷酶抑制活性的比较Fig.1 Comparison of inhibitory activities of different extracts on α-glucosidase
由图1可知,在相同质量浓度条件下,桑叶提取物、葡萄皮提取物、青钱柳叶提取物和枇杷叶提取物对α-葡萄糖苷酶抑制率均大于阳性对照组,因此选取以上4种提取物进行配方优化设计。
2.2 配方优化设计结果分析
2.2.1混料设计方案及结果
运用Design-Expert 8.0.6数据统计分析软件,得到实验方案,并按照实验方案进行实验,结果见表2。
根据实验结果建立回归方程:
E抑制率=41.11A+44.25B+42.13C+35.58D-
26.63AB+17.66AC+33.36AD+17.97BC+
4.27BD+8.92CD-68.89ABC+176.71ABD-
63.09ACD+24.21BCD。
其中A、B、C、D分别表示枇杷叶提取物、青钱柳叶提取物、葡萄皮提取物、桑叶提取物的质量分数,由回归方程和方差分析可见,拟合的三次方程中ABD和BCD三次项的系数为正值,说明枇杷叶提取物、青钱柳提取物、葡萄皮提取物和桑叶提取物对体外抑制率起到贡献作用,二次项回归系数AD项绝对值最大,说明在混料配方中枇杷叶提取物和桑叶提取物复配液对α-葡萄糖苷酶的体外抑制率的贡献最大。

表2 混料设计方案及结果
2.2.2较佳复配比例的确定与验证
当葡萄皮提取物添加比例固定在10.00%时,不同比例枇杷叶提取物、青钱柳提取物和桑叶提取物溶液对α-葡萄糖苷酶抑制率影响的等高线图及3D响应面图见图2。其中响应面图为曲面,表明因素之间存在交互作用。通过软件优化功能,对最优配方进行优化,并对最优配方条件下的结果进行预测,结果见图3。
通过数据分析,确定较佳复配比例为:枇杷叶提取物41.82%,青钱柳提取物26.05%,葡萄皮提取物10.00%,桑叶提取物22.13%,体外抑制率的预测值为 48.73%。按照最优的复配比例进行3次重复验证实验,计算结果,得到配方溶液对α-葡萄糖苷酶的体外抑制率为49.32%±0.15%,与响应面的预测值无明显差异,说明响应面模型优化复配4种提取物的最佳复配比例的结果可靠。
2.3 HepG2细胞体外模型降血糖效果分析
2.3.1配方对HepG2细胞存活率的影响

图2 不同比例提取物溶液对α-葡萄糖苷酶抑制率影响Fig.2 Effects of different proportions of extract solutions on inhibitory rate of α-glucosidase
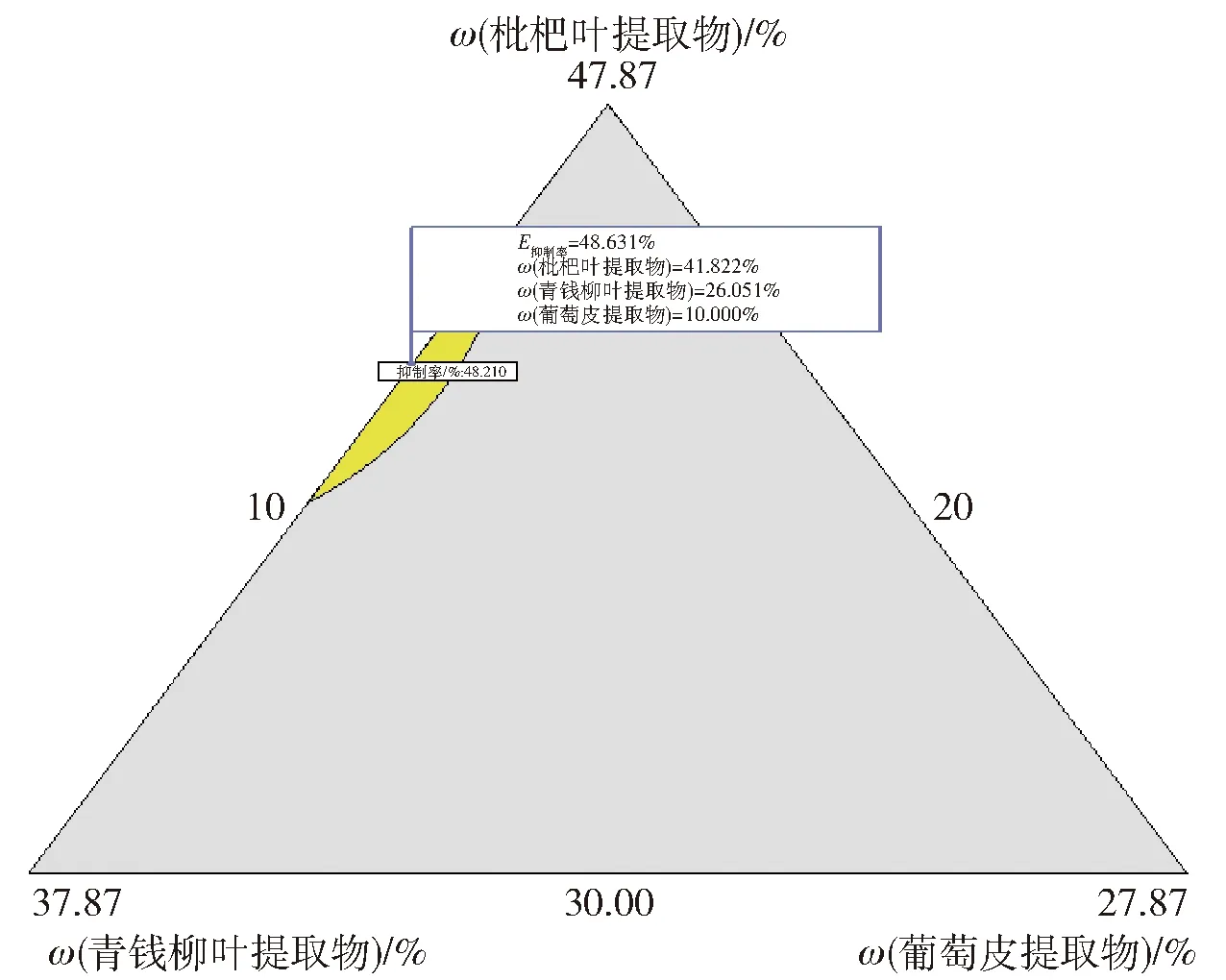
图3 数据处理软件对较优配方比例的预测Fig.3 Prediction of proportion of better formular by data processing software
采用MTT法测定了配方样品对HepG2细胞存活率的影响,数据采用Duncan’s multiple range test方法分析,不同字母表示显著性差异,结果见图4。结果表明,配方样品在质量浓度0.125~0.500 mg/mL范围内对细胞存活率均没有显著影响,说明配方样品在质量浓度0.500 mg/mL及以下时对HepG2细胞没有细胞毒性。因此,选定此浓度范围进行后续实验。
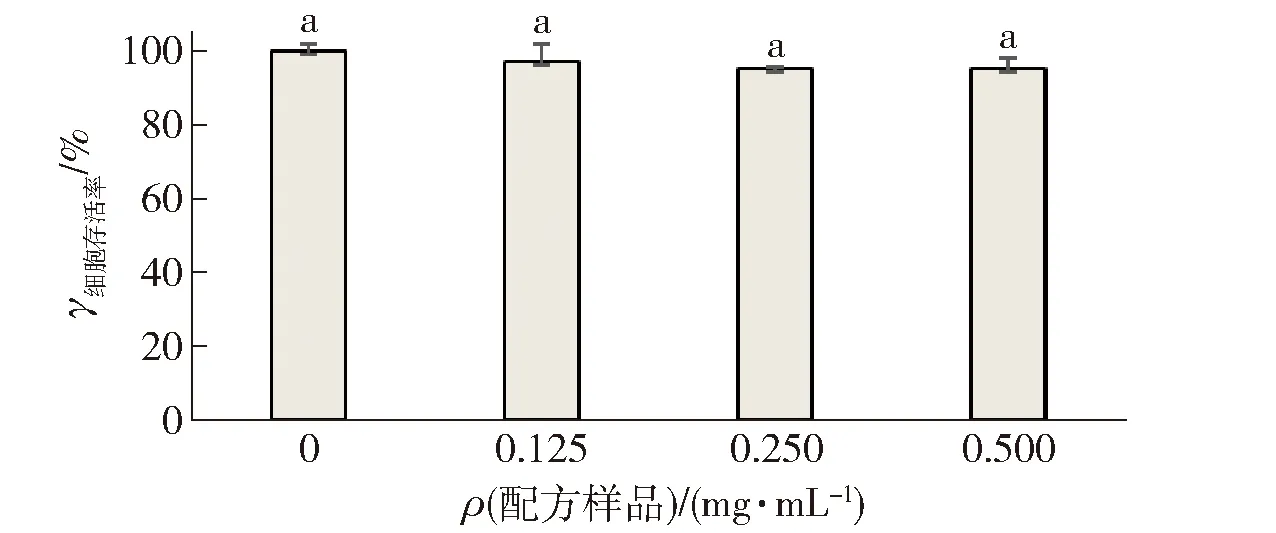
字母代表差异性。图4 不同浓度配方样品对HepG2细胞存活率的影响Fig.4 Effects of different concentrations formula sample on cytoactive of HepG2 cells
2.3.2配方样品对高糖诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响
当加入高浓度葡萄糖刺激后,与空白对照组相比模型组的葡萄糖利用率显著降低,说明成功建立了胰岛素抵抗模型。采用葡萄糖氧化酶-过氧化物酶法测定配方样品对高糖诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响,结果见图5。而在添加高浓度葡萄糖刺激的同时,加入不同浓度配方样品处理,其中实验组1添加了30 mmol/L葡萄糖溶液和0.125 mg/mL样品溶液,实验组2添加了30 mmol/L葡萄糖溶液和0.250 mg/mL样品溶液,实验组3添加了30 mmol/L葡萄糖溶液和0.500 mg/mL样品溶液。结果表明实验组显著提高胰岛素抵抗模型的葡萄糖利用率,且促进作用呈现一定的浓度依赖效应。当样品终质量浓度为0.500 mg/mL时细胞对葡萄糖的利用率最高,与模型组相比提高了37.88%。结果表明配方样品对高浓度葡萄糖刺激HepG2细胞造成的胰岛素抵抗具有一定的改善作用。
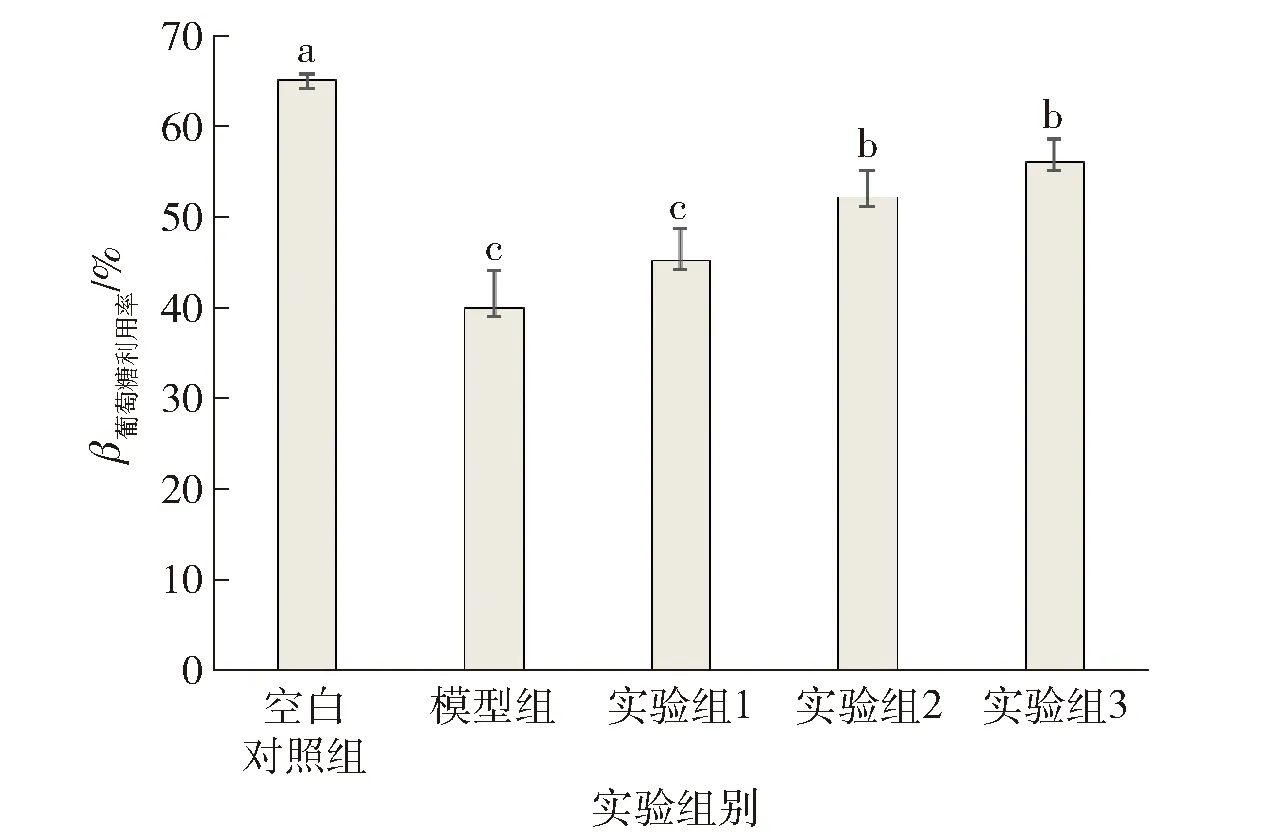
不同字母代表差异显著。图5 配方样品对高糖诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响Fig.5 Effects of formula samples on glucose utilization in HepG2 cells induced by elevated glucose
2.3.3配方对高糖和高脂联合诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响
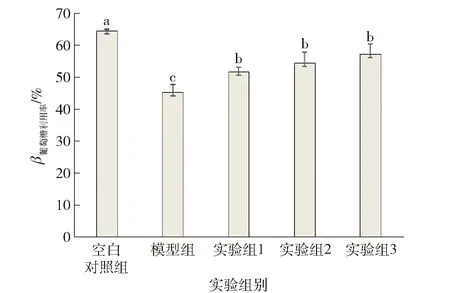
不同字母代表差异显著。图6 配方样品对高糖和高脂联合诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响Fig.6 Effects of formula samples on glucose utilization in HepG2 cells induced by elevated glucose and free fatty acids
测定配方样品对高糖和高脂联合诱导胰岛素抵抗HepG2细胞内葡萄糖利用率的影响,结果见图6。当加入高浓度葡萄糖与棕榈酸刺激后,与空白对照组相比模型组的葡萄糖利用率显著降低,说明成功建立了胰岛素抵抗模型。在添加高浓度葡萄糖和棕榈酸刺激的同时,加入不同浓度配方样品处理,其中实验组1添加了30 mmol/L葡萄糖溶液、0.250 mmol/L棕榈酸和0.125 mg/mL样品溶液,实验组2添加了30 mmol/L葡萄糖溶液、0.250 mmol/L棕榈酸和0.250 mg/mL样品溶液,实验组3添加了30 mmol/L葡萄糖溶液、0.250 mmol/L棕榈酸和0.500 mg/mL样品溶液。结果显示实验组显著提高胰岛素抵抗肝细胞对葡萄糖的利用率。当配方样本终质量浓度为0.500 mg/mL时细胞对葡萄糖的利用率最高,与模型组相比提高了25.63%。结果表明配方样品对高浓度葡萄糖与棕榈酸联合刺激HepG2细胞造成的胰岛素抵抗具有一定的改善作用。
3 结 论
本文通过对8种不同植物提取物原料进行体外酶抑制率比较,筛选出4种活性较强的提取物原料进行配方优化设计,对数据进行分析,得出4种提取物具有交互作用,较佳复配比例为:枇杷叶提取物41.82%,青钱柳提取物26.05%,葡萄皮提取物10.00%,桑叶提取物22.13%。HepG2细胞体外模型降血糖效果评价实验结果显示配方样品可提高高糖诱导以及高糖-高脂联合诱导胰岛素抵抗HepG2细胞内葡萄糖利用率,降低细胞外的葡萄糖浓度,改善胰岛素抵抗模型症状。
目前,本配方只进行了体外细胞模型评价降血糖效果实验,辅助降血糖功能评价实验有待完善,可望在此配方基础上,结合感官评价开发一款辅助降血糖功能性食品。

