表面展示新城疫病毒部分F蛋白的重组干酪乳杆菌的构建及其免疫原性
刘欢欢,李树东,杨雨晴,孙晓莹,李岩,刘昕旸,陈小燕,张连妹,白永飞,侯喜林,余丽芸
表面展示新城疫病毒部分F蛋白的重组干酪乳杆菌的构建及其免疫原性
刘欢欢1,李树东1,杨雨晴1,孙晓莹1,李岩1,刘昕旸2,陈小燕2,张连妹2,白永飞2,侯喜林1,余丽芸2
1 黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319 2 黑龙江八一农垦大学 生命科技学院,黑龙江 大庆 163319
本研究旨在构建重组干酪乳杆菌pLA-Newcastle disease virus (NDV)-F/,获得表达产物,并探讨其免疫效果。利用PCR扩增携带部分主要抗原表位的NDV F基因,与穿梭质粒pLA连接转化至大肠杆菌BL21(DE3)中,筛选阳性重组质粒,将其电转化至干酪乳杆菌中,构建重组干酪乳杆菌pLA-NDV-F/,应用PCR鉴定阳性菌株,Western blotting鉴定重组菌反应原性,间接免疫荧光、流式细胞术和激光共聚焦检测蛋白表达情况。试验选用14日龄雏鸡,各组免疫方式为口服+滴鼻。设立pLA-NDV-F/两次免疫组和三次免疫组、弱毒疫苗组、pLA/、未攻毒PBS组和攻毒PBS组。间接ELISA方法检测雏鸡血清IgG、肠道、鼻腔、肺脏中sIgA抗体效价,评价试验组雏鸡攻毒保护率。结果表明,有94.10%的重组菌表达了F蛋白,且高效表达在干酪乳杆菌细胞表面,蛋白大小为62 kDa,并能与抗NDV阳性血清特异性结合。各免疫组anti-F IgG和sIgA抗体水平显著高于对照组,pLA-NDV-F/三次免疫组抗体持续时间比两次免疫组延长28 d,抗体峰值没有显著差异。免疫pLA-NDV-F/三次、两次、弱毒疫苗、pLA/和PBS的攻击保护率分别为80%、80%、90%、0%和0%。因此,利用干酪乳杆菌表达体系成功表达了携带部分抗原表位的NDV F基因,具备良好的反应原性和免疫原性,可诱导机体产生保护性免疫应答。
新城疫病毒,免疫原性,干酪乳杆菌,黏膜免疫,保护率
新城疫 (Newcastle disease,ND) 由新城疫病毒 (Newcastle disease virus,NDV) 引发,是危害禽类最严重的疫病之一,被世界动物卫生组织认定为必须报告的A类动物疫病。NDV在常温下具备高度稳定性[1],并可通过粪口途径和眼结膜及鼻黏膜等呼吸道黏膜侵入机体,使得该病防控困难较大[2]。
由于野生鸟类和家禽的相互传播致使NDV变异株大量出现[3],迄今为止全世界已分离出18种不同的基因型[4],常规疫苗常无法提供足够的保护。抗原表位是机体产生免疫应答的基础,截取主要抗原表位进行基因工程疫苗研制针对性更强,更有利于ND的防控。NDV F蛋白存在多处抗原位点可诱导产生中和抗体,在调控病毒与受体细胞膜融合、病毒侵入机体等方面具有关键性作用[5]。NDV F蛋白裂解位点 (Fcs) 位于NDV前体蛋白F0的第112–117氨基酸处[6],研究表明,此处碱基的轻微改变即可影响NDV毒力和融合活性,是决定ND毒力强弱的关键因素[7-8]。因此,截取涵盖Fcs的抗原区段制备基因工程疫苗更具应用价值。
干酪乳杆菌是肠道益生菌,可抑制胃肠道病原体生长,调节肠道微生物菌群的平衡,能够诱发黏膜和全身免疫起到类似佐剂的作用[9-11],以其作为黏膜疫苗递送载体可以表达同源和异源蛋白[12-13],构建的重组菌株表达的酶无需经过纯化即可应用于饲料添加剂等食品级用途[14]。ND主要通过黏膜途径侵入机体,因此,以干酪乳杆菌作为抗原递送载体研发黏膜疫苗对该病的防控具有十分重要的意义。本研究截取包括Fcs在内的NDV F蛋白的两处主要抗原表位基因片段,选用干酪乳杆菌表面展示表达载体pLA与目的片段连接,构建重组干酪乳杆菌pLA-NDV-F/,通过激光共聚焦、流式细胞术检测目的蛋白的表达情况,将表达的重组菌免疫雏鸡对其免疫原性进行分析,为制备新城疫基因工程乳酸菌疫苗的研究提供依据。
1 材料与方法
1.1 病毒、细菌株、质粒、试验动物
新城疫活疫苗 (LaSota株) 购自哈药集团生物疫苗有限公司;F48E8株由黑龙江八一农垦大学预防兽医实验室保存;大肠杆菌BL21 (DE3) 感受态细胞、干酪乳杆菌表面展示表达载体pLA、纯化的重组NDV F蛋白均由本实验室构建保存;干酪乳杆菌购自中国工程微生物保藏中心;试验用鸡为14日龄商品蛋鸡。
1.2 主要试剂和仪器
TRIzol、DNA聚合酶、限制性核酸内切酶HⅠ、Ⅰ、T4 DNA连接酶、反转录试剂盒、pMD18-T载体均购自TaKaRa公司;质粒提取试剂盒购自AXYGEN公司;胶回收试剂盒、SDS-PAGE凝胶制备试剂盒购自Solarbio公司;羊抗鸡IgG-HRP、FITC标记的羊抗鸡荧光二抗购自北京博奥森;山羊抗鸡IgA-HRP购自Abcam公司;DAB显色试剂盒购自中杉金桥公司;DH5α感受态细胞、BL21 (DE3) 感受态细胞、抗NDV阳性血清由本实验室保存,抗NDV阳性血清抗体效价经血清中和试验 (SNT) 测得为1︰256。凝胶成像系统和半干转膜仪,美国Bio-Rad公司;超净工作台,哈尔滨东联电子技术开发公司;共聚焦显微镜,德国Leica公司。
1.3 目的基因的获取
根据NDV F基因序列(GenBank登录号:AF077761.1) 设计一对特异性引物,上下游引物分别插入HⅠ和Ⅰ酶切位点,上游引物序列:P1 5ʹ-GGATCCATCATAGTTAAGCTCCTCCC-3ʹ (下划线部分为HⅠ),下游引物序列:P2 5ʹ-GTCGACGTAATCCATATTTCCACCAG-3ʹ (下划线部分为Ⅰ)。PCR反应条件为:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,共30个循环;72 ℃ 10 min,PCR产物用0.9%琼脂糖凝胶分析。
1.4 pLA-NDV-F/E. coli的构建与鉴定
采用琼脂糖凝胶DNA回收试剂盒对1.3中PCR产物进行回收并将其连接至pMD18-T上,转化入DH5α感受态细胞,涂布于含氨苄抗性的LB固体培养基中,37 ℃培养,次日挑取单菌落,进行PCR初步鉴定、双酶切鉴定阳性重组菌,送往深圳华大基因科技有限公司测序。将测序正确的目的片段与pLA穿梭质粒连接转化至BL21感受态细胞中,命名为pLA-NDV-F/,经PCR、双酶切鉴定筛选阳性重组质粒pLA-NDV-F。
1.5 pLA-NDV-F/L. casei的构建
将1.4获得的阳性重组质粒pLA-NDV-F电转化至干酪乳杆菌感受态细胞中,涂布于氯霉素抗性MRS固体培养基中 (含氯霉素34 μg/mL),次日挑取单菌落37 ℃静置培养12 h,提取重组质粒进行PCR鉴定,筛选阳性重组干酪乳杆菌,并将其命名为pLA-NDV-F/。同时构建干酪乳杆菌对照菌,命名为pLA用于动物试验,干酪乳杆菌感受态细胞制备参照温丽娟等[15]发表的方法。
1.6 pLA-NDV-F/L. casei表达目的蛋白的鉴定
1.6.1 pLA-NDV-F/.的表达
取pLA-NDV-F/和pLA/各2%接种于MRS液体培养基中,37 ℃静置培养10 h后,获得重组蛋白。
1.6.2 Western blotting分析
获得的重组蛋白经溶菌酶处理后,1%上样缓冲液重悬,SDS-PAGE后,半干转膜仪将蛋白转移至硝酸纤维素膜上,5%脱脂乳封闭、抗NDV阳性血清 (1︰50) 孵育2 h、羊抗鸡IgG-HRP (1︰5 000) 孵育2 h,DAB显色液显色。
1.6.3 间接免疫荧光试验
取表达10 h的pLA-NDV-F/,均匀涂布于载玻片上,放入预冷的无水乙醇中固定菌体,5%脱脂乳溶液封闭过夜,抗NDV阳性血清 (1︰50) 37 ℃孵育2 h、FITC标记的羊抗鸡荧光二抗 (1︰100) 37 ℃孵育1 h,PBS洗涤菌体后于荧光显微镜下观察结果。
1.6.4 流式细胞术
取表达10 h的pLA-NDV-F/,调整细胞浓度为5×106个/mL,收集菌体用5%牛血清白蛋白4 ℃封闭过夜,依次经抗NDV阳性血清 (1︰50)、FITC标记的羊抗鸡荧光二抗 (1︰100) 37 ℃避光孵育1 h,PBS重悬菌体,流式细胞仪检测。
1.6.5 激光共聚焦
取流式细胞术处理后的表达菌涂布于载玻片上,封片剂封片,激光共聚焦显微镜观察。
1.7 重组菌pLA-NDV-F/L. casei免疫攻毒保护性试验
1.7.1 动物免疫
经平板计数后,将菌液浓度为1011CFU/mL的pLA-NDV-F/和pLA/,通过口服和滴鼻结合的方法用于动物免疫,免疫剂量为0.2 mL/只 (口服0.15 mL,滴鼻0.05 mL)。选用14日龄雏鸡,随机分为5组,每组30只,A1和A2组免疫重组菌pLA-NDV-F/,B组免疫弱毒疫苗 (5羽份/mL),C组免疫pLA/,D1和D2组免疫PBS。A1组为两次免疫组,A2组为三次免疫组,D1组为攻毒PBS组,D2组为未攻毒PBS组,比较不同组别间免疫效果。具体分组情况见表2。
B组免疫按弱毒疫苗免疫程序,其余各组连续免疫菌体5 d为一次免疫,一免、二免、三免各间隔10 d,免疫开始每隔7 d每组剖杀2只鸡采集血清,检测特异性IgG抗体水平,取肺脏、肠道、鼻腔冲洗液检测特异性sIgA抗体水平。
1.7.2 血清中IgG抗体检测
将浓度为1 μg/mL的纯化重组NDV F蛋白包被酶标板,4 ℃包被过夜,5%脱脂乳37 ℃封闭1 h,加入待检样品 (1︰10) ,37 ℃孵育1 h,加入羊抗鸡IgG-HRP (1︰5 000) 37 ℃孵育1 h,底 物 (TMB-H2O2) 显色,2 mol/L H2SO4终止反 应,酶标仪检测,读取450吸光值。待检血清450/阴性血清≥2.1即为阳性结果,反之为阴性结果。
1.7.3 肠道、鼻腔、肺脏冲洗液中sIgA抗体检测
检测sIgA抗体,二抗选用山羊抗鸡IgA-HRP (1︰10 000),具体步骤参照1.7.2。

表1 免疫试验
1.7.4 检测结果显著性分析
采用Graphpad Prism 6软件的方差分析法对检测结果进行显著性分析。*:0.01<<0.05;**:0.001<<0.01;***:0.000 1<<0.001;****: 0.000 01<<0.000 1。
1.7.5 pLA-NDV-F/.攻毒保护试验
将F48E8毒株以肌肉注射的方式,对A1组二免后7 d,A2、B、C、D1组三免后7 d的试验鸡进行攻毒,攻毒剂量为105EID50,攻毒后7 d观察试验鸡临床症状及死亡情况,计算免疫保护率。
免疫保护率(%)=(1−免疫组死亡率/对照组死亡率)×100%。D2组为未攻毒PBS组。
2 结果与分析
2.1 pLA-NDV-F/L. casei构建与鉴定
2.1.1 PCR鉴定
以pLA-NDV-F/提取的重组质粒为模板进行PCR扩增,结果显示有大小约为564 bp的片段,与预期结果一致 (图1)。
2.1.2 Western blotting鉴定
对表达10 h的pLA-NDV-F/和pLA/用溶菌酶处理后,进行Western blotting鉴定,结果显示,pLA-NDV-F/表达的蛋白被抗NDV阳性血清识别,在62 kDa处出现明显印记 (图2),对照组未出现特异性条带,与预期结果相符。

图1 pLA-NDV-F/L. casei PCR扩增结果

图2 pLA-NDV-F/L. casei Western blotting鉴定结果
2.1.3 间接免疫荧光试验鉴定
对pLA-NDV-F/和pLA/进行间接免疫荧光鉴定,结果表明,pLA-NDV-F/在明视野下可观察到菌体形态(图3A),荧光显微镜下亦可观察到明显的绿色荧光反应(图3B),且荧光为菌体发出(A,B重叠图3C),pLA/在明视野下可见到菌体形态(未列结果),荧光显微镜下未见到绿色荧光(图3D),证明pLA-NDV-F/成功表达外源蛋白。
2.1.4 流式细胞术鉴定
取表达10 h的pLA-NDV-F/和pLA/进行流式细胞术检测,结果显示,pLA-NDV-F/荧光强度明显高于pLA/,筛选的10 000个重组乳酸菌可表达此蛋白的菌体高达94.10% (图4),表明pLA-NDV- F/已成功表达外源蛋白,且表达量较高。
2.1.5 激光共聚焦鉴定
利用激光共聚焦技术检测重组菌蛋白表达情况,观察到绿色荧光主要集中于菌体表面(图5C),而pLA/无此现象(图5D),与预期结果相符(图5)。
2.2 血清IgG抗体效价测定
间接ELISA方法检测血清中IgG抗体水平,结果显示,pLA-NDV-F/两次免疫组、三次免疫组和弱毒疫苗组雏鸡首免后7 d即可检测到相应抗体,三次免疫组与两次免疫组 (=0.098) 和弱毒疫苗组 (=0.382) 相比抗体峰值没有显著差异 (>0.05),三次免疫组与两次免疫组抗体水平于42 d后出现显著性差异 (<0.05),7 d后各试验组抗体水平均显著高于pLA/组和PBS组 (0.000 1<<0.001) (图6A)。

图3 pLA-NDV-F/L. casei荧光检测结果

图4 pLA-NDV-F/L. casei流式细胞术检测结果

图5 pLA-NDV-F/L. casei激光共聚焦显微镜检测结果

图6 重组菌免疫雏鸡血清 (A) 特异性IgG抗体水平及雏鸡肠道 (B)、鼻腔 (C)、肺脏 (D) 冲洗液特异性sIgA抗体水平
2.3 肠道、鼻腔、肺脏冲洗液sIgA抗体效价测定
对采集的雏鸡肠道、肺脏、鼻腔冲洗液进行间接ELISA方法检测,肠道冲洗液检测结果显示,免疫pLA-NDV-F/的两组抗体水平显著高于对照组 (0.000 01<<0.000 1),分别于免疫后56 d、28 d达到抗体峰值且抗体水平没有显著性差异 (>0.05),三次免疫组抗体水平于42 d后显著高于两次免疫组。弱毒疫苗组在免疫后49 d抗体出现下降趋势,各试验组抗体水平均显著高于pLA/组 (0.000 1<<0.001) 和PBS组 (0.000 1<<0.001) (图6B)。
鼻腔冲洗液检测结果表明,pLA-NDV-F/三次免疫组和两次免疫组抗体水平分别于免疫后37 d、21 d达到抗体峰值且抗体水平没有显著性差异 (>0.05),pLA-NDV-F/三次免疫组的抗体水平于35 d后显著高于两次免疫组 (0.01<<0.05),于21 d后显著高于弱毒疫苗组 (0.05<<0.01),并显著高于pLA/组 (0.000 1<<0.001) 和PBS组 (0.000 1<<0.001),对照组抗体无明显增长 (图6C)。
肺脏冲洗液检测结果表明,pLA-NDV-F/免疫三次组和免疫两次组在免疫后21 d抗体出现明显增长并趋于稳定,分别于49 d和28 d达到峰值,于42 d后出现显著性差异 (0.01<<0.05),三次免疫组与弱毒疫苗组抗体水平没有显著性差异 (0.05),各试验组抗体水平极显著高于pLA/组 (0.000 1<<0.001) 和PBS组 (0.000 01<<0.000 1) (图6D)。
2.4 pLA-NDV-F/L. casei攻毒保护试验结果
分别于两次免疫和三次免疫7 d后以NDV强毒株F48E8对试验鸡进行攻毒,攻毒对照组72 h内全部死亡;未攻毒PBS组 (D2) 试验鸡全部存活,健康状态良好。其中,免疫重组干酪乳杆菌pLA-NDV-F/的两组于36 h开始出现死亡现象,两次免疫组弱毒疫苗组于48 h开始出现死亡现象,未死亡个体健康状态均良好,A1、A2、B、C、D1和D2各组保护率分别为80%、80%、90%、0%、0%和100% (表3)。
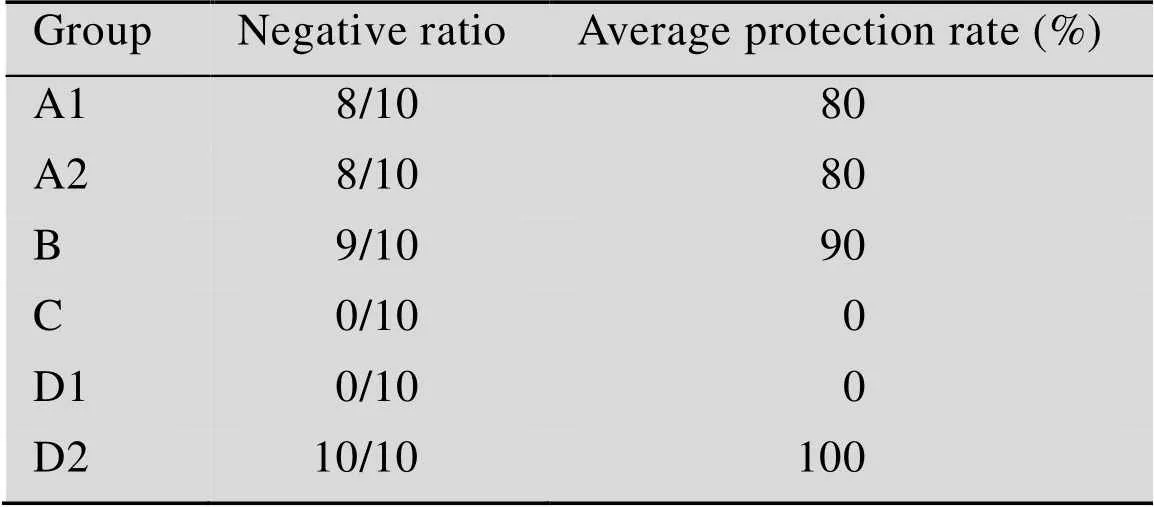
表2 免疫重组干酪乳杆菌保护率
3 讨论
本文报道了以干酪乳杆菌作为抗原递送载体研发一种黏膜疫苗用于鸡新城疫的防控。具体为截取包括Fcs在内的NDV F蛋白的两处主要的抗原基因片段,与pLA穿梭质粒相连,构建重组干酪乳杆菌pLA-NDV-F/,经检测发现重组菌阳性率高达94.10%,且展示在细胞表面,确定了该重组菌的应用价值。
黏膜免疫存在归巢效应,诱导特定部位致敏的免疫细胞,约80%免疫细胞返回抗原致敏部位发挥免疫功能,表现为局部免疫,其余20%免疫细胞则转移至其他黏膜部位发挥功能,致使不同黏膜部位发生相互关联[16]。通过对鼻黏膜冲洗液中sIgA抗体的检测可以发现,相对于其他组织,重组菌在此处诱导的抗体持续时间相对较短,与相关文章中关于乳杆菌鼻黏膜的定殖仅为3 d左右的报道基本一致[17]。可于肺脏冲洗液中检测到sIgA抗体,且抗体水平和抗体持续时间均优于鼻腔冲洗液,分析原因可能为:1) 滴鼻免疫途径使部分重组菌抗原进入肺脏诱发局部黏膜免疫;2) 进入鼻腔和肠道的菌刺激产生的免疫细胞部分转移至肺脏黏膜免疫组织,引起黏膜相关淋巴组织 (Mucosal associated lymphoid tissues, MALT) 免疫应答[16];3) 口服pLA-NDV-F/可长时间、大量存留于肠道,由此处刺激产生的免疫细胞可转移刺激肺脏黏膜免疫组织产生免疫应答,却不能刺激鼻相关淋巴组织 (Nasal associated lymphoid tissues, NALT) 免疫反应[18],可能是造成肺脏抗体持续时间长于鼻腔的原因,另外,是否因为自身免疫器官产生的局部免疫应答和其他免疫细胞通过转移诱导的MALT免疫应答共同作用,从而导致此处抗体水平较高,有待验证。
免疫次数增多的同时免疫成本也随之增加,因此,确定免疫次数与抗体效价、抗体持续时间的关系对于该重组菌的实际应用具有重要意义,可以发现免疫两次组和免疫三次组在诱导体液免疫和黏膜免疫方面产生的抗体峰值无显著性差异,可能是试验时均以相同剂量抗原用于雏鸡免疫,以至于试验鸡体内针对此剂量抗原产生的抗体已到达阈值,无法实现显著增长。研究表明,在适当增加抗原施用剂量时可诱发更高水平的抗体滴度[2,19]。因此,随着免疫次数的增加,适当增加免疫剂量或许更有利于抗体峰值的增长。攻毒试验结果显示A1、A2组保护率一致,表明两次免疫和三次免疫都能抵抗病毒感染,只是三次免疫能获得更长的免疫保护时间。免疫保护性试验结果显示,重组菌组免疫效果略低于弱毒疫苗组,可能因为重组菌表达的仅为部分抗原表位区,而弱毒疫苗具备天然病毒完整的抗原表位,因此能刺激机体产生更高的免疫应答,但是仍需要田间免疫效果的进一步分析。
本研究利用干酪乳杆菌表达体系成功表达了NDV F部分主要抗原表位蛋白,雏鸡免疫及攻毒保护性试验表明,重组干酪乳杆菌pLA-NDV-F/具有良好的免疫原性和反应原性,可诱导机体产生保护性免疫应答。
[1] Ge JY, Wang XJ, Tian MJ, et al. Recombinant Newcastle disease viral vector expressing hemagglutinin or fusion of canine distemper virus is safe and immunogenic in minks. Vaccine, 2015, 33(21): 2457–2462.
[2] Dimitrov KM, Afonso CL, Yu QZ, et al. Newcastle disease vaccines-A solved problem or a continuous challenge? Vet Microbiol, 2017, 206: 126–136.
[3] Ayala AJ, Dimitrov KM, Becker CR, et al. Presence of vaccine-derived Newcastle disease viruses in wild birds. PLoS ONE, 2016, 11(9): e0162484.
[4] Snoeck CJ, Owoade AA, Couacy-Hymann E, et al. High genetic diversity of Newcastle disease virus in poultry in west and central Africa: cocirculation of genotype XIV and newly defined genotypes XVII and XVIII. J Clin Microbiol, 2013, 51(7): 2250–2260.
[5] Toyoda T, Gotoh B, Sakaguchi T, et al. Identification of amino acids relevant to three antigenic determinants on the fusion protein of Newcastle disease virus that are involved in fusion inhibition and neutralization. J Virol, 1988, 62(11): 4427–4430.
[6] Samal S, Khattar SK, Paldurai A, et al. Mutations in the cytoplasmic domain of the Newcastle disease virus fusion protein confer hyperfusogenic phenotypes modulating viral replication and pathogenicity. J Virol, 2013, 87(18): 10083–10093.
[7] Xiao S, Nayak B, Samuel A, et al. Generation by reverse genetics of an effective, stable, live-attenuated Newcastle disease virus vaccine based on a currently circulating, highly virulent Indonesian strain. PLoS ONE, 2012, 7(12): e52751.
[8] Samal S, Kumar S, Khattar SK, et al. A single amino acid change, Q114R, in the cleavage-site sequence of Newcastle disease virus fusion protein attenuates viral replication and pathogenicity. J Gen Virol, 2011, 92: 2333–2338.
[9] Aktas B, de Wolfe TJ, Tandee K, et al. The effect of32G on the mouse cecum microbiota and innate immune response is dose and time dependent. PLoS ONE, 2015, 10(12): e0145784.
[10] Compare D, Rocco A, Coccoli P, et al.DG and its postbiotic reduce the inflammatory mucosal response: an-organ culture model of post-infectious irritable bowel syndrome. BMC Gastroenterol, 2017, 17: 53.
[11] Van Beek AA, Sovran B, Hugenholtz F, et al. Supplementation withWCFS1 prevents decline of mucus barrier in colon of accelerated aging–/Δ7mice. Front Immunol, 2016, 7: 408.
[12] Grangette C, Müller-Alouf H, Hols P, et al. Enhanced mucosal delivery of antigen with cell wall mutants oflactic acid bacteria. Infect Immun, 2004, 72(5): 2731–2737.
[13] Qiu ZB, Chen J, Chen JJ, et al. Effect of recombinantexpressing interleukin-10 in dextran sulfate sodium-induced colitis mice. J Dig Dis, 2013, 14(2): 76–83.
[14] Peterbauer C, Maischberger T, Haltrich D. Food-grade gene expression in lactic acid bacteria. Biotechnol J, 2011, 6(9): 1147–1161.
[15] Wen LJ, Hou XL, Wang GH, et al. Immunization with recombinantstrains producing K99, K88 fimbrial protein protects mice against enterotoxigenic. Vaccine, 2012, 30(22): 3339–3349.
[16] Brandtzaeg P, Farstad IN, Haraldsen G. Regional specialization in the mucosal immune system: primed cells do not always home along the same track. Immunol Today, 1999, 20(6): 267–277.
[17] Wyszyńska A, Kobierecka P, Bardowski J, et al. Lactic acid bacteria–20 years exploring their potential as live vectors for mucosal vaccination. Appl Microbiol Biotechnol, 2015, 99(7): 2967–2977.
[18] Briskin M, Winsor-Hines D, Shyjan A, et al. Human mucosal addressin cell adhesion molecule-1 is preferentially expressed in intestinal tract and associated lymphoid tissue. Am J Pathol, 1997, 151(1): 97–110.
[19] Dimitrov KM, Ramey AM, Qiu XT, et al. Temporal, geographic, and host distribution of avian paramyxovirus 1 (Newcastle disease virus). Infect Genet Evol, 2016, 39: 22–34.
Immunogenicity of the truncated NDV F protein surface-displayed on
Huanhuan Liu1, Shudong Li1, Yuqing Yang1, Xiaoying Sun1, Yan Li1, Xinyang Liu2, Xiaoyan Chen2, Lianmei Zhang2, Yongfei Bai2, Xilin Hou1, and Liyun Yu2
1 College of Animal Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang, China 2 College of Life Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang, China
To evaluate immune efficacy of the recombinant, we constructed pLA-Newcastle disease virus (NDV)-F/and obtained the expression products. PCR amplified the NDV F gene carrying part of the major epitopes. The target gene was inserted to the shuttle plasmid pLA, and then transformed intoBL21 (DE3) in order to screen positive recombinant plasmid. The positive recombinant plasmid was transformed intoby electroporationto construct pLA-NDV-F/The positive strains were identified by PCR. The reactivity of the recombinant bacteria was identified by Western blotting and the protein expression was detected by indirect immunofluorescence, flow cytometry and laser confocal microscopy. The 14-day-old chickens in each group were vaccinated by oral plus nose drops. The pLA-NDV-F/twice immunization group and three times immunization group, the commercial vaccine group, the pLA/group, the unchallenge PBS and the challenge PBS group were established. IgG in serum and sIgA in the lavage fluid of intestinal, nasal and lung were detected by ELISA. The protection rate of chickens was evaluated. The results showed that 94.10% of the recombinant bacteria expressed the F protein. The recombinant protein was highly expressed on the surface ofwith a protein size of 62 kDa, which specifically bound to anti-NDV serum. The levels of anti-F IgG and sIgA antibodies in each test group were significantly higher than those in the control groups. The duration of antibody in the pLA-NDV-F/three-time immunization group lasted 28 days longer than that in the twice immunized group, and there was no significant difference between antibody peak values. The attack protection rates in each group of immunized pLA-NDV-F/three times, twice, attenuated vaccine, pLA/and PBS were 80%, 80%, 90%, 0% and 0%, respectively. Therefore, the antigenic protein of NDV F was successfully expressed byexpression system, which has of reactogenicity and immunogenicity, and could induce protective immune responses in chickens.
Newcastle disease virus, immunogenicity,, mucosal immunity, protection rate
March 22, 2019;
May 20, 2019
Supported by: Heilongjiang Bayi Agricultural University Postgraduates’ Innovation Project (No. YJSCX2017-Y40), Provincial Early Stage Industrialization Cultivation Project (No. 1253CGZH14), Heilongjiang Provincial Land Reclamation Bureau Science and Technology Research Project (No. HNK135-04-06).
Liyun Yu. Tel/Fax: +86-459-6819292; E-mail: yuliyun1227@126.com
Xilin Hou. E-mail: xly_hou@163.com
黑龙江八一农垦大学研究生创新科研项目(No. YJSCX2017-Y40),省高校产业化前期培育项目(No. 1253CGZH14),黑龙江省农垦总局科技攻关项目(No. HNK135-04-06) 资助。
2019-06-18
http://kns.cnki.net/kcms/detail/11.1998.Q.20190617.1050.002.html

刘欢欢, 李树东, 杨雨晴, 等. 表面展示新城疫病毒部分F蛋白的重组干酪乳杆菌的构建及其免疫原性. 生物工程学报, 2019, 35(8): 1453–1462.Liu HH, Li SD, Yang YQ, et al. Immunogenicity of the truncated NDV F protein surface-displayed on Lactobacillus casei. Chin J Biotech, 2019, 35(8): 1453–1462.
(本文责编 郝丽芳)

