EGFR 和DNA-PKcs 与肺癌患者预后的关系
曲媛媛 殷洪涛 张茵 王瑞芝 鄂明艳
肺癌在我国是发病率及死亡率最高的恶性肿瘤,其中非小细胞肺癌占肺癌的80%[1],是临床最常见也最难治的恶性肿瘤之一。患者的预后除与肿瘤分期、病理类型等有关,还与调控肿瘤细胞的增殖、损伤修复、抗凋亡等相关基因的表达异常密切相关。其中,表皮生长因子受体(epidermal growth factor receptor,EGFR)作为原癌基因-1(human epidermal growth factor receptor-1,her-1)的表达产物[2],在肿瘤的发生、发展中发挥着重要作用。EGFR抑制剂对存在EGFR敏感性突变的非小细胞肺癌具有良好的治疗效果[3-4]。EGFR的高表达则与放化疗敏感性差,患者预后不良相关[5]。DNA依赖蛋白激酶催化亚基(DNAdependent protein kinase catalytic subunit,DNA-PKcs)是参与DNA双链断裂损伤修复的重要激酶,在包括非小细胞肺癌的多种肿瘤组织中高表达[6],临床研究提示其表达程度与患者的预后具有相关性。然而EGFR和DNA-PKcs与非小细胞肺癌患者预后效果及患者生存时间之间的关系研究较少。为明确EGFR和DNK-PKcs在非小细胞肺癌中的表达情况,我们对2005年1月—2008年6月在我院行手术治疗的非小细胞肺癌患者进行了回顾性研究,现将其归纳如下。
1 材料与方法
1.1 临床病例
将在我院行手术治疗227例患者作为研究对象,女性73例,男性154例,平均年龄(55.8±9.4)岁。肺叶切除术208例,全肺切除术16例,袖状切除术者3例。腺癌130例,鳞癌97例。根据第8版AJCC分期,I期32例,IIa期73例,IIb期68例,IIIa期52例,IIIb期2例。随访至2018年8月。术后化疗者156例,术后放疗者87例。
1.2 免疫组化染色
用切片机4 μm将组织芯片蜡块连续切片,56℃水中展片后转至载玻片上。处理如下:(1)脱蜡、水化;(2)抗原修复;(3)血清封闭;(4)在不同切片上分别滴加EGFR、DNA-PKcs的多克隆抗体,4℃孵育过夜;(5)PBS洗三次,2分钟/次;(6)二抗孵育约1小时;(7)PBS洗三次,5分钟/次;(8)DAB显色5~10分钟;(9)PBS冲洗5~10分钟;(10)脱水、透明、封片。
1.3 结果评分
根据染色强度、阳性细胞比例进行评分:染色强度:0(高倍镜下为阴性);1(弱,仅在高倍镜下可观察到);2(中等,在低倍镜下可观察到);3(强,在低倍镜下可见明显染色)。阳性细胞比例:0(无染色);1(1%~25%);2(26%~50%);3(51%~75%);4(76%~100%)。将以上两项评分相加,得到范围在0~7的总分,将染色结果分为四组:-(0);+(1~2);++(3~5);+++(6~7)。EGFR及DNA-PKcs表达+++被认为是高表达,+、++均被认为是低表达。

表1 EGFR 和DNA-PKcs-、+、++、+++四种表达程度[例(%)]
1.4 观察指标
病理科查找2005年1月—2008年6月在我院行手术治疗的非小细胞肺癌患者的肿瘤组织蜡块,进行上述EGFR和DNA-PKcs的免疫组化染色,并对表达程度进行评分,分为-、+、++、+++四组,病案室对这些患者的生存情况进行随访,随访时间至2018年8月10日。
1.5 统计分析
采用SPSS 13.0软件进行统计分析,Kaplan-Meier生存分析,Log-rank比较生存曲线间差异。
2 结果
2.1 EGFR和DNA-PKcs
肺癌患者EGFR和DNA-PKcs-、+、++、+++四种表达程度的患者例数见表1。
另外,EGFR和DNA-PKcs共高表达27例。肺腺癌130例,其中EGFR高表达23例,DNA-PKcs高表达64例;肺鳞癌97例,其中EGFR高表达19例,DNA-PKcs高表达46例。
2.2 生存时间分析
EGFR表达-、+、++、+++的患者的中位生存时间分别为35、37、35、34个月(P>0.05)(图1)。DNA-PKcs表达-、+、++、+++的患者的中位生存时间分别为37、34、32、33个月,阴性表达(-)和高表达(+++)差异具有统计学意义(P<0.05)(图2)。总体中位生存时间为35个月。中位生存时间EGFR和DNAPKcs共高表达为27个月,非高表达患者为36个月,差异不具有统计学意义(P>0.05)(图3)。
3 讨论
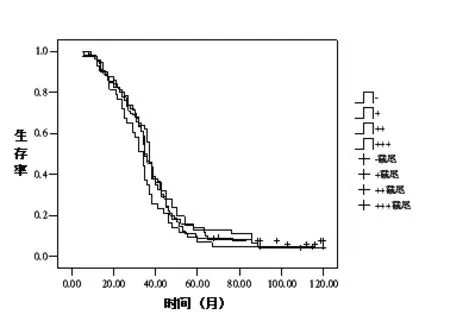
图1 EGFR 表达-、+、++、+++患者的生存曲线

图2 DNA-PKcs 表达-、+、++、+++患者的生存曲线

图3 EGFR 和DNA-PKcs 共高表达患者与非高表达患者的生存曲线
在非小细胞肺癌中,约50%~80%存在EGFR的高表达,EGFR高表达多导致非小细胞肺癌患者对放化疗产生抗拒,因而导致患者的预后不良[7]。通过对患者长期随访研究发现,EGFR的表达程度与患者的生存并无显著相关,EGFR不表达患者的中位生存时间为35个月,高表达患者的中位生存时间为34个月。因此,EGFR的表达并不能作为患者预后的独立评价因素。DNAPKcs定位于细胞核,与Ku70、Ku80共同组成DNA-PK复合物,参与DNA双链断裂的非同源末端连接修复[8]。DNA-PKcs在包括非小细胞肺癌的多种肿瘤组织中高表达,有研究报道非小细胞肺癌肿瘤组织中DNA-PKcs的表达高于周围正常肺组织,且肿瘤与正常组织的DNA-PKcs表达比值高与患者死亡风险增加呈相关[9-10]。我们的研究发现,DNA-PKcs在非小细胞肺癌组织中的高表达率达48%,且高表达患者与阴性表达患者之间的中位生存时间差异具有统计学意义,分别为33个月及37个月。为明确EGFR和DNA-PKcs同时高表达患者的生存情况,我们发现,EGFR和DNA-PKcs同时高表达患者中位生存时间为27个月,低于非同时高表达的患者,但两组差异无统计学意义,因此说明,即使两个分子联合检测,也不能对非小细胞肺癌的长期生存预后做出预测。非小细胞肺癌患者的预后是多因素共同决定的,研究证明,仅通过一两项肿瘤发生相关的生物大分子的检测不能直接对患者的预后做出判断。多项研究表明EGFR经胞浆内转运进入细胞核后,EGFR可作为共转录因子调控相关基因的表达,如COX-2、cyclinD1等,也可以与DNA-PKcs形成复合物,使DNAPKcs的活性增强[11-12]。
综上所述,EGFR和DNA-PKcs在非小细胞肺癌的肿瘤组织中均存在不同程度的表达,虽然EGFR的表达程度与患者的生存时间无显著相关,但更深入的研究其在细胞核内的表达与患者预后的相关性具有潜在意义。DNA-PKcs高表达则提示患者的生存时间短,对于患者预后的判断具有一定的提示作用。

