探讨多模式超声检查技术在早期评价乳腺癌新辅助化疗效果中的应用价值
郝秀秀 王 暘 李岩密
新辅助化疗(neoadjuvant chemotherapy,NAC)是指对进展期乳腺癌患者术前进行全身性、计划性及系统性的化学治疗,NAC不仅能够给乳腺癌患者带来充分的肿瘤病理缓解,同时还能在一定程度上提升保乳手术的成功率[1]。而近年来的相关调查研究结果[2]显示,虽然大部分患者能够从NAC中获益,但仍有小部分患者对NAC并不敏感,治疗期间病情有可能发生一定程度的进展。因此,对乳腺癌术前NAC疗效的准确评估具有重要的意义,但由于缺乏灵敏度、特异度较高的生化检查或技术手段,临床尚缺乏对NAC疗效评估的统一标准与方法,而超声作为乳腺癌早期诊断的重要方法,其在NAC疗效评估中同样具有一定的作用[2]。本研究通过对乳腺癌患者观察研究,探讨多模式超声检查技术在早期评价乳腺癌NAC效果中的应用价值。
1 资料与方法
1.1 一般资料
回顾性选取2015年6月至2017年6月于解放军总医院第一医学中心接受治疗的60例女性乳腺癌患者作为观察对象,年龄28~75岁,中位年龄为45岁,明确原发独立乳腺癌病灶,术前病理类型检测结果显示乳腺浸润性癌59处,肉瘤样癌1处。所有患者对本研究内容及风险完全知情同意,已签署知情同意书,本研究通过医院伦理道德委员会审核。
1.2 纳入与排除标准
(1)纳入标准:①经组织病理实验、术后病理证实为早期乳腺癌或乳腺良性病变;②已签署知情同意书。
(2)排除标准:①存在乳腺手术史;②合并其他类型恶性肿瘤;③合并严重乳腺小叶增生等影响宫颈血流动力学参数疾病;④隆乳手术后;⑤严重精神疾病患者;⑥无法配合完成超声检查。
1.3 仪器与材料
采用IU22型超声诊断仪器(荷兰Philips公司),探头频率为7~12 MHz;采用Logic E9型彩色多普勒超声仪(美国GE公司),9 L4超声探头,频率为9 MHz,机械指数设定为0.16。
1.4 研究方法
所有患者均接受为期4~8个周期的NAC术前治疗,NAC结束后方可进行手术治疗及术后治疗。NAC治疗方案为HER-2阴性患者采用表阿霉素或吡喃阿霉素联合多西他赛或紫杉醇治疗,HER-2阳性患者则在上述治疗基础上联合应用曲妥珠单抗治疗,周期间隔时间为21 d。病理学评级标准依照Miller &Payne分级标准进行评价,其中I~II级为病理学浸润性肿瘤残存,即为pINV;III~V级则为pCR,患者肿瘤疗效评价标准中部分缓解、无效及进展对应I~IV级的pINV,而完全缓解对应pCR。
超声造影检查分别于患者NAC治疗前、NAC第1周期结束后的21 d(即第2周期开始前)进行多模式超声检查,应用二维超声测量患者乳腺癌原发病灶的最大径(D),采用彩色多普勒超声血流频谱检测肿瘤内动脉收缩期峰值血流速度(peak systolic velocity,PSV),并测量动脉血流阻力指数(resistive index,RI),应用弹性超声成像技术测量病灶及周围组织的弹性整体应变率比值(entire strain ratio,ESR)。
所有操作均由同一位医师进行检查,声像图分析结果则由超声科2位资深医师,采用双盲法进行评估,两位医师判断结果有一个判定无效则总结果为无效。
1.5 统计学方法
采用IBM SPSS19统计软件进行统计学分析。计量资料满足正态分布,采用t检验,数据用(±s)表示,计数资料采用x2检验,并绘制超声4项指标诊断NAC有效性的受试者工作特征曲线(receiver operating characteristic,ROC),计算预测的灵敏度与特异度,以P<0.05为差异有统计学意义。
2 结果
2.1 术后组织病理学评价NAC疗效结果
术后组织病理试验证实60例乳腺癌患者中53例患者治疗有效,肿瘤疗效评价标准中其中III级29例,IV级10例,V级14例,治疗总有效率为88.33%;7例患者治疗无效,其中Ⅰ级4例,Ⅱ级3例。
2.2 NAC无效患者化疗前后超声各项参数指标变化情况
NAC第1个周期结束后多模式超声检测病灶D、PSV、RI和ESR指标与NAC前比较差异无统计学意义(t=0.109,t=1.062,t=0.029,t=0.247;P>0.05),见表1。
2.3 NAC有效患者化疗前后超声各项参数指标变化情况
NAC后患者病灶D、PSV、RI和ESR均较化疗前降低,差异有统计学意义(t=1.297,t=3.569,t=1.050,t=3.884;P<0.05),见表2。
表1 NAC无效患者化疗前后超声各项参数指标变化情况(±s)
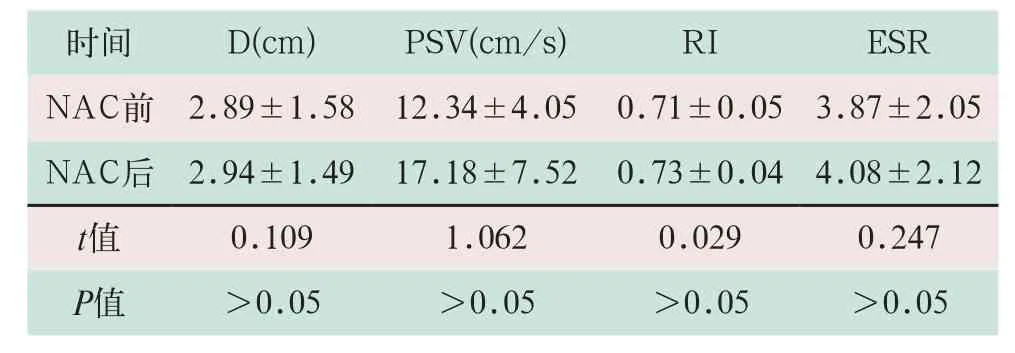
表1 NAC无效患者化疗前后超声各项参数指标变化情况(±s)
注:表中D为病灶最大径;PSV为肿瘤内动脉收缩期峰值血流速度;RI为血流阻力指数;ESR为弹性整体应变率比值
时间 D(cm) PSV(cm/s) RI ESR NAC前 2.89±1.58 12.34±4.05 0.71±0.05 3.87±2.05 NAC后 2.94±1.49 17.18±7.52 0.73±0.04 4.08±2.12 t值 0.109 1.062 0.029 0.247 P值 >0.05 >0.05 >0.05 >0.05
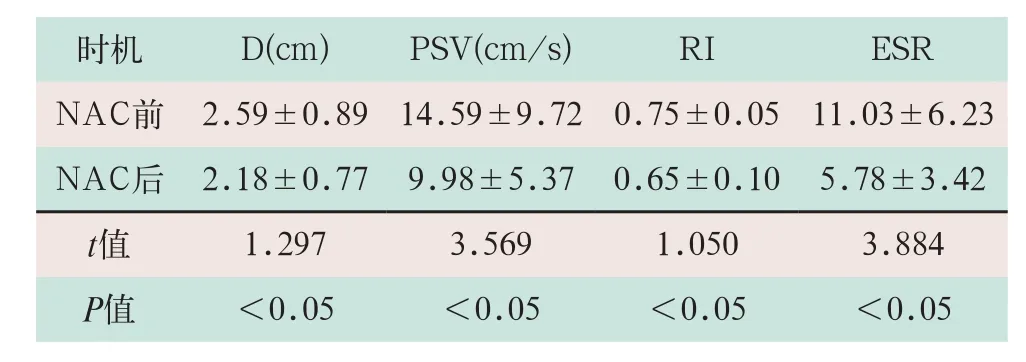
表2 NAC有效患者化疗前后超声各项参数指标变化情况
2.4 ROC曲线绘制结果
病灶D、PSV、RI和ESR指标变化预测NAC有效性的ROC曲线下面积分别为0.707、0.901、0.966和0.979,设定不同阈值则灵敏度、特异度不同,以距离机会线最远点作为阈值,即病灶D缩小8%、PSV降低15%,RI降低3.6%,ESR降低15.7%作为阈值标准,病灶D、PSV、RI和ESR预测NAC有效的灵敏度分别为64.2%、63.4%、83.2%和88.7%,特异度分别为91.1%、100.0%、100.0%和100.0%,见图1。
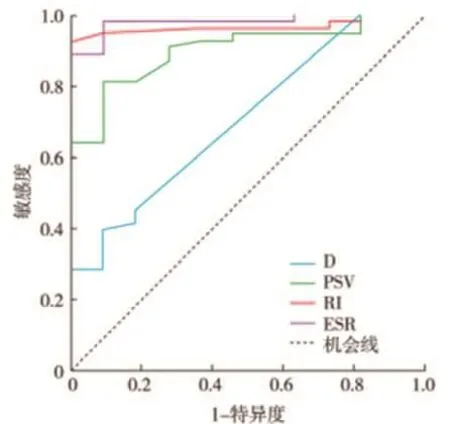
图1 多模式超声检查各指标变化预测NAC有效性的ROC曲线
3 讨论
虽然目前临床尚未完全统一乳腺癌NAC疗效评估方法与标准,但临床病理与肿瘤标志物或基因手段检测用于早期评估乳腺癌NAC疗效仍具有一定的临床应用价值,但其同样存在检查费用昂贵、可重复性差、有创性检查等多种缺陷,这也导致乳腺癌NAC疗效评估结果误差较大等结局的发生[4]。近年来,有学者提倡采用磁共振(MR)技术评估乳腺癌NAC疗效,由于MR对软组织具有较高的密度分辨率,成像清晰且检查无医源性创伤,具有良好的应用价值,但MR检查时间相对较长,多次、反复检查患者需要承担高额的MR检查费用,因此MR用于评估乳腺癌NAC同样颇为受限[5-6]。
目前,超声应用早期评价乳腺癌NAC疗效的研究与报道相对较少,本研究采用的多模式超声检查方案均采用操作简单、价格低廉的超声检查方法,以病灶D、PSV、RI和ESR的4个定量指标作为预测标准,其结果显示,NAC有效的患者病灶D、PSV、RI和ESR均较化疗前明显改变,而在治疗无效的11处病灶中,NAC前后病灶D、PSV、RI和ESR指标无明显变化,绘制ROC曲线并设计病灶D、PSV、RI和ESR阈值发现,多模式超声检查技术对化疗有效的灵敏度最高的指标是ESR,特异度最高的指标为PSV。结果提示,采用多模式超声检查方案能够有效提升乳腺癌NAC的早期评价准确度,并且通过对4个定量指标的联合分析能够提升超声对化疗有效的灵敏度与特异度。
通过回顾分析可知,本研究采用的高频超声能够清晰显示肿瘤内部的细微结构,明确肿瘤与周围乳腺组织的界限关系,更为精确的测量肿瘤的形态大小,而化疗导致肿瘤退缩是一种缓慢渐进过程,基于临床治疗角度分析认为,NAC第2周期前是第1周期药物彻底发挥作用的时期,因此用于早期评估NAC疗效具有重要的临床意义[7-8]。彩色多普勒超声能够准确显示肿瘤内部的血流分布、供应以及血流动力学参数等指标,在本研究中并未将血流分级作为评估标准,这主要考虑到血流分级作为半定量指标易受到操作人员主观意识的影响,导致其NAC疗效评估的应用意义不大[9];而采用PSV和RI作为定量评估指标,基于乳腺癌为血管依赖性病变,化疗药物破坏肿瘤首先破坏新生血管,导致远端的微血管闭塞,进而导致血管破坏[10]。理论上血流动力学指标中的PSV和RI指标应呈明显降低的变化,但本研究结果与此存在差异,这可能与不同病理分期乳腺癌患者NAC效果及预后存在差异有关[11-12]。
超声组织弹性成像能够通过分析病变区域与周围正常组织区域之间弹性系数的差异进行诊断,病理学研究中发现乳腺癌组织结构相对更为致密,较良性乳腺肿瘤具有更多的纤维成分,因此乳腺癌病灶的硬度相对较大,而超声弹性成像提供的正是有关肿瘤组织硬度方面的信息[13]。采用弹性分级法或评分法评估病灶,受检者操作影响有一定主观局限性,而ESR是通过2个感兴趣区域像素弹性比值,比较乳腺病灶区域与周围正常组织间硬度顺应性的差异,具体以数字化定量分析,能清晰反映其之间组织弹性程度的细微差异,可较为客观地量化反映病灶硬度,具有可重复性、操作简便等特点[14-15]。
多模式超声检查技术可在早期准确评估乳腺癌NAC治疗效果,通过对病灶D、PSV、RI及ESR指标变化情况的描述,可实现NAC早期疗效的定量化评估,具有临床应用及推广价值。但本研究仍存在一定的不足,如样本总量过小可能导致结果、结论客观性不足,且本研究并未结合更多的超声检查技术,寻求更为简单、快捷及准确的多模式超声检查方案仍需进一步临床研究证实。

