急性期脑出血患者血清MMP-2 ICAM-1与IL-6 TNF-α水平和脑水肿的关系
王 栋 白雪蕾 吴环立△
南阳市第二人民医院 1)神经外科一病区 2)心脏生理实验室,河南 南阳 473012
脑出血后脑组织周围水肿是患者致残和致死的主要原因[1-2]。炎症反应和脑组织微血管通透性增加是脑出血周围水肿发生的主要病理机制[3-5]。研究显示,大鼠外周血和脑组织中基础金属蛋白酶2(MMP-2)和细胞间黏附分子1(ICAM-1)表达水平与脑组织炎症反应和微血管通透性增加明显相关[6]。但关于人体的相关研究报道仍十分少见。本研究通过检测急性期脑出血脑患者血清MMP-2、ICAM-1、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)的表达水平,以及脑组织周围水肿体积变化情况,探讨MMP-2、ICAM-1与IL-6、TNF-α、脑出血周围水肿体积的相关性。
1 对象与方法
1.1研究对象选取2016-01—2018-06南阳市第二人民医院收治的脑出血患者218例。入选标准:(1)符合中华医学会颁布的中国脑出血诊治指南(2014版)中的诊断标准,经头颅CT、MRI证实为脑出血;(2)首次发病,病程<24 h;(3)住院时间>14 d,行保守治疗。排除标准:(1)合并心、肝、肾等重要器官功能严重异常的患者;(2)外伤、血管畸形、动脉瘤破裂引发的脑出血。其中男134例,女84例;年龄29~75(57.50±5.11)岁;发病至入院时间0.7~8.5(3.70±0.50)h;合并高血压58例,糖尿病16例。本研究经医院伦理委员会批准,患者或其家属签署知情同意书。
1.2方法分别抽取脑出血患者发病第1天、第3天、第7天、第14天的清晨空腹外周静脉血4 mL,3 000 r/min离心10 min,取上层血清,酶联免疫吸附实验(ELISA)检测MMP-2、ICAM-1、IL-6、TNF-α浓度,试剂盒购于上海语纯生物科技有限公司,操作按说明书进行。发病第1天、第3天、第7天、第14天分别进行1次头颅CT扫描,根据影像学参数,使用多田公式计算血肿体积和病灶周围水肿体积,计算脑出血周围水肿体积=病灶体积—血肿体积。
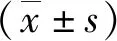
2 结果
2.1不同时间血清MMP-2、ICAM-1、IL-6、TNF-α水平变化情况脑出血后不同时间患者血清MMP-2、ICAM-1、IL-6、TNF-α水平之间差异有统计学意义(P<0.01)。其中脑出血后第3天、第7天患者血清MMP-2、ICAM-1水平明显高于第1天,差异有统计学意义(P<0.05);脑出血后第7天患者血清MMP-2、ICAM-1水平明显高于第3天,差异有统计学意义(P<0.05);脑出血后第14天患者血清MMP-2、ICAM-1水平明显低于第1天、第3天、第7天,差异有统计学意义(P<0.05)。脑出血后第1天、第3天、第7天患者血清IL-6、TNF-α水平差异无统计学意义(P>0.05);脑出血后第14天患者血清IL-6、TNF-α水平明显低于第1天、第3天、第7天,差异有统计学意义(P<0.05)。见表1。
2.2不同时间脑出血周围水肿体积变化情况脑出血后第1天、第3天、第7天、第14天的脑出血周围水肿体积分别为(3.04±1.47)mL、(9.62±2.80)mL、(17.48±2.05)mL、(25.61±2.49)mL。脑出血后第3天、第7天、第14天时脑出血周围水肿体积明显大于第1d,差异有统计学意义(P<0.05);脑出血后第7天时脑出血周围水肿体积明显大于第3d,脑出血后第14天时脑出血周围水肿体积明显大于第7天,差异有统计学意义(P<0.05)。
2.3相关性分析脑出血后第1天、第3天、第7天、第14天血清MMP-2与ICAM-1呈正相关(r=0.736、0.702、0.648、0.691,P<0.05);第1天、第3天、第7天血清MMP-2、ICAM-1与IL-6、TNF-α、脑出血周围水肿体积呈正相关(P<0.05);脑出血后第14天血清MMP-2、ICAM-1与IL-6、TNF-α呈正相关(P<0.05),与脑出血周围水肿体积无相关性(P>0.05)。见表2。
3 讨论
脑出血周围水肿是脑出血后继发性脑损伤的主要表现,炎症反应在其中发挥重要作用[7-15]。脑出血后早期,颅内血肿占位性病变引发炎性浸润,黄嘌呤反应生成毒性氧自由基,损伤血管内皮细胞,导致细胞毒性及血管源性脑水肿[10-11,16-22]。MMP-2能够降解胞外基质中多种活性成分[12]。研究发现,当机体发生免疫炎症反应时,细胞因子可在NF-κB、AP-1介导下上调MMP-2表达水平,而过表达的MMP-2可能影响血脑屏障的正常生理功能,导致血管源性脑水肿[13-15,23-35]。ICAM-1是广泛分布于中枢神经系统中的黏附因子,影响白细胞黏附、活化,介导体内炎症反应[16-19];正常生理状态下,血管内皮中ICAM-1呈低表达,当缺血、缺氧、炎症反应时,ICAM-1表达明显上调[20-23]。外界因素刺激淋巴细胞、纤维母细胞、上皮细胞等可产生炎性因子IL-6,参与炎症反应的发生、发展[24-25,36-43]。研究显示,脑出血患者外周血IL-6含量增加,促进抗原生成,激活体内免疫应答,是反映患者炎症反应程度的主要指标[26-28,44-50]。TNF-α是由巨噬细胞、内皮细胞等分泌的多肽类细胞因子,具有多种生物学作用,参与机体免疫炎症过程,在脑出血后神经组织中高表达,可反映患者炎症反应水平[29-32]。
本研究显示,脑出血后第1天、第3天、第7天,血清MMP-2、ICAM-1水平呈明显上升趋势,第14天血清MMP-2、ICAM-1水平明显下降,低于第1天。提示MMP-2、ICAM-1可能参与了脑出血的病情发展过程,在发病初期,患者体内炎症反应增加,炎症因子透过血脑屏障进入脑组织,上调MMP-2、ICAM-1表达水平,导致继发性脑损伤,随着治疗时间的延长病情得到控制,MMP-2、ICAM-1表达水平逐渐下降。脑出血后第1天、第3天、第7天,血清IL-6、TNF-α水平提升,脑出血损伤脑组织和细胞,大量分泌巨噬细胞、淋巴细胞等,产生IL-6、TNF-α等炎症因子。脑出血后周围水肿体积逐渐增大,病灶部位受炎症反应刺激,炎性细胞分泌大量氧自由基,损伤脑组织,增加血脑屏障通透性,最终引发脑组织周围水肿。相关性分析显示,MMP-2与ICAM-1呈正相关,提示两指标在脑出血早期脑组织继发性损伤中发挥协同作用。发病第1天、第3天、第7天血清MMP-2、ICAM-1与IL-6、TNF-α、脑出血周围水肿体积呈正相关,提示MMP-2、ICAM-1可间接反映脑出血患者体内炎症反应水平,且共同参与了脑组织周围水肿。临床工作中联合检测MMP-2、ICAM-1水平有助于评估患者脑出血周围水肿的严重程度,为治疗方案的制定提供参考。

表1 不同时间血清MMP-2、ICAM-1、IL-6、TNF-α水平变化比较
注:与第1天相比,aP<0.05;与第3天相比,bP<0.05;与第7天相比,cP<0.05

表2 脑出血后不同时间各指标Pearson相关性分析

