基于核心素养的高三专题复习
——氧化还原反应方程式的书写
柯增援
(广东省阳江市第三中学 529500)
氧化还原反应的化学(离子)方程式的书写一直都是历年来高考考察的重点、热点内容.在教学中,笔者发现大多数同学对于书写新情境下的氧化还原反应方程式感觉很棘手,稍微复杂的方程式都不知道怎么配平,失分严重.所以在高三的一轮复习中讲解一节氧化还原反应方程式的配平十分重要和必要.
在教学中,笔者通过对比归纳总结出书写配平氧化还原反应(离子)方程式的方法——四步法,建立一种模型来解析氧化还原反应(离子)方程式的内在规律,在与班级同学的分享交流中,效果良好.
模型的建立如下:
第一步:根据化合价的变化,确定四种物质(氧化剂、还原剂、氧化产物、还原产物);
第二步:根据得失电子守恒,配平四种物质;
第三步:根据原子守恒,配平其它物质(化学方程式);
根据电荷守恒,配平其它离子(离子方程式);
第四步:根据原子守恒、电荷守恒,査方程式是否配平.
一、教学过程设计
模块一、复习氧化还原反应(离子)方程式的配平
1.正向配平法:适用于反应物中氧化剂和还原剂是不同的物质
第一步:根据化合价的变化,明确四种物质.在化合价有升降的元素下用“↑”“↓”标出升或降的数值.
还原剂 氧化剂 氧化产物 还原产物
第二步:根据得失电子守恒,配平四种物质.取变价元素的最小公倍数,确定四种的系数.
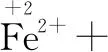
↑1×5 ↓5×1
第三步:根据电荷守恒,配平其它物质.

5×(+2) 1×(-1) X×(+1) 5×(+3) 1×(+2)
左边电荷数:
5×(+2)+1×(-1)+X×(+1)= 9+X
右边电荷数:
5×(+3)+1×(+2)= +17
根据电荷守恒,左右两边电荷相等,X=8,H+前面配8,H2O前面配4.
第四步:根据原子守恒、电荷守恒,査方程式是否配平.
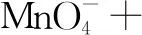
2.逆向配平法:适用范围:①部分氧化还原 ②自身氧化还原(含歧化反应)
第一步:根据化合价的变化,明确四种物质.在化合价有升降的元素下用“↑”“↓”标出升或降的数值.
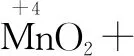
氧化剂 还原剂 还原产物 氧化产物
HCl中有一部分Cl元素生成了Cl2,有一部分还是Cl-,采用逆向配平法.
第二步:根据得失电子守恒,配平四种物质.取变价元素的最小公倍数,确定四种的系数.
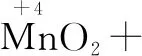
↓2×1 ↑1×2
注意Cl2按照两个Cl元素的变化计算.
第三步:根据原子守恒,配平其它物质.

HCl中有2HCl元素生成了Cl2,有2HCl生成了MnCl2,故HCl前面的系数4,H2O前面的系数是2.
第四步:根据原子守恒,査化学方程式是否配平.
在氧化还原反应的化学(离子)方程式的配平中,最重要的是找到变价的四种物质,可以正向配平(用氧化剂和还原剂配平),也可以逆向配平(氧化产物和还原产物配平),还可以前后配平,即用氧化剂和氧化产物或者还原剂和还原产物配平,只要是变价的两种物质就可以配平.
模块二、新情景下的氧化还原反应的化学(离子)方程式的配平
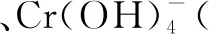
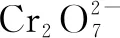
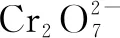
第一步:根据题给信息写出部分反应物和生成物,根据化合价的变化,明确四种物质.

氧化剂 还原剂 还原产物 氧化产物
第二步:根据得失电子守恒,配平四种物质.取变价元素的最小公倍数,确定四种的系数

↓3×2×1 ↑2×3
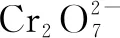
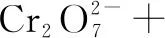
1×(-2) 3×(-1)

2×(+3) 3×(-2)
左边电荷数:1×(-2)+ 3×(-1)+X=-5+X;右边电荷数:2×(+3)+ 3×(-2)=0.根据电荷守恒,左右两边电荷相等,X=5,H+前面配5,H2O前面配4.
第四步:根据原子守恒,电荷守恒,査方程式是否配平
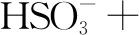
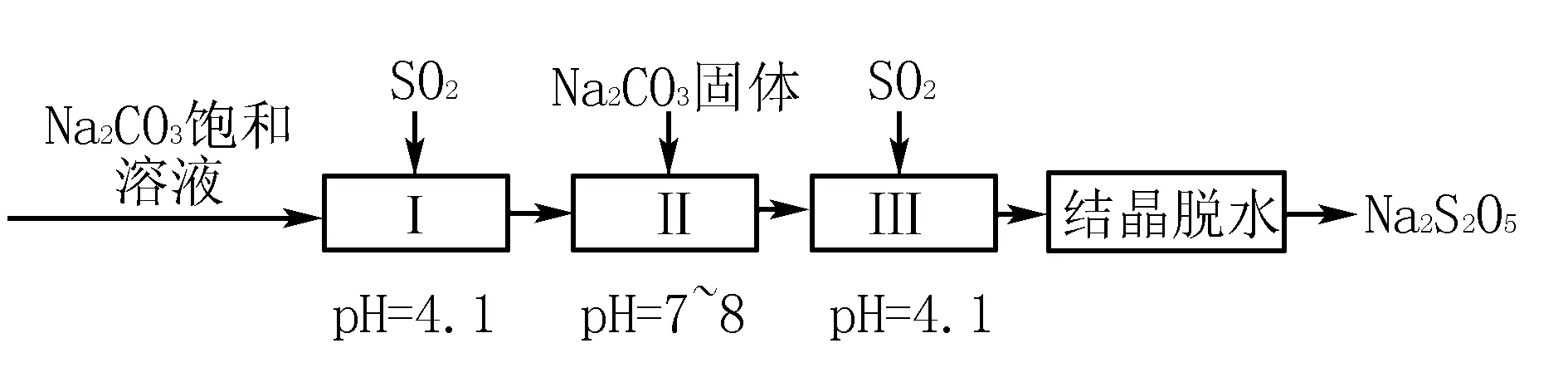
高考题实例剖析2 (2018 年全国卷理综第27题节选) 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛.回答下列问题:
(1)利用烟道气中的SO2生产Na2S2O5的工艺为:
(2)Na2S2O5可用作食品的抗氧化剂.在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL.滴定反应的离子方程式为____.
解析根据题目,Na2S2O5可用作食品的抗氧化剂,说明Na2S2O5具有还原性,作还原剂.实验用 I2标准溶液滴定葡萄酒样品,I2作为氧化剂.要书写滴定反应的离子方程式,可以按照以下步骤进行:
第一步:根据题给信息写出部分反应物和生成物,根据化合价的变化,明确四种物质.
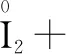
氧化剂 还原剂 氧化产物 还原产物
第二步:根据得失电子守恒,配平四种物质.取变价元素的最小公倍数,确定四种的系数.
2I2+1S2O52-→2SO42-+4I-
↓1×2 ↑2×2
第三步:根据电荷守恒原则,并结合环境的性质判断缺项.题目中制备Na2S2O5的环境是酸性环境,只能在是在生成物边加上H+来配平电荷守恒,反应物配H2O.
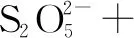
0 1×(-2) 2×(-2) 4×(-1)X×(+1)
左边电荷数:1×(-2)=-2;右边电荷数:2×(-2)+4×(-1)+X×(+1)=-8+X;
根据电荷守恒,左右两边电荷相等,X=6,H+前面配6,H2O前面配3.
第四步:根据原子守恒和电荷守恒,査方程式是否配平
2I2+1S2O52-+3H2O =2SO42-+4I-+6H+
由此可见,在高三复习中,先帮助学生建立氧化还原反应的化学(离子)方程式配平的模型,培养学生的解题思路,指导学生认真读懂题意,利用氧化还原反应规律,结合题目中化学反应的环境,就可以正确快速地书写出新情境下的氧化还原方程式.
二、设计理念
《普通高中新课程方案导读》中提到“教师在以各种表征的方式呈现重要的内容时,应该尽量以强而有力的观念为核心,将其组织成为相互关联的资讯网络,以便学生能以统整的方式来汲取这些内容;教师在讲解与诠释内容时,应该以这些重要的观念及其间的关联为焦点”.以上【模块一】是【模块二】的基础和铺垫;【模块二】内容是【模块一】内容的继续、延伸和拓展.通过【模块二】的设计,学生将【模块一】学到的“四步法”模式深入的理解和应用.高考中新情景下的反应虽然是陌生,但是解题思路是相通的,帮助学生建立解题的模型显得非常重要,这样学生才能够以不变应万变.

