微小RNA-373表达下调对皮肤鳞状细胞癌A431细胞周期和凋亡的影响
夏永华 张彩凤 李敏 刘冬 胡华 张孟杰 程赛
1新乡医学院第一附属医院皮肤科,河南卫辉453100;2新乡医学院第一附属医院消化内科,河南卫辉453100
miRNA-373(miR-373)定位于人类染色体 19q13.4,最初被鉴定为人胚胎干细胞特异性miRNA分子之一[1]。随后研究表明,miRNA-373 的转入能使正常细胞大量增殖并形成肿瘤,且具有癌性大鼠肉瘤病毒癌基因同源基因(rat sarcoma viral oncogene homolog gene,RAS)的特点,被证实为潜在的癌基因[2]。进一步研究显示,miR-373与食管鳞状细胞癌(简称鳞癌)[3]、宫颈癌[4]、乳腺癌[5]和非小细胞肺癌[6]等多种不同的肿瘤发生发展密切相关。我们前期研究发现miR-373 表达下调显著抑制皮肤鳞癌A431 细胞的侵袭,并能显著下调基质金属蛋白酶2(MMP-2)和MMP-9蛋白的表达[7]。为进一步研究miR-373在皮肤鳞癌中的作用,我们采用miR-373抑制剂下调皮肤鳞癌细胞中miR-373的表达,探讨其对细胞周期和凋亡的影响,初步探讨可能的分子机制,为以miR-373为靶点的皮肤鳞癌的靶向治疗提供依据。
一、材料与方法
1.细胞及试剂、仪器:皮肤鳞癌细胞株(A431)来自美国典型培养物保藏中心(ATCC)。miR-373抑制剂(即miR-373互补序列ACACCCCAAAATCGAAGCACTTC)以及阴性对照miRNA为上海吉玛公司产品;脂质体2000转染试剂产自美国Invitrogen 公司;胎牛血清产自美国Gibco公司;实时PCR试剂盒和逆转录试剂盒均来自北京天根生化科技有限公司;胱天蛋白酶3(caspase-3)检测试剂盒来自美国Sigma 公司;流式细胞仪为美国Beckman 公司产品;膜联蛋白V-异硫氰酸荧光素和碘化丙锭均为美国Sigma公司产品。
2.细胞培养、转染及分组:用含10%胎牛血清、100 U/ml链霉素和青霉素的DMEM培养液在37 ℃、5%CO2环境中传代培养A431细胞。细胞处于对数生长期时,采用胰酶消化,计数后接种至6 孔板进行后续实验。将细胞分为3 组:未处理组不接受任何处理,阴性对照组转染阴性对照miRNA,miR-373抑制剂组转染miR-373抑制剂。按照脂质体2000的说明操作,于转染后48 h进行后续实验。
3.实时PCR检测细胞中miR-373基因表达:用Trizol试剂提取各组A431 细胞的总RNA,利用miR-373 和U6 反转录引物按操作说明进行逆转录。miR-373 反转录引物:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTG GATACGACACACCC - 3′ ,U6 反 转 录 引 物 5′ -GTCGTATCCAG TGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAATA-3′,均由上海吉凯生物公司合成。按实时PCR 试剂盒说明书扩增细胞中miR-373 基因,并以U6 基因作为内参。hsamiR-373-3p正向引物5′-GGGAAGTGCTTCGATTTTG-3′,反向引物5′-CAGTGCGTGTCGTGGAGT-3′;U6 正向引物5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物 5′ -CGCT TCACGAATTTGCGTGTCAT-3′。采用2-△△Ct计算miR-373的相对表达量。
4.CCK-8 检测细胞增殖:将3 组A431 细胞制备成单细胞悬液,分别接种于96孔板中(3 000个细胞/孔),每个时间点设置 5 个复孔,分别于培养 24、48、72 和 96 h 时在上述培养孔中加入终浓度为10%的CCK-8试剂,于37 ℃培养箱中继续孵育2 h,最后利用酶标仪测定450 nm 波长处吸光度(A值),并绘制肿瘤细胞的生长曲线。
5.细胞周期分析:转染后48 h收集A431细胞,每组1×106个。离心后用预冷的PBS 漂洗3 次,采用70%冰乙醇于4 ℃固定30 min,结束后用预冷的PBS漂洗3次,将细胞重悬于含40 μg碘化丙锭和100 μg RNaseA的PBS中,于37 ℃孵育30 min。最后采用流式细胞仪检测10 000 个细胞,分析DNA含量。
6.细胞凋亡检测:收集转染后48 h 的细胞,2 000 r/min(离心半径1.4 cm)离心5 min,用预冷PBS 漂洗,计数,按1 × 106/ml 重悬,取100 μl 细胞放置于流式管中,分别加入5 μl 膜联蛋白V-异硫氰酸荧光素和碘化丙锭,避光孵育15 min,采用流式细胞仪检测10 000 个细胞,最后通过CellQuest软件分析凋亡率。
7.比色法检测caspase-3活性:分别将3组A431细胞悬液接种至 96 孔板中,每孔 100 μl(3 × 103个细胞),置于37 ℃、5%CO2培养箱中培养。细胞转染后48 h,根据试剂盒说明加5 μl 5 mg/L caspase-3 酶底物至上述各组培养基中,37 ℃孵育1 h。酶标仪测定A450值,以此表示caspase-3活性。
二、结果
1.miR-373抑制剂显著下调A431细胞中miR-373的表达:实时PCR 检测表明,miR-373 抑制剂组miR-373 的表达水平为0.120±0.036,显著低于未处理组(1.002±0.022)和阴性对照组(1.037 ± 0.028),且差异有统计学意义(F=376.565,P< 0.001;t值分别为36.21、34.83,均P< 0.001);未处理组和阴性对照组之间差异无统计学意义(t=1.702,P=0.164)。
2.miR-373 表达下调抑制A431 细胞增殖:与未处理组和阴性对照组相比,miR-373抑制剂组在48、72和96 h时细胞增殖活性显著降低,且3 组间差异均有统计学意义(F值分别为10.805、13.720 和 30.907,P值分别为0.038,0.010 和0.001),而未处理组和阴性对照组之间差异均无统计学意义(t值分别为0.614、0.049和0.755,P值分别为0.572、0.963和0.492)。见图1。
3.miR-373 表达下调对A431 细胞周期的影响:流式细胞仪检测结果表明,miR-373抑制剂组G0/G1期比例显著高于未处理组和阴性对照组,且差异均有统计学意义(t值分别为15.51、13.24,P值分别为0.000 1、0.000 2)S期比例显著低于未处理组和阴性对照组,且差异有统计学意义(t值分别为18.39、15.76,均P< 0.000 1);G2/M期比例显著低于未处理组和阴性对照组,差异亦有统计学意义(t值分别为6.216、5.141,P值分别为0.003 4、0.006 8)。未处理组和阴性对照组之间G0/G1期、S期、G2/M期细胞比例差异均无统计学意义(t值分别为1.822、0.821、2.169,P值分别为0.143、0.458、0.096)。见图2。
4.miR-373表达下调诱导A431细胞凋亡:miR-373抑制剂组中A431细胞早期凋亡、晚期凋亡和总凋亡的细胞比例均显著高于另外两组(图3),且3组间差异均具有统计学意义(F值分别为279.369、19.775和135.739,均P< 0.01)。未处理组和阴性对照组之间早期凋亡、晚期凋亡及总凋亡细胞比例差异均无统计学意义(t值分别为0.165、0.354 和0.042,P值分别为0.877、0.741和0.968)。
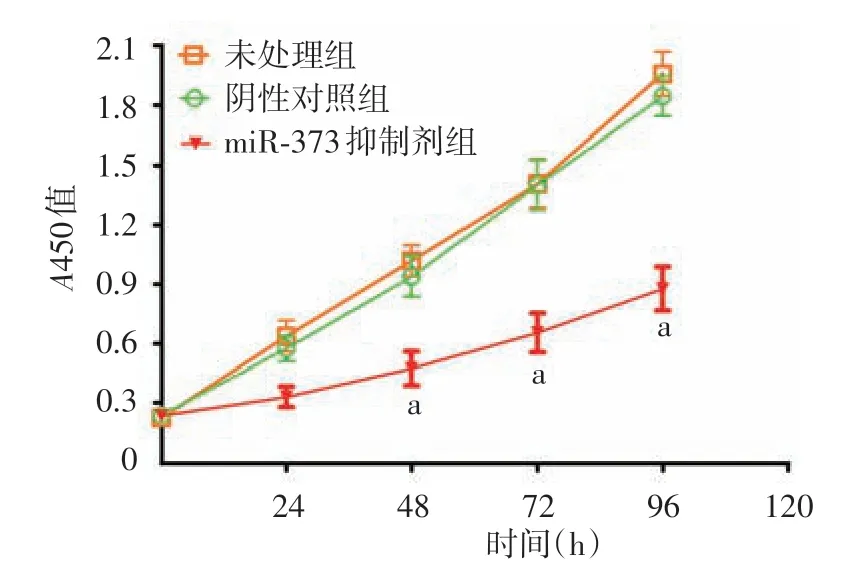
图1 miR-373 表达下调对A431 细胞增殖的影响 a:与未处理组和阴性对照组相比,P <0.05
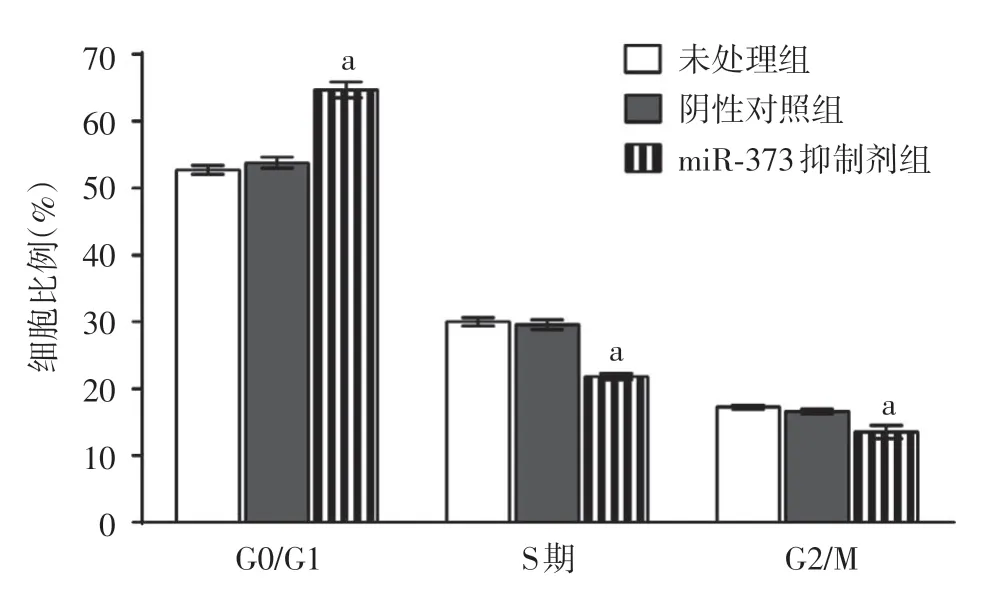
图2 各组A431细胞周期分布比较 a:与未处理组和阴性对照组相比,均P <0.01
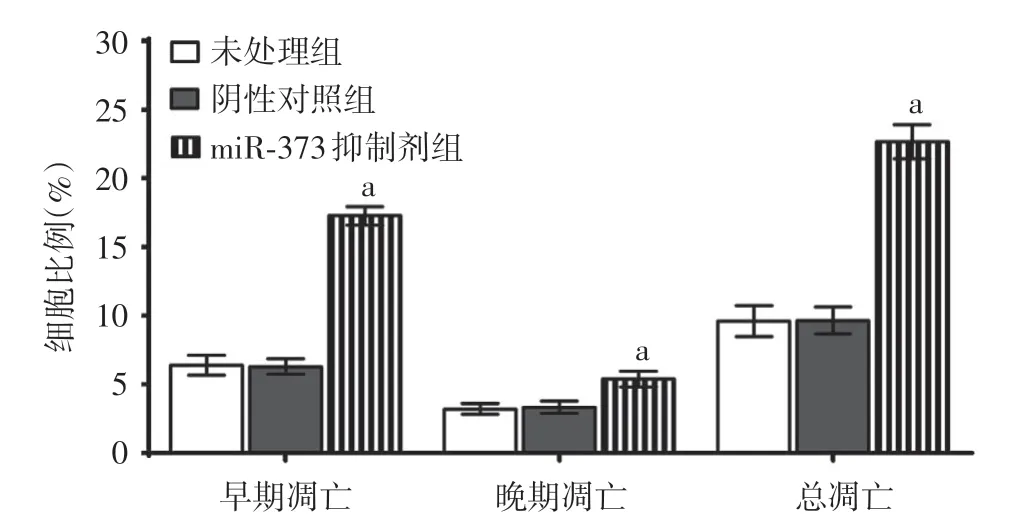
图3 不同处理组A431 细胞早期凋亡、晚期凋亡和总凋亡细胞比例比较 a:与未处理组和阴性对照组相比,均P <0.01
5.miR-373 表达下调对A431 细胞caspase-3 活性的影响:miR-373 抑制剂组caspase-3 活性为(1.238 ± 0.057),显著高于未处理组(0.413 ± 0.028)和阴性对照组(0.437 ±0.036),且差异有统计学意义(F=123.392,P< 0.05;t值分别为12.87、11.84,P值分别为0.000 2、0.000 3),而未处理组和阴性对照组间差异无统计学意义(t=0.519,P=0.631)。
三、讨论
研究表明,miRNA 介导的转录调控涉及肿瘤调控中的每一个环节,异常miRNA 表达与肿瘤细胞生物学过程密切相关,如凋亡逃避、增殖、转移和化疗抗性[8-9]。在这个过程中,一些miRNA 发挥癌基因的功能,而另一些扮演抑癌基因的作用[10]。类似地,miR-373在不同肿瘤中的作用也不尽相同,如在食管鳞癌[3]、宫颈癌[4]和胃癌[11]等肿瘤中发挥癌基因的功能,而在胆管癌[12]、结肠癌[13]和胰腺癌[14]等肿瘤中发挥抑癌基因功能,这可能与其靶向作用的基因不同相关。然而,迄今为止,miR-373在皮肤鳞癌中的功能尚不清楚,为了探讨其作用,我们在前期研究中检测人永生化上皮细胞(HaCaT细胞)和皮肤鳞癌细胞株中miR-373的表达,发现皮肤鳞癌细胞株中miR-373的表达水平均显著高于HaCaT细胞[7],提示miR-373 可能在皮肤鳞癌中发挥癌基因的功能,因而其可能成为皮肤鳞癌潜在的分子治疗靶点。
Tanaka等[13]研究发现,miR-373的表观沉默在结肠癌细胞增殖中发挥抗增殖作用,这种作用可能与调控癌基因RAB22A的表达相关。此外,miR-373的过表达增加胃癌细胞的增殖潜能,这可能与肿瘤坏死因子α诱导蛋白1的表达水平下调密切相关,肿瘤坏死因子α诱导蛋白1的过表达可减弱miR-373抑制剂对胃癌细胞的抑制能力[11]。上述研究表明,miR-373在调控肿瘤增殖中具有重要的价值。本研究中我们也发现,miR-373 表达下调可显著抑制皮肤鳞癌A431 细胞的增殖,并且提高A431 细胞在G0/G1 期的比例,但降低S 期和G2/M 期细胞比例,提示miR-373 可能在皮肤鳞癌增殖调控中发挥重要作用。未来尚需通过实验进一步证实miR-373 调控的靶基因在皮肤鳞癌增殖中的作用,从而为miR-373的临床转化奠定基础。
miRNA 与肿瘤细胞凋亡密切相关,有些被鉴定为促凋亡miRNA[15],而有些发挥抑制凋亡的作用[16]。为了进一步阐明miR-373 与皮肤鳞癌细胞凋亡的关系,我们采用流式细胞仪分析不同处理组之间细胞凋亡的变化。结果显示,抑制miR-373表达显著诱导细胞凋亡,提示miR-373在皮肤鳞癌中属于抗凋亡的miRNA分子。进一步研究表明,miR-373表达下调与caspase-3 活性升高密切相关,这可能是miR-373引发皮肤鳞癌细胞凋亡的可能分子机制。
总之,本研究结果表明,miR-373 表达下调可显著抑制皮肤鳞癌细胞的增殖,改变细胞周期分布和诱导细胞凋亡,其凋亡诱导作用可能与caspase-3活性升高有关。这些研究初步提示,miR-373可能在调控皮肤鳞癌细胞增殖、周期和凋亡中发挥关键作用,未来miR-373 可能成为皮肤鳞癌潜在的分子治疗靶点。本研究尽管提示miR-373在皮肤鳞癌中的初步作用,但尚需进一步阐明miR-373 在皮肤鳞癌中的靶点,从机制上阐明其在皮肤鳞癌发生发展中的作用,为以miR-373为靶点的治疗奠定基础。
利益冲突所有作者均声明不存在利益冲突

