对川崎病患儿静脉注射丙种球蛋白耐药临床预测模型建立的质疑
谢丽萍 龚 娟 富 洋 何 岚 储 晨 严卫丽 黄国英 刘 芳
川崎病(KD)是一种病因不明的全身非特异性血管炎。目前已成为儿童获得性心脏病的首要病因。IVIG联合阿司匹林可降低冠状动脉(冠脉)瘤的发生率[1]。但有10%~20%的KD患儿对首剂IVIG不敏感,其发生冠脉病变的风险显著增高[2-4],尽早识别这类患儿并予以积极治疗十分重要。
多年来,许多国家和地区的学者通过分析KD患儿的临床资料,或建立了IVIG耐药的临床预测模型,但敏感度和特异度达不到临床预期(≥80%)[5-9],或在不同人群的验证中预测效果不佳[10-15],或缺乏不同人群的验证[16-18]。基于此提出假设,以临床症状、体征实验室检查指标不能建立KD患儿IVIG耐药特异度和敏感度均≥0.80的预测模型。
1 方法
1.1 研究设计 回顾性收集经复旦大学附属儿科医院(我院)首次诊断和治疗的KD病例,全样本人群按7∶3比例随机分为建模组和验证组,通过单因素及多因素Logistic回归分析建立IVIG耐药预测模型,并行验证,将KD患儿按性别、年龄、发热天数、KD类型等分层,在不同的分层中单独建模和验证;基于全样本人群验证已发表的IVIG耐药预测模型,考察通过临床症状、体征和实验室指标是否有达到临床预期的预测KD患儿IVIG耐药模型。
1.2 样本量 采用NCSS PASS 11.0.8软件计算最低样本量。取α=0.05,power=0.9,敏感度和特异度均为0.75,IVIG耐药率按8%计算(上海市2013至2017年IVIG耐药率为8%),需IVIG耐药组最低样本量42例,IVIG敏感组最低样本量483例。
1.3 KD诊断标准及定义 依据2017年美国心脏协会(AHA)发布的KD诊断标准[19]。冠脉病变:<5岁儿童冠脉内径≥3 mm,≥5岁儿童冠脉内径≥4 mm;或冠脉内径>邻近节段1.5倍[20];或冠脉的z值>2.0[19,21]。
1.4 IVIG耐药标准 接受首剂IVIG治疗后36 h仍有发热或退热后重新发热,需要第2剂IVIG或其他挽救治疗[19]。
1.5 KD诊治流程 我院KD住院患儿均集中在心内科病房,由心血管专科医生依据AHA发布的KD指南[19]进行标准治疗和评估。患儿诊断为KD后,予以标准治疗(2 g·kg-1IVIG静脉持续滴注12~24 h,并口服阿司匹林30~50 mg·kg-1·d-1,q 8 h)。通过体温测量检测IVIG是否耐药,每日至少每6 h测1次腋温。IVIG输注结束后每3 d复查1次CRP及血常规,直至CRP恢复正常。热退≥3 d及CRP恢复至正常时,阿司匹林减量至3~5 mg·kg-1·d-1,根据有无冠脉病变决定阿司匹林口服时间及是否加用其他抗栓药物治疗。IVIG耐药患儿依据病情予第2剂IVIG、或激素、或英夫利昔、或以上二种药物联合治疗。所有患儿在出院前(约病程2周)、出院后2周(约病程1个月)、出院后6周(约病程2个月)行超声心动图检查。
1.6 纳入标准 ①从我院HIS系统中检索2013年1月1日至2017年12月30日出院诊断中包括“川崎病”或“黏膜皮肤淋巴结综合征”的患儿;②发病≤10 d(以发热为起病)并接受标准治疗的患儿。
1.7 排除标准 ①KD冠脉后遗症期病例(病程>1个月,入院仅为评估和治疗冠脉后遗症);②首剂IVIG剂量为1 g·kg-1,或剂量不规则,或未使用IVIG;③首剂IVIG应用时发病>10 d;④未同时服用阿司匹林;⑤在外院已经进行KD治疗,因各种原因转入我院继续治疗;⑥发病前2周内、发病后或应用首剂IVIG同时给予激素或其他免疫抑制剂治疗;⑦合并严重感染(如败血症、细菌性脑膜炎、细菌性肺炎、水痘、流感等)或有免疫缺陷性疾病(如HIV、肿瘤等);⑧既往有KD病史。
1.8 临床信息采集及定义 由一人逐份阅读病历并提取:①性别、发病年龄;②临床症状和体征包括:发热、双眼结膜充血、多形性皮疹、口腔改变、四肢改变、颈部淋巴结肿大、肛周脱皮及卡疤红肿;③应用首剂IVIG时的发热天数、是否IVIG耐药;④实验室检查包括:首次IVIG治疗前的CRP、ESR、PLT、WBC、N%、Hb、血清白蛋白(ALB)、ALT、AST、肌酸激酶同工酶(CK-MB)、Na+、血清总胆红素(TB);IVIG应用前多次行实验室检查者,CRP、ESR、WBC、N%、ALT、AST、CK-MB和TB取最高值,PLT、Hb、ALB和Na+取最低值;⑤采集发病≤30 d的二维超声心动图检测结果,截取是否发生冠脉病变和相应的冠脉测值(冠脉内径绝对值和z值),期间多次行心超者取z值最大的一次结果。
1.9 分组 依据是否耐药,分为IVIG耐药组和敏感组;IVIG耐药组和敏感组分别以7∶3的比例,由Microsoft Excel的随机函数产生,随机数由小到大排列,前70%的患儿入建模组,余30%患儿入验证组,IVIG耐药和敏感组的建模亚组统称为建模组,IVIG耐药和敏感组的验证亚组统称为验证组。
1.10 分层 根据现有的不同KD预测模型中客观的临床表现和不完全KD表现[19],本文行性别、发病年龄、首剂IVIG使用时发热天数和KD类型分层分析。此外,针对建模组IVIG耐药多因素回归分析中有意义的实验室指标也纳入分层分析。
1.11 IVIG耐药预测模型检索 在PubMed、中国知网检索已发表的KD患儿IVIG耐药预测模型的相关文献,检索日期:2000年1月1日至2019年7月8日。英文检索式:(((kawasaki disease[Title] OR mucocutaneous lymph node syndrome[Title])) AND (resistance[Title/Abstract] OR nonresponse[Title/Abstract] OR refractory[Title/Abstract] OR unresponsiveness[Title/Abstract])) AND (prediction OR scoring OR sensitivity OR specificity OR screening);共检索到167篇文献,通过阅读标题和摘要筛选出KD患儿IVIG耐药预测相关文献共14篇,排除预测二次耐药1篇、预测对1 g·kg-1IVIG耐药1篇、因包含体温、心率等不确定性指标,排除3篇;9篇[5,16,17,22-27]报告了KD患儿IVIG耐药预测模型。中文检索式:(川崎病 or 黏膜皮肤淋巴结综合征) and (耐药 or 无反应 or 不敏感 or 抵抗 or 难治性) and (预测 or 评分 or 敏感度 or 特异度 or 筛选);共检索到34篇文献,其中IVIG耐药预测相关文献3篇,排除使用IVIG治疗后实验室检查作为预测指标1篇,余2篇[18, 28]为KD患儿IVIG耐药预测模型。中英文共11篇预测模型文献进入本文评价分析。

2 结果
2.1 一般情况 符合本文纳入标准的KD患儿1 953例,经排除筛选后1 360例纳入本文分析(图1)。男875例(64.3%),女485例;年龄中位数1.8(0.9,3.2)岁;IVIG耐药组和敏感组分别为171和1 189例;建模组和验证组分别为952和408例。
2.2 建模组与验证组基线数据 表1显示,建模组和验证组基线数据(一般信息、不完全KD比例、应用首剂IVIG时的发热天数、是否IVIG耐药、实验室指标、冠脉病变率),差异均无统计学意义(P>0.05)。
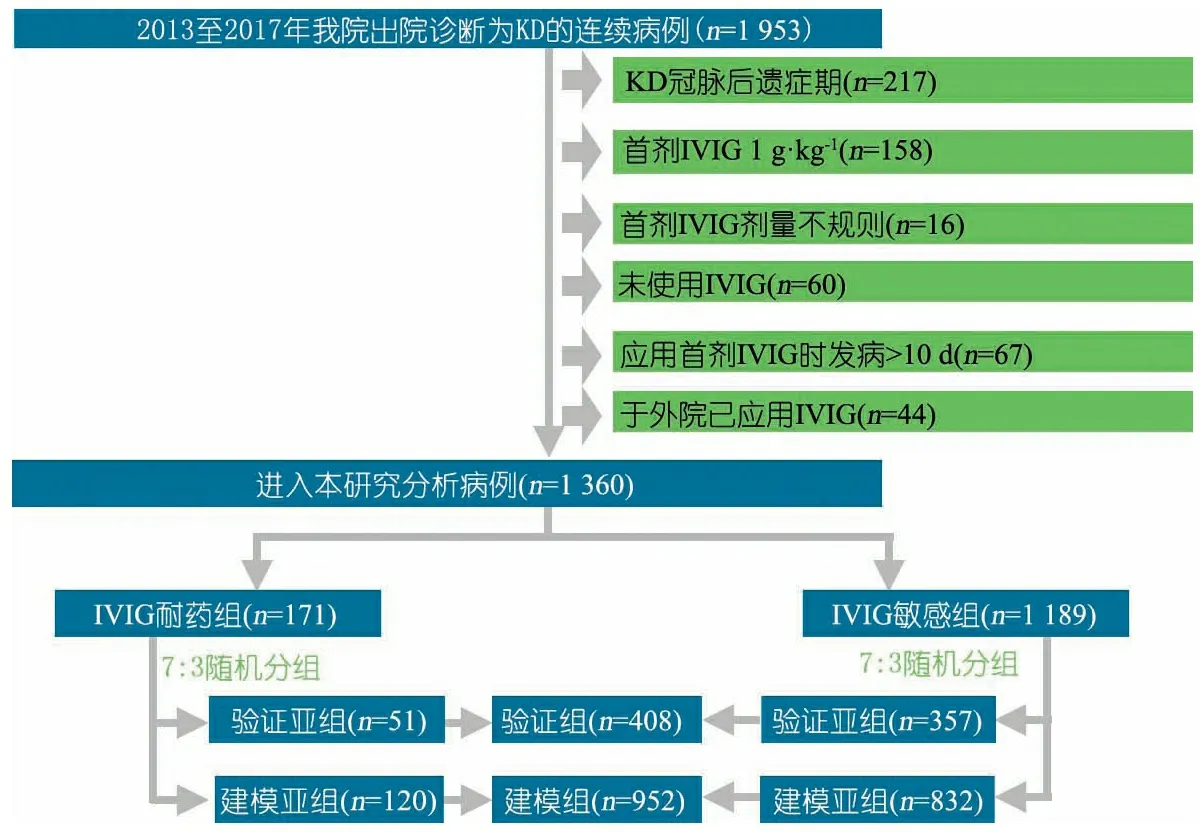
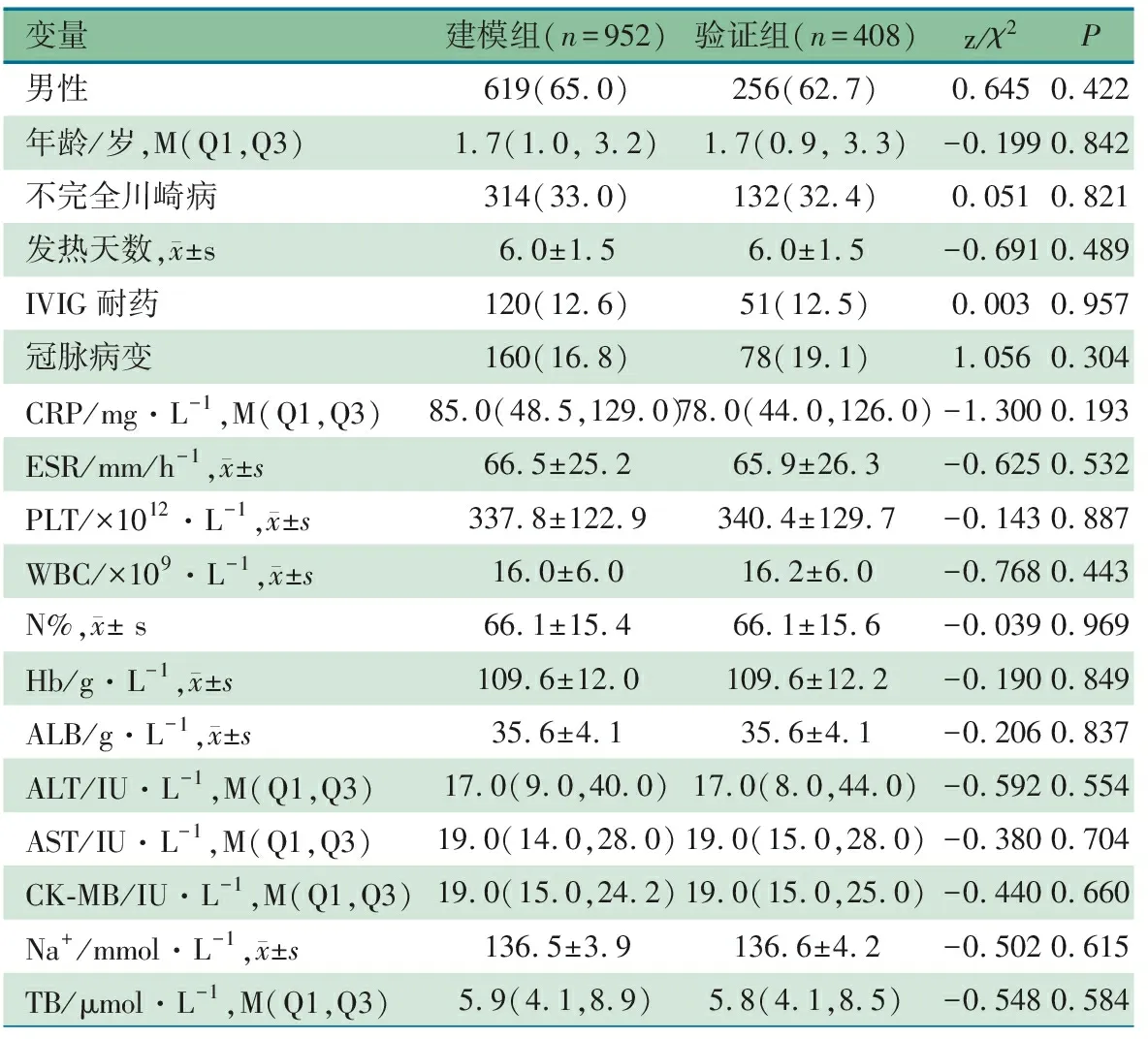
图1 研究对象纳入和排除流程图
2.3 建模组IVIG耐药模型的建立 总结归纳11个已发表的KD预测模型[5,16-18,22-27]中的危险因素行单因素分析,表2显示,在IVIG耐药组和敏感组中,男性、发病年龄、应用首剂IVIG时发热天数、多形性皮疹、颈淋巴结肿大和除CK-MB以外的11项实验室指标差异均有统计学意义(P<0.05)。
将单因素分析有意义的变量行多因素logistic回归分析,表3显示,男性、发病年龄、应用首剂IVIG时发热天数、N%、Hb、ALB和Na+是IVIG耐药的危险因素。其中,连续性变量根据ROC曲线确定的界值转换为二分类变量,界值分别为发病年龄2岁、应用首剂IVIG时发热天数5 d、N% 0.75、Hb 110 g·L-1、ALB 34 g·L-1、Na+133 mmol·L-1。在建模组中该评分系统的AUC为0.818(95% CI:0.774~0.861),根据最大约登指数确定界值≥5分时,敏感度为0.767,特异度为0.726(图2A)。
2.4 IVIG耐药模型验证 在验证组中,该评分系统的AUC为0.777(95% CI:0.712~0.842),≥5分时敏感度为0.627,特异度为0.776(图2B)。
2.5 分层建立评分系统 基于建模组IVIG耐药多因素回归分析有意义的变量和 KD类型(完全性/不完全性KD)行分层,建立各自的评分系统,各评分系统在建模组和验证组的敏感度和特异度见表4。建模组敏感度0.417~0.875,特异度0.541~0.903;验证组敏感度0.290~0.850,特异度0.401~0.940,无敏感度和特异度均≥0.80。
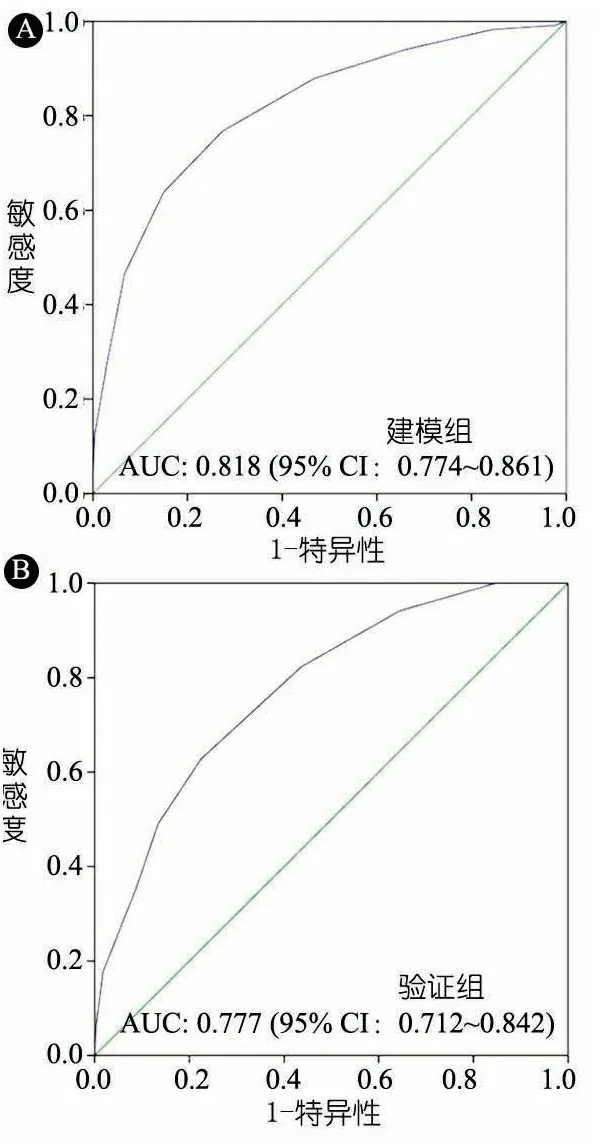
图2 建模组和验证组IVIG耐药预测模型ROC曲线
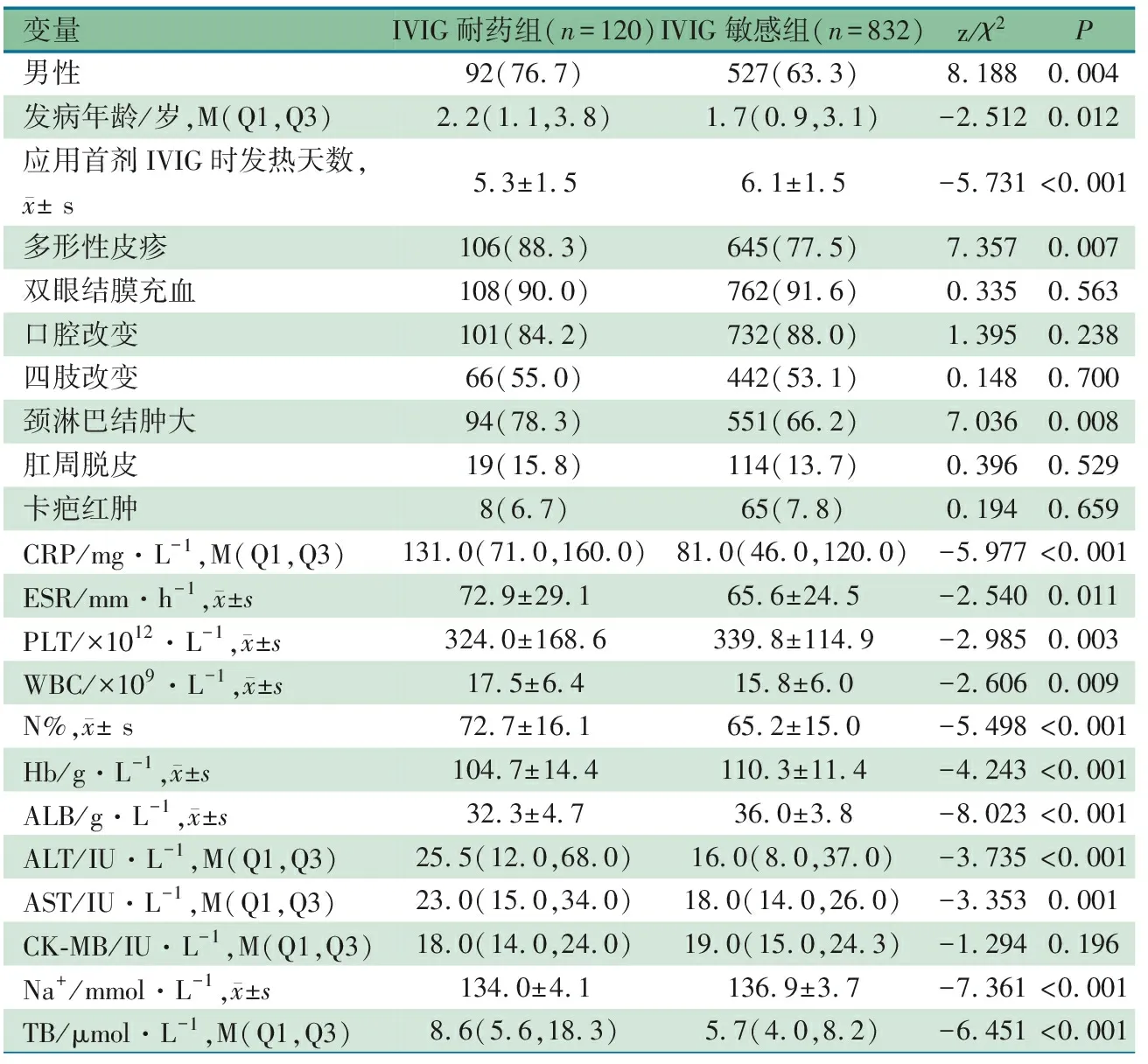
表2 建模组IVIG耐药单因素分析[n(%)]
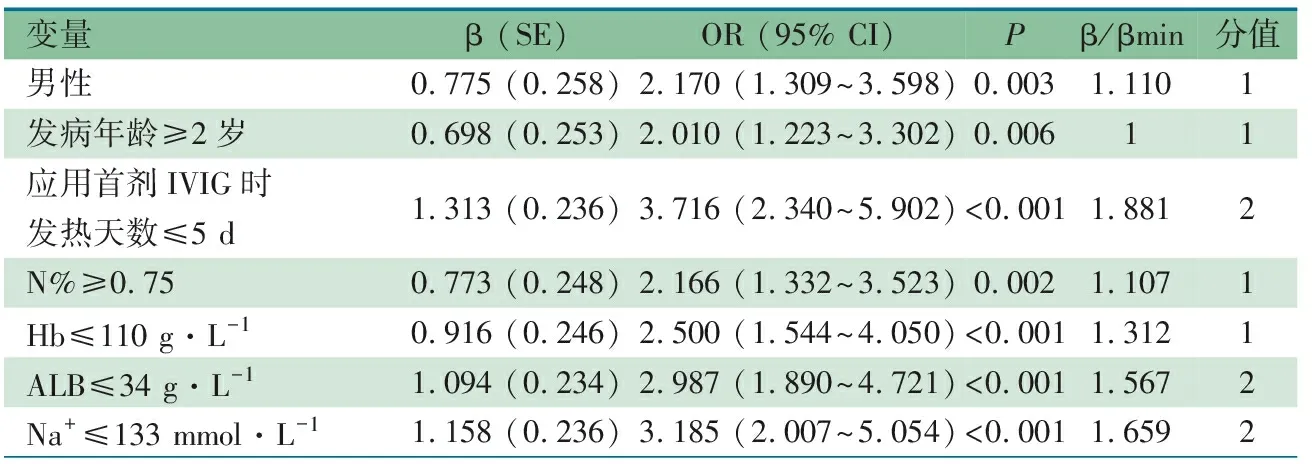
表3 建模组IVIG耐药多因素回归分析

表4 不同分层内IVIG耐药评分系统预测效果评价
2.6 11种评分系统IVIG耐药预测模型的验证 基于我院全样本人群验证11个已报道的IVIG耐药预测评分,敏感度0.272~0.799,特异度0.412~0.926,无敏感度和特异度均≥0.80的预测模型,而且与建模时相差很大(表5)。

表5 11个评分系统的内容及在我院研究对象中的验证结果
注 1)来自于不同研究的预测界值
3 讨论
多项研究显示IVIG耐药的KD患儿发生冠脉病变的风险显著增高[2-4]。日本一项随机临床对照试验证实IVIG耐药高风险人群在初始治疗中联合应用小剂量激素和IVIG,其冠脉病变率可由23%降至3%[29]。因此,如何筛选出IVIG耐药高风险患儿并给予更积极的治疗一直是临床关注的焦点。目前,基于临床症状、体征和实验室检查建立的IVIG耐药预测评分相关研究较多,但均未达到建模和验证时敏感度和特异度均≥0.80的临床预期。
我院住院KD患儿的治疗集中于心内科病房,采用一致的、规范的诊断标准及治疗方案[19]。本文的研究对象从2013至2017年我院出院诊断为KD的连续病例中严格筛选,纳入的研究对象均为在首次诊断和治疗的、发病10 d内接受2 g·kg-1IVIG及阿司匹林治疗的KD患儿,同质性较好。本研究基于我院952例建模组KD患儿资料建立了新的预测评分系统,包括7个预测指标:男性(1分),发病年龄≥2岁(1分),应用首剂IVIG时发热天数≤5 d(2分),N%≥0.75(1分),Hb≤110 g·L-1(1分),ALB≤34g·L-1(2分),Na+≤133 mmol·L-1(2分)。当总分≥5分时,敏感度为0.767,特异度为0.726。但在我院另外408例验证组KD患儿的验证中,敏感度仅为0.627,特异度为0.776。本研究分层建立的16个预测模型的预测效果同样达不到临床期望效果。仅男性、发病年龄≥2岁、完全性KD、不完全KD、N%<0.75、Hb≤110 g·L-1和Hb>110 g·L-1分层预测模型在建立组中敏感度和特异度均≥0.70,但验证组中敏感度0.500~0.659,特异度0.692~0.832。无敏感度和特异度均≥0.80的预测模型。
本研究对11个已发表的预测评分进行评价,包括日本地区5个和中国地区6个(北京2个,重庆2个,苏州1个及台湾1个)。基于日本人群数据建立的Kobayashi、Egami及Sano评分是日本应用较多的评分体系[25-27],日本人群中敏感度0.77~0.86,特异度0.68~0.86。然而,这3个评分在韩国人群、北美人群、德国人群中敏感度仅0.23~0.42,特异度0.74~0.92[10, 13, 14]。在中国北京、重庆、苏州和台湾地区人群中敏感度0.207~0.620,特异度0.710~0.957[16-18, 24]。与此类似,本研究显示这3个评分及后来建立的2个日本预测评分在上海地区人群中敏感度为0.272~0.509,特异度0.829~0.926,均与临床预期相差甚远。
基于中国台湾、苏州、重庆和北京地区人群建立的IVIG耐药预测评分中,仅台湾地区的预测评分敏感度和特异度均≥0.80,但其病例数仅有203例(22例耐药),且其自身用67例病人验证时敏感度亦降至0.71;其余评分无敏感度和特异度均≥0.80[5, 16-18, 24, 28]。目前,国内建立的预测评分仅有少量不同地区的人群验证。肖蘭等[28]研究显示在重庆地区人群中,台湾[17]和苏州[16]地区的预测评分敏感度0.753~0.827,特异度0.183~0.286,而北京地区[24]的预测评分敏感度0.519,特异度0.660。本研究显示国内6个预测评分在上海地区人群中敏感度0.509~0.709,特异度0.441~0.789,无敏感度和特异度均≥0.80的预测评分。
在本研究及国内外其他研究中建立的IVIG耐药预测评分的人群验证中,无任何预测评分的敏感度和特异度均≥0.80。现有研究显示,基于KD患儿临床资料建立的IVIG耐药评分系统,在不同种族人群之间、同一种族不同地区的人群之间、甚至在同一医院诊治的不同人群中都无法适用。由此推论,基于现有的临床表现和基本实验室指标,难以建立临床适用的KD患儿IVIG耐药预测模型。可能原因如下:
第一,KD表现的是一组临床综合征,其病因和发病机制均不清楚,且大剂量IVIG治疗KD的作用机制亦不清楚,因此尚无特异性实验室检查可以诊断KD和预测IVIG耐药。对本研究多因素回归分析中的4项预测指标(N%、Hb、ALB、Na+)进行IVIG耐药的ROC曲线分析,各指标预测IVIG耐药的AUC为0.614~0.738,根据最大约登指数确定相应界值,敏感度0.544~0.651,特异度0.543~0.751,预测价值有限。因此,单凭现有的非特异性的实验室指标和临床表现可能很难得到达到临床预期的预测模型。
第二,IVIG不同的生产工艺可能也与IVIG耐药有关。Tsai等[30]分析台湾地区使用了3种不同工艺的IVIG的KD患儿,发现β-丙内酯酶法和酶解法生产的IVIG比酸化法生产的IVIG更容易导致IVIG耐药(13%vs11%vs1%,P=0.001)。Lin等[31]研究3 830例台湾KD患儿,同样发现应用β-丙内酯酶法生产的IVIG的KD患儿有着更高的耐药率(相对危险度为1.45,95% CI:1.08~1.94)。这些研究提示IVIG生产工艺可能与IVIG耐药有关。本研究中KD患儿所用的IVIG均为中国生产且制备工艺均为酸化法(pH 4.0),但涉及5个生产厂家。尽管工艺相同,仍然无法排除不同生产厂家对其疗效的影响。
第三,遗传因素可能也是影响IVIG耐药的重要原因之一。Kuo等[32]在台湾人群中发现Fc受体家族基因中的FCGR2A基因的甲基化水平与IVIG耐药相关。FCGR2A基因启动子区CpG岛甲基化水平显著降低的KD患儿,其编码的激活性受体FcγR IIA显著增加,与更多IgG的Fc段结合,进而激活异常的免疫反应导致IVIG耐药的发生。Shrestha等[33]在白种人群中发现FCGR3B基因的多态性与IVIG耐药相关。该基因的两个SNP位点rs403016和rs447536的多态性导致编码产生两种不同的Fc受体NA1和NA2。携带NA1等位基因的KD患儿,其编码的NA1受体对IgG亲和力更高,更容易结合IgG而引发异常免疫反应,增加IVIG耐药的风险。这些研究提示表观遗传和基因多态性可能影响着个体IVIG耐药的发生。因此,需对KD 中IVIG耐药和敏感患儿进行更多大样本的遗传方面研究,探讨遗传因素本身或遗传因素结合临床指标对IVIG耐药的预测作用。
本研究局限性。近年研究新发现的可能与IVIG耐药相关的免疫学指标,如IL-1和6、肿瘤坏死因子-α、血管细胞黏附分子、降钙素原、N末端B型利尿钠肽等[34-36],以及部分凝血指标如D-二聚体[37],未纳入本研究预测变量的分析中。但这些免疫学指标亦为非特异性。
综上所述,基于KD患儿现有的临床表现和实验室检查的资料,无法建立达到临床适预期的IVIG耐药预测评分系统。鉴于KD发病及IVIG耐药均有很强的遗传倾向,探索与IVIG耐药有关的遗传因素并建立适用于临床早期应用的快速检测方法是以后研究的重点。

