特殊人群的疼痛药物治疗管理
——早产儿及新生儿的疼痛用药
覃旺军 邓 昂,2△
(1中日友好医院药学部,北京100029;2冀药师健康管理有限公司,北京100125)
疼痛是医务人员接触最多的临床主诉和症状。随着疼痛临床诊疗技术的飞跃发展,更多的医务人员开始重视疼痛及疼痛相关疾病的诊疗及药物治疗管理。但对以早产儿、新生儿、儿童、老年人、妊娠及哺乳期女性为主的特殊人群的疼痛问题,如何进行安全有效的疼痛药物治疗管理,仍然是医务人员所面临的一大难题。本文将针对早产儿和新生儿这一特殊人群的疼痛药物治疗管理进行探讨。
一、早产儿及新生儿相关疼痛的产生机制及临床影响
随着对早产儿、新生儿在神经生物学和临床医学的研究不断深入,目前已经能够证实,胎儿以及新生儿对外界的刺激能够产生疼痛反应,而这些疼痛反应可能导致患儿经历急、慢性疼痛。胎儿及新生儿可以通过一系列复杂的生物化学、生理学和行为改变,对这些有害的刺激做出痛觉反应。但胎儿、早产儿及新生儿的疼痛是一个复杂的,多层次的反应现象,不同的疼痛来源和不同类型的疼痛可能涉及各种受体组合和发育中的神经系统内的不同机制[1]。
胎儿及新生儿的疼痛仍然可简单归类为生理性、炎症性、神经性或内脏相关疼痛,但是对这些不同类别的疼痛,还可以进一步根据疼痛严重程度细分并且深入评估。胎儿及新生儿疼痛可以引发一系列神经生物学变化,这些变化涉及并激活疼痛调制系统,对疼痛信号的传导和调制产生影响。如果疼痛延长或重复,就可能会引发疼痛系统的调控异常,例如可能导致脊髓水平的信号加工改变,这些不良经历进而改变大脑发育和后续行为的变化。这些疼痛刺激进一步引发异常的神经生理状态,如原发性和继发性痛觉过敏,如果刺激加剧持续,甚至导致神经病理性疼痛的产生[2]。因此对于胎儿及新生儿的有效的疼痛管理、积极控制疼痛体验对患儿短期或长期的结果都是有益的。然而,由于对在早产儿和足月新生儿神经系统成熟的关键阶段控制疼痛及其长期后遗症的必要性缺乏认识,很少采取有效的疼痛控制措施。
尽管我们了解所有婴幼儿都会感到疼痛,但对于正常新生儿来说,疼痛仅限于临床常见的刺激性操作,如足跟采血针穿刺、静脉穿刺选、肌肉注射等。而对于早产儿,他们可能反复暴露于重复的程序性疼痛,包括手术造成的广泛组织损伤,或放置用于机械通气的气管插管的侵入性操作[3]。在被收入新生儿重症监护病房(neonatal intensive care unit, NICU)的婴儿中,疼痛感最为常见,且感受最强烈。基于上述的认知,无论是从人文关怀还是遵从患儿家属的要求,目前的国内外共识都趋向认为,医务人员应该积极的治疗或预防早产儿和足月新生儿可能面对的疼痛问题。
二、国外早产儿及新生儿镇痛诊疗的进展和我国的现状
早在2003年2月,美国食品药品监督管理局(Food and Drug Administration, FDA)和美国国家卫生研究院(National Institutes of Health, NIH)成立了一个国际性的新生儿疼痛控制组,以评估新生儿疼痛领域的知识状况。新生儿疼痛控制组定期开会讨论临床试验、药物治疗优先次序、伦理约束、知识差距和未来研究需求。该小组编写了3个主题方面的手册,建立了减轻新生儿疼痛的处理原则:①与侵入性手术相关的疼痛管理;②机械通气期间的镇静和镇痛;③减轻新生儿手术期间和手术后的疼痛和应激反应。这些原则为开展新生儿疼痛处理指明了方向。之后不久,在2004年3月由FDA和NIH召开的 “新生儿药物开发倡议”会议上,这些手册原则得到了进一步的讨论。与会专家对该手册进行了审查和评论,讨论也涉及了新生儿疼痛控制和临床试验设计问题各个领域的信息。在此之后,更多的关于早产儿及新生儿疼痛的问题受到了广泛的关注,相关的基础研究以及临床研究也逐步开展。2008年法国的一项前瞻性研究发现[4],在会产生疼痛的治疗操作前,仅有20.8%的婴儿接受了镇痛治疗,79.2%的婴儿没有得到相应的镇痛处理,而且这一比例在不同医疗机构内之间的差异巨大。
2009年意大利新生儿学会(the Italian Society of Neonatology)发布了新生儿镇痛指南,其理念与世界卫生组织 (World Health Organization, WHO) 对成人疼痛控制的三阶梯镇痛法相似[5],都认为对于早产儿及新生儿的疼痛治疗应基于评估,采取阶梯式干预管理模式,进一步奠定了评估疼痛和推行阶梯式镇痛管理模式的基础。
2016年美国儿科学会和加拿大儿科协会(American Academy of Pediatrics and the Canadian Pediatric Society, AAP/CPS) 发布的指南更新推荐,每个治疗新生儿的医疗机构都应建立新生儿疼痛控制计划[6]。这些推荐意见包括:常规评估以发现疼痛、减少疼痛性操作的次数、预防/减少床旁侵入性操作所致急性疼痛、在手术后预测到可能出现术后疼痛并对其给予治疗、新生儿重症监护期间应避免慢性疼痛/应激。
相比于国外而言,我国的早产儿及新生儿相关疼痛的诊疗严重滞后,主要表现在:缺乏对早产儿新生儿疼痛感受的认识;临床诊疗过程中缺乏有效应对的管理团队和标准操作规程;对特殊人群疼痛药物治疗的管理缺失;针对特殊人群疼痛治疗风险的识别应对不足。尽管中华医学会麻醉学分会儿科麻醉学专业组的专家发表了《小儿术后镇痛专家共识(2017版)》[7],为小儿术后疼痛的评估和治疗提供了推荐意见,但是在新生儿及早产儿的治疗领域中,还缺乏标准和统一的管理规范和指南。目前国内尚缺乏大样本、高质量的关于早产儿及新生儿疼痛诊疗相关的流行病学调查,加之我国普通大众对于疼痛管理的认知严重不足,对疼痛药物治疗管理的意识淡薄,医疗机构往往忽视对早产儿和新生儿的疼痛管理。
国内的疼痛药物治疗管理方面,由于疼痛专科临床药师数量稀少,管理方向集中偏向成人术后镇痛、慢性非癌痛以及癌痛方向等原因[8],疼痛药师在早产儿及新生儿疼痛管理方面的关注不足。另外,针对于早产儿及新生儿疼痛药物治疗管理方面的标准规范及临床实践相对缺乏,这也是药师在进行临床干预管理和用药指导方面所面临的一大困境。
三、早产儿及新生儿疼痛诊疗中的误区和问题
尽管医学界早就了解早产儿及新生儿对外界的反应,但是对于新生儿对疼痛的反应仍存在较多的认知误区。尤其是医疗环境和专业知识更新不足的情况下,仍有较多的医务人员认为新生儿对疼痛的反应不足,常见的误区包括:一是认为因为神经系统发育不成熟,新生儿对外界的痛觉刺激不能有效传导到大脑;二是认为新生儿的丘脑和皮层之间的联系尚未发育成熟,痛的知觉难以定位于大脑皮层;三是认为新生儿没有识别疼痛的心理场景,不能够充分体验痛觉。这些误区的存在直接导致了医务人员忽视早产儿及新生儿对痛觉的感受,在刺激性/侵害性操作过程中无法及时采取有效的疼痛干预措施。而事实上,早产儿及新生儿都可以对有害刺激产生应激和疼痛反应[9],在妊娠中晚期,胎儿已经有高度分化和功能完整的感觉系统。此外光学神经影像学检查的证据也显示,早产儿在暴露于刺激之下,大脑躯体感觉区域的皮质电生理活动明显增加[10]。
对新生儿的疼痛评估也存在问题。无法和新生儿进行直接有效的沟通是最主要的困扰。基于疼痛评估的“金标准”一直是以自我报告为核心的主观评价体系,而新生儿则无法进行主观报告其反应及感受。事实上,大量研究证明新生儿对疼痛的反应可以从自主神经系统反应(如心率加快、血压升高)、激素水平波动(如皮质醇及儿茶酚胺的升高)、行为变化(面部表情变化、哭闹及规避性反应)等方面得到体现[11],而这些反应正是建立对早产儿及新生儿进行急性疼痛评估工具的基础。
四、早产儿及新生儿疼痛的药物治疗管理策略
1.早产儿及新生儿的疼痛评估工具
从疼痛专科临床药师的角度来看,早产儿及新生儿疼痛药物治疗管理首先需要解决的是如何对新生儿进行有效的疼痛评估。目前对于新生儿急性疼痛评估的工具包括单维度和多维度的工具,单维度评估工具主要从生理指标或行为反应来进行评估,而多维度的评估工具则需要从生理、行为及场景参数综合评估。
目前在NICU使用较多的主要是多维度的评估工具,这些评估工具已经被证明具有较好的有效性、可靠性及临床实用性。对于新生儿疼痛的评估主要基于新生儿可能接触到的刺激所产生的急性疼痛来开发验证,评估工具中涉及到的体征也受到主观评估的观察者的影响,因此,各种类型的评估量表都具有一定的测评局限性,在临床实践中往往需要结合具体的病情、临床场景及需要评估的疼痛类型来选择,目前并没有单一有效的工具可以满足所有的评估需求。本文将常用的几种新生儿疼痛评估工具进行对比(见表1)。
疼痛评估是早产儿、新生儿疼痛的唯一重要预测方式,但是不同医疗机构内的新生儿疼痛评估和管理是非常不稳定的。除了为术后护理制定循证指南和教育专业人员提高新生儿术后疼痛控制意识之外,还必须强调医生对疼痛的评估[19]。由于任何一种方法都不能准确有效地评估所有患儿的所有类型的疼痛,多种评估方法的联合使用有助于提高疼痛评估的准确性。为了有效地评估疼痛,医师及药师必须与患儿及患儿照顾者进行交流。疼痛治疗后需评估其效果和不良反应,按时进行疼痛评估和记录才能保证疼痛药物治疗的有效性和安全性。尽管评估工具的使用存在局限性,但是医疗机构仍需要建立一套实用性良好的针对早产儿及新生儿疼痛的评估流程,医务人员对评估的重视对提高新生儿的疼痛管理极其重要。临床中对早产儿最常用的是“早产儿疼痛情况评估表(PIPP量表)”,用于评估急性疼痛;而“新生儿疼痛、激越和镇静评分(N-PASS评分)”用于评估长期疼痛。
2.早产儿及新生儿的疼痛药物治疗管理原则
由于早产儿和新生儿疼痛主要来源于刺激性因素和术后急性疼痛,主流观点都认同应采取疼痛预防性控制措施,防范或减轻伤害性刺激引起的疼痛。考虑到新生儿的生理与成人间存在显著差异,对药物代谢及敏感性方面具有独特性,早产儿及新生儿的药物治疗风险高,在临床药物治疗管理方面存在极大的挑战。一方面,小儿的血浆蛋白和α1-球蛋白水平较低,导致药物结合蛋白含量低,阿片类药物和局部麻醉药等蛋白结合率高的药物在小儿的血浆中将会出现更高的游离药物浓度,使得药物的作用增强和(或)毒性增强。另一方面,许多镇痛药物包括阿片类镇痛药和非甾体抗炎药都通过P450酶系代谢,而婴儿刚出生时的肝药酶分泌系发育不完善、药物清除能力低,在出生后几个月肝药酶水平迅速增长到成人水平。因此婴儿在药物代谢方面存在着阶段性变化。此外,婴儿特别是未足月的新生儿的肾脏对药物的排泄能力是低于成人的,药物或有活性的代谢产物容易蓄积到有毒水平。
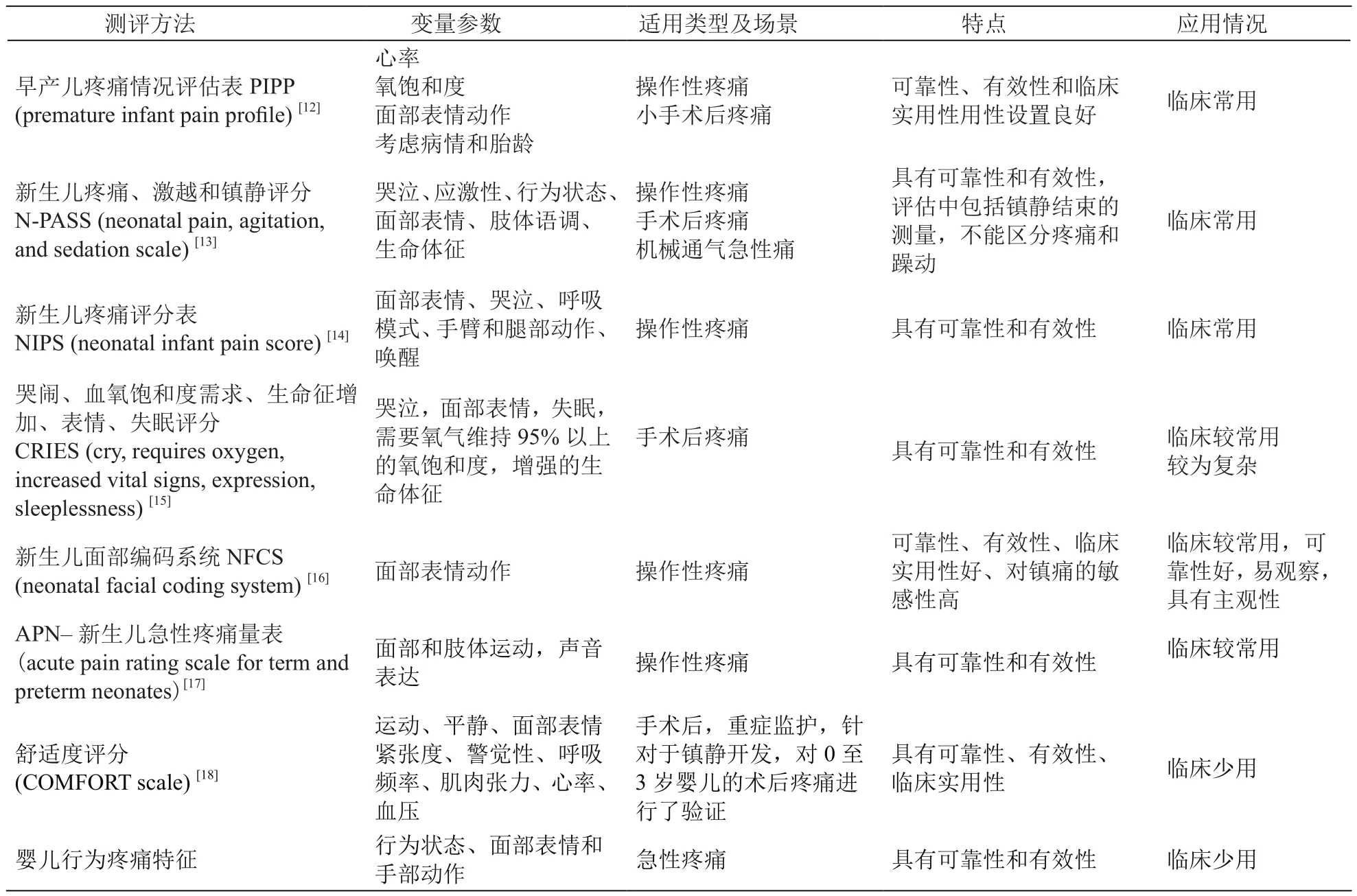
表1 新生儿疼痛评估方法对比表
正因为存在上述较多不确定的影响因素,早产儿及新生儿的疼痛药物治疗管理原则并不强调积极采取药物治疗干预[20]。主要原则包括四个方面:①针对所有预期疼痛性操作进行预先镇痛;②避免不必要的伤害性刺激或疼痛性操作;③鼓励父母积极参与协助孩子应对这些操作;④联用非药物和药物方法,以预防和减少新生儿疼痛。
基于阶梯镇痛管理的理念,早产儿及新生儿疼痛药物治疗管理模式可以细分构建成为以防范为基础,以非药物治疗为主,根据病情及镇痛需求,基于疼痛评估体系的多阶梯架构(见图1)[21]。
3.早产儿及新生儿的疼痛治疗建议
(1)口服蔗糖:口服蔗糖、葡萄糖等甜味液体可为足月儿和早产儿提供有效镇痛。蔗糖或葡萄糖是通过激活脑干中阿片类和非阿片类系统来达到镇痛效果的。对那些接受侵入性较小的操作的早产儿,葡萄糖的镇痛效果似乎与蔗糖相同;治疗新生儿疼痛的剂量范围为0.012~0.12 g(0.05~0.5 ml 的24%蔗糖溶液)[6]。建议在疼痛性操作前2 min通过安抚奶嘴给予,并可根据疼痛缓解程度重复给予。通常按照矫正胎龄(postmenstrual age, PMA)调整插管婴儿的蔗糖剂量: PMA为24~26周:0.1 ml,PMA为27~31周:0.25 ml,PMA为32~36周:0.5 ml,PMA为37~44周:1 ml,PMA为45~60周:2 ml。

图1 早产儿及新生儿疼痛药物治疗管理阶梯式模式图
(2)非阿片类镇痛药:如对乙酰氨基酚、氯胺酮及非甾体类抗炎药:对乙酰氨基酚是一种常用的解热镇痛药,几乎可用作各类术后疼痛治疗的基础用药。轻度疼痛可单独使用对乙酰氨基酚镇痛,中度疼痛可与非甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)或可待因联合使用[22]。对乙酰氨基酚具有良好的安全用药范围,且没有严重的不良反应,经常用来治疗小儿疼痛。对乙酰氨基酚的直肠[23]和静脉制剂[24]均已在婴儿中进行过研究,其在新生儿中出现肝毒性或肾毒性的风险较低[25~27]。对乙酰氨基酚已被广泛用于治疗轻至中度操作性疼痛和术后疼痛,但是单用对乙酰氨基酚的效果还不足以减少疼痛,尤其是对于刺激性明显的操作性疼痛而言,对乙酰氨基酚的治疗效果尚显不足。因此对于接受致痛性操作的新生儿,不推荐单独使用对乙酰氨基酚来预防或减少其急性疼痛(见表2)。
氯胺酮作为一种N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,通过脑组织及脊髓神经细胞膜上的NMDA受体产生中枢性镇痛作用,广泛用于新生儿和小婴儿的操作、手术或术后镇痛和镇静,其优点在于对心率和血压的影响较少[28]。 早产儿使用NSAIDs可引起消化道出血、血小板功能障碍及肾小球滤过率下降等不良反应。因此,应警惕NSAIDs在早产儿及新生儿的镇痛治疗的风险[29]。
(3)阿片类镇痛药:阿片类药物是迄今为止应用最广泛的小儿术后镇痛药物,兼有镇静作用。吗啡和芬太尼是新生儿镇痛最常用的阿片类药物。芬太尼类衍生物经过结构修饰,具备了更多变的治疗特点,例如舒芬太尼效果更强,而阿芬太尼和瑞芬太尼作用时间更短。新生儿及婴幼儿由于血脑屏障未发育成熟,代谢清除较慢,且在血内与蛋白结合较少,阿片类药物对于婴儿尤其是早产儿的呼吸抑制效应较成人更敏感,使用时应注意观察患儿的生命体征。
吗啡常用于机械通气或大手术后的婴儿,通过持续输注或者间断输注方式,缓解侵入性操作相关的急性疼痛和术后疼痛。早产儿使用吗啡镇痛可能发生低血压和喂养延迟等副作用[30,31],因此,不推荐机械通气的早产儿常规输注吗啡。新生儿使用吗啡术后疼痛的推荐剂量如下[7]:①口服:每次80 μg/kg,每4~6 h一次;②静脉和皮下注射:起始剂量为25 μg/kg,根据治疗反应确定最佳剂量。

表2 对乙酰氨基酚在早产儿及新生儿中的口服和直肠给药剂量[7]
芬太尼能快速镇痛,而且对血流动力学的影响极小,因此可用于新生儿。但目前尚无大型试验对芬太尼在新生儿中的应用进行过研究。由于新生儿的药物清除率降低,芬太尼的半衰期延长易产生副作用,应在严密监测下使用才能保证安全。与吗啡相比,芬太尼具有降压效应小和对胃肠动力或尿潴留的影响小等优点,但其也存在阿片类耐受和戒断反应大的缺点[32,33]。
(4)局部麻醉药:局部麻醉药能可逆性地阻滞钠通道,抑制神经动作电位的产生,阻止神经冲动的传递,使有关神经支配的部位出现暂时性感觉丧失,可减少新生儿的操作性疼痛,因而被广泛应用[34]。常用的局部麻醉药包括利多卡因、布比卡因、左布比卡因和罗哌卡因等。
(5)镇静剂:临床常用的镇静剂包括苯二氮卓类、右美托咪定、巴比妥类和水合氯醛等药物,具有镇静、抗焦虑、肌松弛和遗忘的作用。大部分镇静剂没有镇痛作用,还可能掩盖新生儿疼痛的临床体征。因此,在新生儿使用镇静剂的安全性、剂量和有效性得到充分证实之前[35],目前并不推荐将右美托咪定等镇静剂常规用于新生儿。但也有研究表明,早产儿和新生儿在心脏手术后能够耐受以0.3 μg/(kg·h)和0.75 μg/(kg·h)的速率持续输注的右美托咪定[36]。
无论采取何种药物及给药方式,都要首先确保患儿的安全,要在医护人员的指导下、在患儿家属的照看下给药。定期反复评估患儿的疼痛程度,并根据评估结果调整用药剂量。
五、总结与讨论
早产儿及新生儿因其特殊的生理状态和较高的治疗风险受到了广泛的关注,但该人群的疼痛相关问题仍未得到重视。由于在疼痛认识中存在较多的误区,各层级医疗机构对疼痛管理的意识薄弱,目前国内关于早产儿及新生儿的疼痛管理方面存在较多的不足,对这部分人群的疼痛治疗管理仍缺乏大样本高质量的流行病学研究。
从疼痛专科临床药师角度来看,为满足早产儿及新生儿人群的镇痛需求,应在医疗机构内逐步建立完善有效的NICU疼痛管理单元/团队,建立适用于本医疗机构的疼痛药物治疗管理流程模式,并对这类特殊人群进行标准化的疼痛评估及预防性干预。对于可引发刺激性疼痛的操作进行优化,并对患儿进行预防性管理。对于特定需要镇痛治疗管理的患儿,遵循阶梯式镇痛管理模式,逐步建立有效的早产儿/新生儿疼痛药物治疗管理模式。尤其需要关注镇痛药物治疗的风险,结合患儿的病生理特点和循证证据制定临床有效的治疗策略和具体方案。
尽管早产儿及新生儿疼痛管理在国内仍处于起步探索阶段[37],近年来国外先进的疼痛管理理念和实践经验却值得我们深入学习挖掘。尽早开展在我国人群中的流行病学调查建立特殊人群合理用药评价体系显得尤为关键。

