Notch信号通路在长春新碱诱导神经病理性疼痛中的作用*
李余星 秦冰杰 刘小虎 谭 潇 郑 军 郑卫红△
(1三峡大学医学院 国家中药药理科研三级实验室,宜昌443002;2三峡大学第一临床医学院肝胆胰外科研究所,宜昌443003;3宜都市第一人民医院药剂科,宜昌443300)
由躯体感觉神经直接损伤或疾病引起的疼痛称为神经病理性疼痛,是临床最为难治的慢性疼痛之一。长春生物碱类(长春新碱,vincristine, VCR)是目前临床常用的抗肿瘤化疗药物,在抗肿瘤治疗中发挥重要作用。然而,目前国内外有越来越多的报道提示[1~4],其单用或合用在抗肿瘤的同时会产生神经损伤毒性作用,诱发痛觉过敏和超敏反应,称化疗诱导的神经病理性疼痛(chemotherapy-induced neuropathic pain, CINP),简称化疗痛。此疼痛制约了肿瘤的进一步加量化疗,并降低了肿瘤病人的生活质量,也降低了长春生物碱类药物的抗肿瘤疗效[5~7]。目前其发病机制尚未完全阐明,并缺乏有效的治疗措施。因此,研究化疗痛的发生发展机制、寻找能减轻或消除化疗痛发生发展的药物和方法是当今国内外该领域里亟待解决的课题。
随着对神经病理性疼痛研究的不断深入,药物治疗的新靶点不断被发现,如小胶质细胞通路[8]、P38 MAPK通路[9]、神经生长因子抗体[10]、电压门控钠离子通道阻滞剂、WNT信号通路抑制剂[11]等。其中,本课题组前期研究[12]已证实脊髓背角小胶质细胞活化通路参与了VCR诱导的神经病理性疼痛的发生、发展。而之前已有研究表明[13,14],小胶质细胞的激活与Notch信号通路激活密切相关,抑制Notch信号通路可显著抑制小胶质细胞活化,从而降低促炎细胞因子(TNF-α、IL-1β和IL-6)的表达,减轻神经元的损伤。 Sun 等人的研究也发现[15],大鼠坐骨神经损伤引起神经病理性疼痛,其脊髓Notch信号的表达和活性显著增加,痛域值显著降低;抑制Notch信号通路则逆转了大鼠神经损伤后产生的痛觉过敏。但化疗药VCR诱导的神经病理性疼痛发生发展是否也与脊髓背角Notch信号通路的活化相关,能否通过抑制Notch信号通路的活化来缓解化疗痛大鼠痛觉过敏反应,目前尚无相关文献报道。本研究建立VCR诱导神经病理性疼痛大鼠模型,并通过鞘内注射Notch信号通路活化的抑制剂DAPT,检测大鼠痛阈值变化及其Notch信号通路活化胞内段NICD、核内下游基因Hes1 mRNA的表达,从Notch信号通路进一步探讨化疗诱导的神经病理性发生发展机制,为治疗化疗痛寻找新的靶点提供理论依据。
方 法
1.材料
(1)主要试剂:Notch信号通路抑制剂DAPT购自Selleck公司(批号:S2215);注射用硫酸长春新碱购自深圳万乐药业有限公司(批号:H44021772);Anti-NICD antibody(Abcam公司);正常山羊血清封闭液(谷歌生物)。
(2)实验仪器:Von Frey电子测痛仪(深圳瑞沃德公司);PL-200热刺痛仪(成都泰盟科技有限公司);DM.4-YLS-21A冷热板测痛仪(北京达美达科技有限公司);迷你转印电泳仪(北京六一仪器厂);荧光倒置显微镜(尼康TE-2000,日本);全波长酶标仪(Tecan Austria GmbH公司)。
(3)实验动物:实验采用三峡大学实验动物中心提供SPF级Sprague-Dawley健康雌性大鼠,体重在220~240 g左右(动物生产许可证号:SCXK(鄂)2011-0012)。大鼠饲养环境恒温(22±2)℃,湿度为(60±5)%,12 h交替光照,自由摄食饮水,实验动物设施使用许可证号:SYXK(鄂)2011-0061)。实验动物适应环境3 d后行鞘内置管术,手术成功的大鼠按热痛阈值大小,采用随机区组法进行分组,并单笼饲养。动物使用经过伦理委员会的批准。
2.方法
(1)大鼠鞘内置管:纵向切开约2 cm的大鼠髂棘水平连线为中点的皮肤,分离剔除大鼠L5、L6腰椎棘突周围的肌肉组织,充分暴露进针点。用1 ml注射器的针头轻探测,出现落空感并伴随大鼠侧向甩尾动作,即为精准进管位置,快速在该位置插入注满高压消毒的生理盐水的PE 10管。若再次观察到大鼠侧向甩尾,并发现PE 10管中流入脑脊液,说明初步置管成功。将大鼠背颈脖处做一切口,灌胃针由此切口穿入沿皮下至大鼠背部刀口将置管引出,立即热熔封闭PE 10管并缝合伤口。对大鼠进行消毒处理,肌肉注射青霉素钠8万IU/只,防止伤口感染。置管三天后,大鼠鞘内注射2 %利多卡因10 μl。若大鼠的双后肢出现瘫软并拖地行走且在30 min后恢复正常行走,表明该大鼠可用于实验;反之,则剔除。
(2)实验动物分组及化疗痛动物模型的建立:将已鞘内插管的SD大鼠进行热痛行为学实验,并挑选出热痛阈值合格SD大鼠,按热痛阈值大小筛选实验大鼠并随机区组分为4组,每组10只:①对照组 (control):鞘内注射(i.t.) DMSO (10 %, 1 μl)共8次(D0~D7);再隔日腹腔注射(i.p.)生理盐水0.5 ml /100 g,共4次(D1、D3、D5、D7);②VCR致化疗痛模型组 (VCR):i.t.DMSO (10%, 1 μl)共8次(D0~D7);再隔日i.p.VCR 125 μg/kg,共4次(D1、D3、D5、D7);③DAPT多次给药+ VCR组(DAPT(8)+VCR):i.t.γ分泌酶抑制剂-DAPT(Notch信号通路抑制剂)(50 μg/μl, 1 μl)共8次(D0 ~ D7);再 间 隔 日 i.p.VCR 125 μg/kg, 共 4 次 (D1、D3、D5、D7);④DAPT单次给药+ VCR组 (DAPT(1)+VCR):i.t.DAPT (50 μg/μl, 1 μl) 共 1 次 (D0);i.t.DMSO (50 μg/μl, 1 μl)共 7 次 (D1 ~ D7);再间隔 日 i.p.VCR 125 μg/kg, 共 4次 (D1、D3、D5、D7)。以首次鞘内给药DAPT为第0 d,即D0。在D0、D8测定4组实验大鼠机械痛、热痛和冷痛阈值。并于D9处理大鼠。0.3%戊巴比妥钠(30 mg/kg)对实验大鼠进行深度麻醉,一部分大鼠用4%多聚甲醛进行活体灌注固定,并取出脊髓腰膨大L4-L6组织,放4%多聚甲醛中浸泡,置4℃冰箱内备用。另一部分已麻醉大鼠置于冰盒上取出新鲜的L4-L6脊髓组织,放入预冷的生理盐水中冲洗脊髓,再放入冷冻盒中,于-80℃中保存备用。
(3)行为学检测:将大鼠置于有机玻璃笼内适应环境30 min,待大鼠安静后,分别使用用电子von Frey测痛仪、热刺痛仪器和冷板测痛仪测定痛阈值。左右足各测3次,刺激间隔15 min,记录大鼠出现撤足反应时测痛仪所显示的刺激强度大小,计算左右共6次刺激痛阈值结果的平均值,分别作为大鼠机械痛、热痛和冷痛的刺激痛阈值。
(4)免疫组化法检测NICD蛋白:取固定好的脊髓腰膨大段L4-L6,制备成脊髓组织石蜡切片。取切片脱蜡后分别用pH 9.0 EDTA对NICD切片进行抗原修复。经3% H2O2孵育,5% BSA室温封闭,加入NICD(稀释度1:200, ab8925, abcam) ,4℃孵育过夜,再加入二抗:HRP标记的山羊抗兔IgG(1:500, GB23303, Servicebio),避光室温下作用1 h,DAB显色和苏木精复染细胞核,封片后立即于显微镜下观察并拍照,并用图像分析软件进行灰度分析。
(5)Western blot检测NICD蛋白:在冰上迅速取出脊髓腰膨大部位(L4-L6节段),加入10倍于组织块的冰冻裂解液后用电动匀浆器进行匀浆,4℃下12 000 rpm离心10 min,用BCA法进行蛋白定量测定。配置12%的分离胶,和5%的浓缩胶,浓缩胶电泳条件为80 V恒压,分离胶电泳条件为120 V恒压,当溴酚蓝染料前端电泳至分离胶末端处时即停止电泳,转膜后5%脱脂奶粉封闭1 h,加入NICD,GAPDH一抗:NICD (稀释度1:500,ab8925, abcam);GAPDH (稀释度1:10000, sc25778,santa cruz biotechnology),4℃孵育过夜后TBST洗膜3次,每次5 min。加入TBST稀释的二抗:HRP标记的山羊抗兔IgG (1:3 000, GB23303,Servicebio),室温孵育30 min后TBST洗膜3次,每次5 min。ECL反应、显、定影后使用图像分析系统进行数据分析。
(6)RT-PCR法检测Hes1 mRNA:采用Trizol法提取每一脊髓组织的总RNA。按照TaKaRa说明书步骤依次加入各试剂反转录,各组产物cDNA用于PCR或者-20℃保存。用Primer 5设计引物如下:Hes1-F:5' CTACCCCAGCCAGTGTCAAC3';Hes1-R:5' CCCCAACACGCTCGGGTCTG3'。GAPDH-F:5' GCAAGTTCAACGGCACAG3';GAPDH-R:5' CTCAACAGTATAAAGAGC3'。按照NovoStar Green PCR Mix说明依次加入上下游引物、各组产物cDNA、分子生物水制备25 μl PCR扩增反应体系的混合物,混匀后置于PCR仪进行PCR扩增实验。反应结束后进行1%琼脂糖凝胶电泳检测。配制2%琼脂糖凝胶,上样,电泳,电压120 V,电流50 mA,电泳时间1 h。紫外凝胶成像仪检测。采用软件Image-Pro Plus 6对电泳条带进行灰度值(IOD)分析。
3.统计学方法
实验结果采用SPSS 13.0软件包进行统计分析,痛阈值分析采用随机区组设计的方差分析,灰度值比较采用单因素方差分析,并用least significant difference (LSD) 法做两两比较,计量资料以均数±标准差() 表示,P˂ 0.05为差异有统计学意义。
结 果
1.大鼠痛阈值的变化
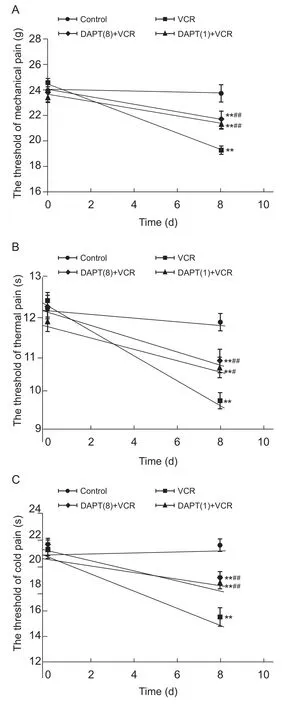
图1 各组大鼠机械痛(A)、热痛(B)、冷痛(C)阈值变化 (n=10,D)Fig.1 The change of the mechanical (A), thermal (B), cold(C) pain threshold in rats (n=10,D)
图1为各组大鼠机械痛(A)、热痛(B)及冷痛(C)阈值变化。给药前各组大鼠行为学痛阈值差异均无统计学意义(P>0.05)。造模第8 d检测各组大鼠痛阈值显示:与对照组比较,VCR组大鼠机械痛、热痛及冷痛痛阈值均显著降低(P˂0.01),提示VCR诱导大鼠产生痛觉过敏反应,即成功建立大鼠化疗痛模型;与VCR组比较,DAPT多次给药+ VCR组和DAPT单次给药+ VCR组机械痛、热痛及冷痛痛阈值明显升高(P˂0.05或P˂0.01),表明当Notch信号通路活化被抑制后,化疗痛大鼠的痛觉敏化反应得到缓解;与DAPT多次给药+ VCR组比较,DAPT单次给药+ VCR组大鼠机械痛、热痛及冷痛痛阈值没有差异(P>0.05),表明Notch信号通路抑制剂DAPT多次给药和单次给药可以达到相同作用效应。以上结果提示VCR隔日腹腔注射4次,可成功建立VCR诱导大鼠化疗痛模型,Notch信号通路抑制剂DAPT可在初次鞘内注射后即可达到抑制Notch信号通路的作用。
2.免疫组化法检测大鼠脊髓背角NICD蛋白的表达
图2为免疫组化检测各组大鼠NICD表达(A)及NICD平均灰度值(B)。与对照组比较,VCR组NICD的表达显著增加,其平均灰度值明显升高(P˂0.01),表明活化的Notch信号通路参与VCR诱导的神经病理性疼痛的发生与发展;与VCR组比较,DAPT多次给药+ VCR组和DAPT单次给药+ VCR组NICD表达和平均灰度值均显著降低(P˂0.01),表明抑制Notch信号通路活化可缓解VCR诱导的大鼠化疗痛;与DAPT多次给药+VCR组比较,DAPT单次给药+ VCR组NICD的表达无显著变化(P>0.05),表明单次鞘内注射DAPT即可阻断Notch信号通化。
3.Western Blot法检测大鼠脊髓背角NICD蛋白的表达
与对照组比较,VCR组大鼠NICD表达显著升高(P˂0.01);与VCR组比较,DAPT多次给药+ VCR组和DAPT单次给药+ VCR组大鼠NICD表达均降低,且具有统计学差异(P˂0.01),表明抑制Notch信号通路的活化,大鼠NICD的表达下调;与DAPT多次给药+ VCR组比较,DAPT单次给药+ VCR组大鼠NICD的表达并无变化,表明单次给予DAPT即可抑制Notch信号通路的活化(见图3)。
4.RT-PCR法检测大鼠脊髓背角Hes1 mRNA的表达水平
与对照组比较,VCR组大鼠Notch信号通路核内下游基因Hes1 mRNA表达水平显著升高(P˂0.01),表明VCR激活Notch信号通路诱导大鼠产生神经病理性疼痛。与VCR组比较,DAPT多次给药+ VCR组和DAPT单次给药+ VCR组大鼠Hes1 mRNA表达水平均显著降低(P˂0.01),表明抑制Notch信号通路的活化,VCR诱导的化疗痛大鼠的Notch信号通路核内下游基因Hes1 mRNA表达水平降低。与DAPT多次给药+ VCR组比较,DAPT单次给药+ VCR组大鼠Hes1 mRNA表达水平并无变化(P>0.05),表明单次给予DAPT即可抑制Notch信号通路的活化(见图4)。
讨 论
Notch信号通路由Notch受体、Notch配体(DSL蛋白)、NICD转运分子和下游靶基因如Hes、Hey等信号传导分子等组成[16]。Notch信号是通过相邻细胞的Notch配体与受体相互作用而产生,Notch蛋白经过三次剪切,由胞内段(NICD)释放入胞质,并进入细胞核与转录因子CSL结合, 形成NICD/CSL转录激活复合体,从而激活HES、HEY、HERP等碱性-螺旋-环-螺旋 (basichelix-loophelix, bHLH)转录抑制因子家族的靶基因,发挥生物学作用。Xie等[17]发现,丝线结扎坐骨神经干建立坐骨神经结扎损伤模型(chronic constriction injury,CCI)和选择性坐骨神经损伤模型(spared nerve injury, SNI)时大鼠机械和热痛域值显著降低,鞘内注射γ-分泌酶抑制剂DAPT,可明显增加大鼠的机械痛阈值和热辐射痛阈值,表明抑制Notch信号通路可预防或逆转早期或晚期的神经损伤型神经病理性疼痛;而作为Notch信号传导途径配体的jagged-1肽则呈剂量依赖性地诱导正常大鼠的神经性疼痛样行为,提示Notch通路的活化可能参与了神经损伤引起神经病理性疼痛的产生和发展。
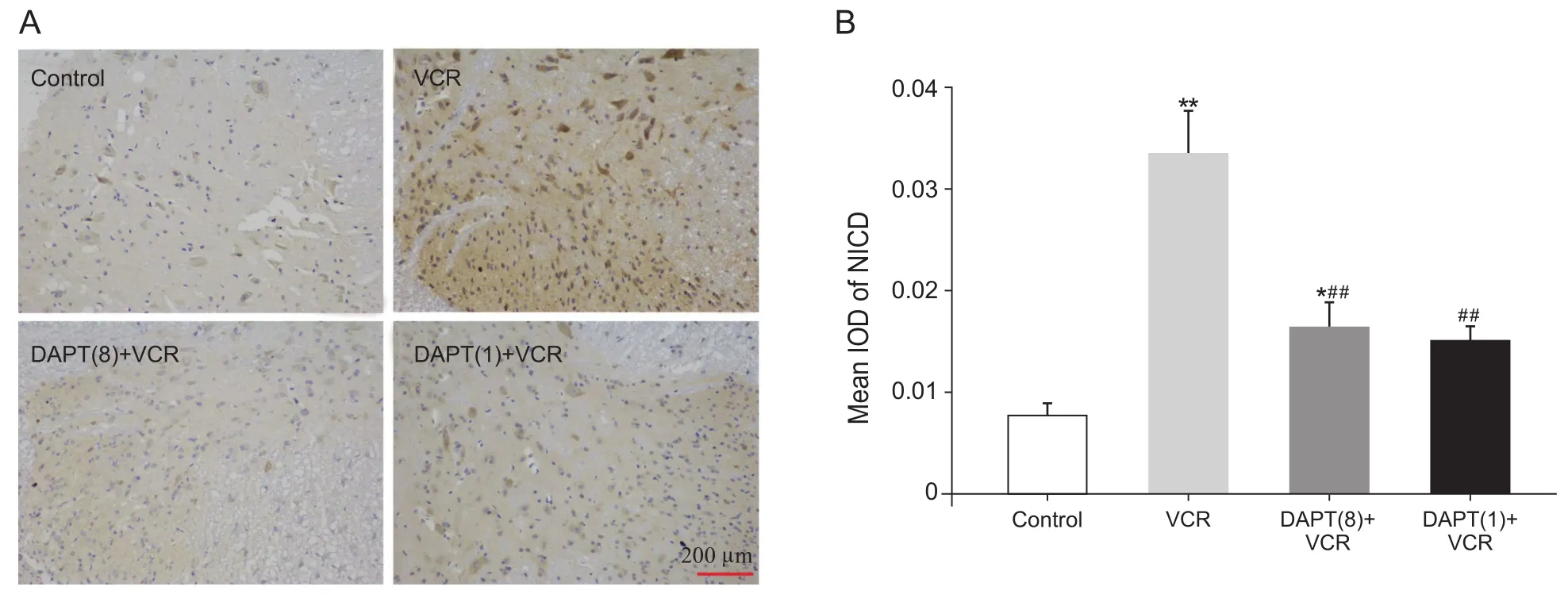
图2 各组大鼠脊髓背角NICD的表达(A)及平均灰度值(B) (n=10,D)(免疫组化法 ×200)Scale bar=200 μmFig.2 Expression (A) and integrated optical density (B) of NICD in spinal dorsal horn of rats (n=10,D)(Immunohistochemistry ×200) Scale bar=200 μm
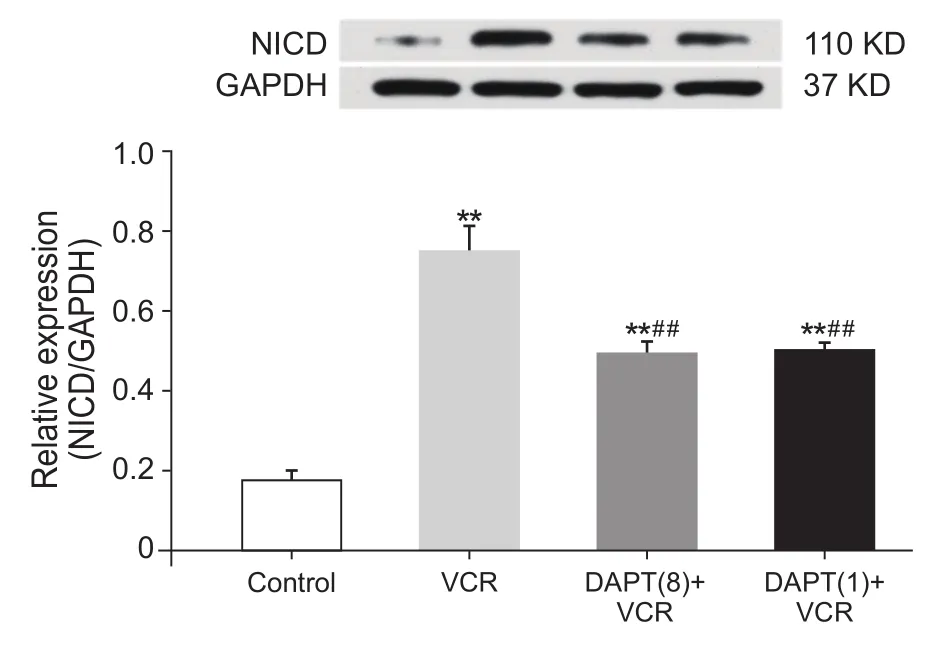
图3 各组大鼠脊髓背角NICD表达变化 (n=10,D)Fig.3 Expression of NICD in spinal dorsal horn of rats(n=10,D)
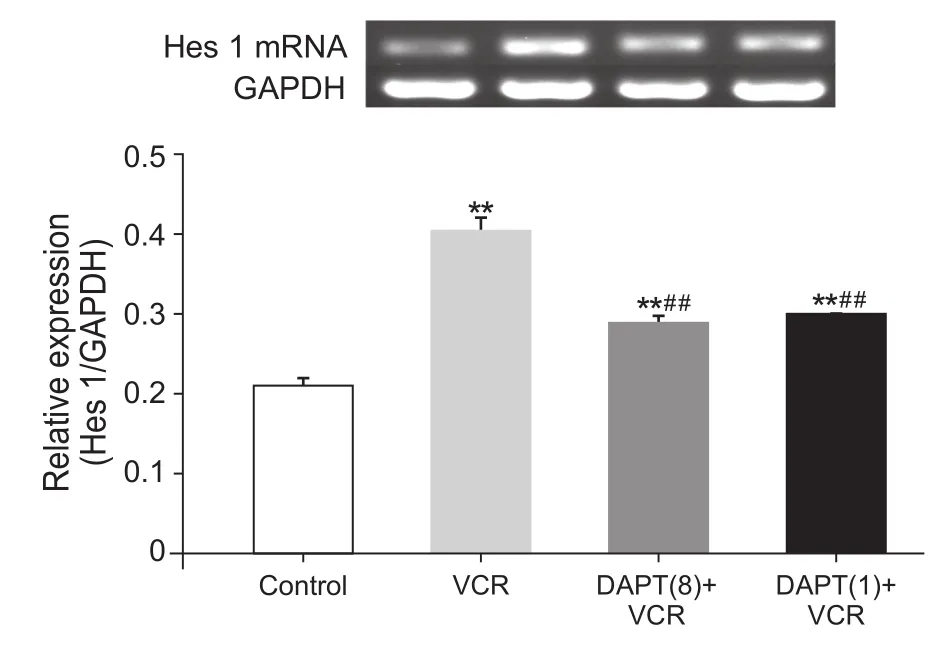
图4 各组大鼠脊髓背角Hes1 mRNA表达水平变化(n=10,D)Fig.4 Expression of Hes1 mRNA in spinal dorsal horn of rats (n=10,D)
本研究参考文献方法[18]用化疗药物长春新碱腹腔注射建立化疗药诱导大鼠神经病理性疼痛模型,结果显示:VCR组大鼠机械痛阈值、热痛阈值和冷痛阈值均显著降低,证明化疗痛模型成功建立。同时,VCR组化疗痛大鼠脊髓背角Notch信号通路活化标志物NICD蛋白、核内下游基因Hes1 mRNA表达均显著增高。鞘内给予Notch信号通路抑制剂DAPT后,发现化疗痛大鼠的痛阈值均显著提高,其痛觉过敏反应得到明显缓解,大鼠脊髓背角NICD蛋白、Hes1 mRNA表达均明显降低,且DAPT单次鞘内注射与多次鞘内注射的抑制作用无差异(P>0.05)。提示Notch信号通路的活化在VCR诱导的神经病理性疼痛中发挥关键作用。
该研究表明VCR诱导的大鼠神经病理性疼痛与Notch信号通路活化密切相关,且单次鞘内注射DAPT即可产生显著的抑制效应,从而达到缓解化疗痛的疗效。且本课题组前期研究已证实[12]化疗药诱导的神经病理性疼痛的发生发展与小胶质细胞活化通路相关。由此我们推测化疗药诱导神经病理性疼痛的作用机制可能也是通过激活Notch信号通路,继而导致小胶质细胞活化通路活化,促使炎性细胞因子的释放而产生的。然而,Notch信号通路活化对小胶质细胞活化通路的激活是直接作用,还是间接作用的结果,以及而且二者之间是否存在相互递进的关系,尚有待进一步研究阐明。总之,本研究结果提示:抑制Notch信号通路可作为治疗化疗药诱导的神经病理性疼痛的新途径,为临床治疗化疗痛提供了新思路。

