17α-羟化酶缺乏症诊治4例病例报道及文献复习
虞艳芳,苏 恒,罗志丹,欧 杨,郭瑞金,李庆敏
(云南省第一人民医院 内分泌科,云南 昆明 650021)
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH) 是一组由编码皮质激素合成必需酶基因突变致肾上腺皮质类固醇类激素合成障碍所引起的疾病,为常染色体隐性遗传。其主要病因为在皮质醇合成过程中,由于酶缺陷引起皮质醇合成不足,继发下丘脑CRH和垂体ACTH代偿性分泌增加,导致肾上腺皮质增生。涉及CAH的代谢酶缺陷目前主要分为七型:21-羟化酶缺陷,11β-羟化酶缺陷,3β-羟类固醇脱氢酶缺陷,17α-羟化酶缺陷,20,22碳链酶缺陷、17β-羟类固醇脱氢酶3缺陷和类固醇激素急性调节蛋白缺陷。其中17α-羟化酶缺乏症(CYP17),又称Biglieri综合征,约占CAH的1%[1],发病率约为1/50,000-100,000[2]。自1966年Biglieri等[3]首次报道以来,国内外仅有约200例的文献报道。本文对我院内分泌科2018年诊断的4例先天性肾上腺皮质增生症(17α-羟化酶缺陷)患者的病史结合文献探讨17α-羟化酶缺陷症的诊治,现报告如下。
临床资料与结果 病例1 患者,女,16岁,患者一年前突发四肢搐搦,在当地医院就诊,检查发现血压升高达170/110mmHg,伴低钾、低钙,经治疗抽搦好转,低钾、低钙纠正,血压仍高予出院(具体不详)。2月前患者无诱因出现头痛,头昏,并出现昏厥,意识丧失,查头颅CT显示:脑出血,蛛网膜下腔出血,经治病情好转,为进一步明确高血压原因,遂转我院就诊。既往史:无外伤、手术史,无传染病史。未婚未育,月经至今未来潮。患者父母非近亲结婚,为足月顺产在家分娩,生长发育及智力与同龄儿童相似。家中有2个弟弟,生长发育正常。否认药物食物及其它过敏史。体格检查,T:36℃,P:76次/分,R:20次/分,BP:151/99mmHg,身高:162cm,体重:43kg,BMI:17.22kg/m2,上部量:76.5cm,下部量:85.5cm,指间距163cm。全身皮肤未见紫纹、痤疮,甲状腺未触及肿大。心肺腹无异常阳性体征。乳房Tanner分期Ⅰ期,无腋毛、阴毛,外生殖器女性外观呈幼稚型。双上肢肘外翻。双手指双足趾未见短指(趾)畸形。
病例2 患者,女,20岁,患者半年来无诱因时常出现头痛,为持续性闷痛,多见于晨起和中午,伴头晕,无晕厥,意识障碍。无视野缺损,无恶心,呕吐等。近3d病症加重到当地医院就诊,测血压达260/140mHg,即转入我院急诊科,给予降压处理后稍有好转,以高血压收入我科。既往史:至今无自主月经来潮,3年前曾行人工周期有“月经”来潮(具体不详)。未婚未生育。否认家族中有遗传病史。父母非近亲结婚。曾有一姐姐因“头痛”抢救无效死亡(具体不详)。体格检查,T:36.2℃,P:96次/分,R:19次/分,BP:170/110mmHg,身高:160cm,体重:40kg,BMI:15.6kg/m2,上部量:76.5cm,下部量:85.5cm,指间距163cm。甲状腺无肿大。心肺腹无异常阳性体征。乳房Tanner分期Ⅱ期,无腋毛、阴毛,肛门及外生殖器正常。脊柱、四肢无畸形。神经系统正常。
病例3 患者,女,25岁,原发性闭经7年,发现血压高2年入院。2年前因无月经来潮在当地医院检查发现血压升高达180/130mmHg,未进一步检查和治疗。半月前无明显诱因出现双上肢抽搦,无口吐白沫,无意识障碍,无大小便失禁,无软瘫,无呼吸困难,在当地医院检查后诊断“高血压低钾待查(醛固酮增多症?)、双侧肾上腺病变性质待查、先天性子宫缺失”,予以“贝那普利、氯化钾缓释片”等药治疗,现为进一步诊治至我科门诊,以“闭经、高血压原因待查”收入院。既往史:患者足月顺产,出生时体重正常,无产伤。1岁时患“肺结核”。无外伤、手术史,无传染病史。月经至今未来潮,未婚未育。患者父母非近亲结婚,健在,1姐1妹及2兄均无类似疾病。入院查体,T:36℃,P:88次/分,R:20次/分,BP:165/121mmHg,身高:165cm,体重:47kg,BMI:17.2kg/m2。甲状腺刚可触及质软。心肺腹无异常阳性体征。双侧乳房Tanner分期Ⅰ期,未见阴腋毛,外阴幼稚型。脊柱、四肢无畸形。神经系统:生理反射正常。
病例4 患者,女,18岁,患者1年来无明显诱因出现头昏,未重视。1月前体检发现血压升高160/90mmHg,在外院就诊,肾上腺CT示“左侧肾上腺增生”,予特拉唑嗪7mg/d/次、美托洛尔25mg/d/次控制血压,血压控制不佳,门诊以“高血压待查”收住院。既往史:患者足月顺产,无产伤,出生时体重正常。生长发育较同龄人无明显差别。月经初潮12岁,每次持续6~8d,周期28d,无痛经,经期规则。未婚未育。无外伤、手术史,无药物过敏史,输血史,传染病史。父母健在,兄弟姐妹均无类似疾病。体格检查,T:36.0℃,P:90次 /分,R:20次 /分,BP:161/100mmHg,身高:165cm,体重:49kg,BMI:18.0kg/m2。头耻距84cm,耻跟距82cm,指间距170cm。甲状腺未触及肿大。心肺腹无异常阳性体征。外生殖器:未见阴腋毛,外阴幼稚型。乳房Tanner分期Ⅳ期,脊柱、四肢无畸形。神经系统:生理反射正常。
以上4个患者的一般情况、检查化验资料及治疗用药、疗效见表1~表4。
讨 论 本文报道的4例先天性肾上腺皮质增生症(17α-羟化酶缺陷)为我科近一年收治的病人。4个病例共同特点:⑴年轻女性(19.75±3.86) 岁,⑵身材纤细,BMI偏轻 (17.0±1.00kg/m2),⑶高血压,⑷低血钾,⑸性幼稚,⑹闭经,⑺实验室检查:血ACTH↑,CORT↓,FSH↑,LH↑,E2↓,T↓,DHEA↓,17-OHCS↓,17-KS↓。4例患者住院期间予醋酸氢化可的松片替代治疗,同时予拜新同降压、氯化钾缓释片补钾、碳酸钙补钙等治疗。出院时复查血钾、血压正常。
肾上腺皮质激素和性激素的合成需要多种生物酶的参与,17α-羟化酶是当中必不可少的生物酶。当体内17α-羟化酶不足时,机体则不能合成皮质醇和性激素,进而引起一系列临床症候群。临床特征是性发育幼稚、高血压和低血钾。根据生物学性别不同,其临床表现及体征亦不同。46,XX患者特点为第二性征缺如、原发性闭经、子宫及卵巢无发育;46,XY患者特点为异位无发育睾丸,常表现为女性外阴、阴道盲端。王含必[4]等回顾性分析了北京协和医院自1983年-2010年1月期间收治的48例完全型17α-羟化酶缺乏患者的临床资料及实验室检测结果,显示本病发病率低,临床上少见,加之起病症状不一,多不典型,常被误诊、漏诊,错过最佳的治疗时机。

表1 患者一般情况
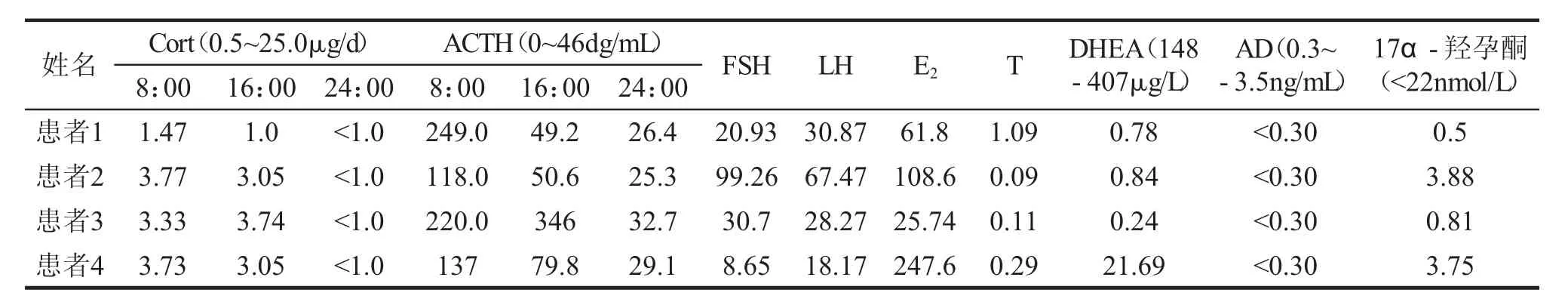
表2 实验室资料

表3 影像学检查资料及基因检测资料
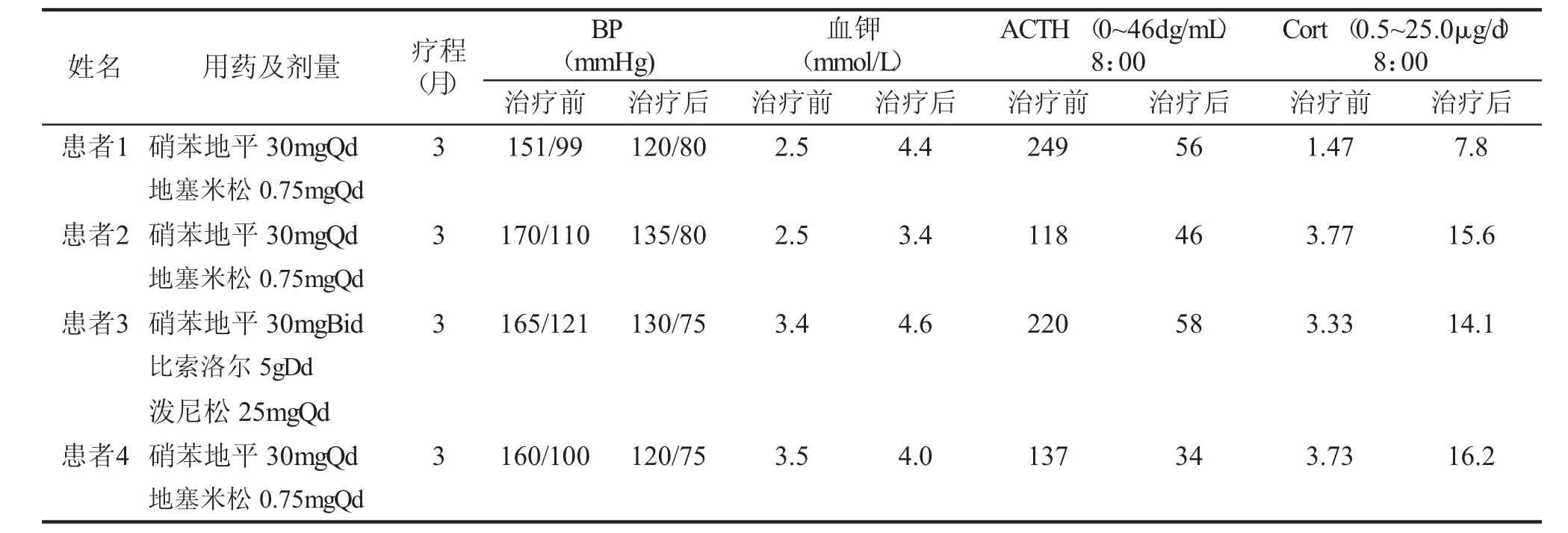
表4 用药剂量、疗程及随访情况
17α-羟化酶缺陷型除皮质醇合成显著降低外,所有的性激素的合成也存在缺陷,这种缺陷在胚胎发育期即已存在,影响胚胎。17-oL羟化酶缺陷症为CAH中非常罕见的类型,属常染色体隐形遗传性疾病,是由于编码该酶的CYP17基因突变而引起。编码CYP17的基因位于第10号染色体长臂(10q24-25),有8个外显子和7个内含子,长约13kb。近年来报道CYP的基因突变类型已>50种,并不断有新的突变类型被发现[5,6]。CYP17A1基因突变包括点突变、小突变、插入、缺失、剪切位点等。CYP17在肾上腺和性腺中均参与类固醇激素的生物合成,因此,该酶缺陷导致17α-羟化类固醇(雄激素、雌激素、皮质醇、11-去氧皮质醇和17-OPH等)合成极低,负反馈使血ACTH水平升高;同时血孕烯醇酮、孕酮、11-去氧皮质酮、皮质酮及其18-羟产物明显升高。上述激素变化致临床表现为:1.男女性分化差,17α-羟化酶缺陷患者的表型均为女性,染色体核型是46,XY的17α-羟化酶缺陷患者睾丸或是在腹腔中,或是腹股沟隐睾,或是在“大阴唇”中,成为男性假两性畸形[7];染色体核型为46,XX的17α-羟化酶患者在胚胎发育阶段虽无上述问题,但出生后一直处于性激素水平低下状态,两者至青春期即使下丘脑-垂体已经启动,FSH、LH明显升高,也无月经来潮及第二性征发育,男、女患者几乎均无阴毛和腋毛生长。直至成年也处于女性性幼稚状态。因为缺少性激素的刺激,这些患者的骨骺未闭,骨龄小于实际年龄,直至成年,在GH的作用下,还能缓慢生长,最终身高要高于一般同龄女性,且身材纤细。2.盐皮质激素合成途径亢进:17α-羟化酶缺陷症患者不论染色体核型为46,XX还是46,XY,在胚胎期都有皮质醇合成分泌障碍,但因17α-羟化酶阻滞前中间化合物为去氧皮质酮(DOC),其强大的储钠排钾作用,造成血容量增加,致高血压、低血钾、碱中毒,并抑制肾素-血管紧张素活性,进而使球状带醛固酮的分泌极度减少。其高血压症状可在儿童期即有表现,如果长期不治疗,高血压可以很严重并可呈进展性。DOC水平与高血压程度不完全相关,同时该物质具有强大的理盐和理糖作用,足以代偿皮质醇不足的表现,所以该患者一般无肾上腺皮质功能减退的表现或有轻度肾上腺皮质功能不足症状,使该疾病在早期难以被发现,易漏诊,应注意鉴别该病[8]。
对于17α-羟化酶缺陷症患者,GC治疗可通过抑制ACTH的过量分泌而使DOC的分泌下降到正常,通常可使高血压得到缓解[9]。假两性畸形和性幼稚的处理:性别取向的决定应该在2.5岁以前做出,3岁以后改变性别可能会给患儿带来严重的心理冲突和障碍。男性假两性畸形作为男孩抚养的患者需要做阴茎尿道成形术,位于腹腔内或发育不全的睾丸应在青春期前切除,以避免发生性腺恶性肿瘤的危险[10]。睾丸女性化患者睾丸切除术应推迟至青春期后进行,以保证患者充分的乳房发育。位于阴囊内并具有正常功能的睾丸可以保留,定期检测,通过B超、CT、MRI、和(或)睾丸活检早期发现性腺肿瘤,早期治疗。为了保证第二性征的发育,性激素替代治疗是必不可少。作为女性生活的患者,在11~12岁开始雌激素替代治疗,起始剂量不宜过大。一般3月后乳房和子宫开始生长,以后过渡到雌/孕激素周期治疗,6月左右有撤退出血。作为男性生活的患者在12~13岁开始给予雄激素替代治疗,雄激素具有促进第二性征发育和骨骼成熟的双重作用,为了取得最佳的成人最后身高,雄激素的剂量宜从小剂量开始。疗过程中的监测必须依据PRA,17-OHP,11-去氧皮质醇,雄激素,尿-KS等调整糖皮质激素,定期监测儿童的身高增长速度和骨龄情况,青春期发育情况。血浆ACTH一般不作为疗效观察指标。一般情况下,如果治疗及时且适当,本病预后良好,但疗效是否满意取决于病变的严重程度以及开始治疗时间的早晚。一般来说,治疗开始越早,越规范合理,效果就越好,可望获得正常的生长、发育和生育能力。

