人外周血染色体核型制备改良方法探讨
龙艳喜,王卫良,唐 莉,杨 琴,莫 晖,武 钊,王华伟
(1.昆明医科大学第一附属医院 生殖遗传科,云南 昆明 650032;2.31695部队医院,山东 青岛 266200;3.昆明市五华区人民医院,云南 昆明 650032)
人外周血染色体培养制备方法广泛运用到临床,是临床遗传学诊断中最基本和最有效的经典检测方法[1],为临床疾病的预防及诊断提供了有效依据。虽然当前人外周血染色体细胞培养及制备已在临床大量应用,但是每个实验室的实验环境及相应设备条件并不相同,实验操作人员操作手法和个人理解也存在很大的差异,导致目前仍然没有一个可以执行的标准操作方法。在人外周血染色体核型制备过程中,因操作步骤较多,每一个步骤操作过程中均会受到多种影响因素的干扰。操作人员任何的操作改变都会影响染色体核型最终的制备效果,甚至导致实验失败[2]。因此,得到结果稳定、质量较好的染色体核型结果一直是该实验技术的关键[3],也是目前染色体核型制备过程中大家不断探索的方向[4]。笔者通过反复实践后发现改良的方法能有效缩短核型制备的操作时间,操作简便,能得到更为清晰的染色体核型,并且实验结果也比较稳定,能显著提高检测分析诊断效率,现将方法报告如下。
资料与方法
一、一般资料 2017年4月-12月我室进行人外周血染色体培养制备1 630例标本,在方法改良前后的数据中随机挑选改良前制备标本200份和改良后制备标本200份,统计分析改良前后染色体分裂相数量及核型的效果。
二、仪器与试剂 Axio Imager Z2&Metasystems全自动扫描染色体图像分析系统,淋巴细胞培养基,秋水仙素10mg/mL和80mg/mL,胰酶(Gibco),0.075mol/L的氯化钾溶液,固定液(甲醇与冰乙酸按3∶1新鲜配制),PH7.4磷酸盐缓冲液,吉姆萨染液。
三、方法 1.细胞培养 用一次性2.5mL注射器取0.5mL(改良法为0.8mL)肝素抗凝血到5mL淋巴细胞培养基中,轻轻混匀放5%CO2,37℃±0.5℃培养箱内培养72h(改良法为96h)。
2.秋水仙素作用 收获细胞前90~120min(改良法为20min) 在培养基中加入浓度为10μg/mL(改良法为80μg/mL) 的秋水仙素0.1mL使最终浓度为0.2μg/mL(改良法为1.6μg/mL),37℃±0.5℃培养箱中继续处理90min(改良法为20min)。
3.低渗处理 秋水仙素处理完毕后,小心地从温箱取出培养瓶,用吸管吸取培养物入10mL锥形离心管内,离心(2000转,8min) (改良法为1700转,7min)。然后加入37℃温育的0.075mol/L的氯化钾溶液低渗液8mL,用吸管吹打成细胞悬液,置37℃水浴处理30min(改良法为20min)。
4.预固定 在每个离心管中加入2mL的固定液,混匀,2000转,离心8min(改良法为1700转,离心7min),弃上清液。
5.固定 在离心管中加入固定液8mL,立即用吸管轻轻吹打成单个细胞悬液,2000转,离心8min(改良法为1700转,离心7min),弃上清液。连续固定2次即可。
6.制片 在锥形离心管中滴入新鲜固定液0.5mL,用吸管将淋巴细胞团轻轻吹打成细胞悬液,从冰箱的冷冻室内取出冰片,每片滴加悬液4~5滴,每份标本滴2张片子。
7.老化 80℃烤片2h,进行显带,一般需尽快进行显带。
8.显带 一般用0.25%胰酶溶液显带后吉姆萨染液染色。显带前先挑出4片试片,胰酶消化时间从35秒钟开始,pH7.4磷酸盐缓冲液中漂洗3秒钟,染色液中染色8min或更长时间,然后用用自来水轻轻冲洗两面,室温干燥后上机镜检。找出条带清晰的条件批量消化染色处理。
四、统计学处理 随机抽取实验方法改良前和改良后的标本各200份,统计染色体分裂相总数和可用于分析的优质核型数目,基于SPSS18.0进行非参数秩和检验,以P<0.05为差异有统计学意义。
结 果
一、改良前后人外周血染色体核型结果 改良的人外周血染色体细胞培养和染色体制备方法获得的染色体分裂相数量明显增加,核型分散度会更好,长短适中的中期细胞会更多,显带后带纹更清晰,便于结果的分析诊断,见图1。
二、数据统计分析结果 为了进一步分析上述不同方法对实验结果的影响是否存在显著差异,我们对实验条件更改前后随机挑选各200份标本,分别进行统计分析,结果见表1。
1.分裂相数量统计 统计改良前培养72h和改良后培养96h各200份样本,每份样本扫描1张片,统计所扫描的全部分裂相。改良前200份样本总的获得25 371个分裂相;明显少于改良后200份样本获得的61 810个分裂相。非参数秩和检验Z=-13.421(P=0.000,P<0.05),提示改良后,分裂相显著增多,2组之间具有统计学差异意义。
2.可用的优质核型统计 分析改良前后染色体核型效果,在固定每张片分析固定数目核型的前提下,统计其中可分析的优质核型数。改良前200份标本中获得的10 000个分裂相中,可用的优质核型数为1 038个,明显少于改良后2 210个,非参数秩和检验Z=-12.493(P=0.000,P<0.05)见表2,提示改良后标本的可用的优质核型显著增多,2组之间具有统计学差异意义。结果表明技术改良可以有效的改善外周血染色体核型制备过程中存在的细胞分裂相少和染色体核型条带质量差的现状。
讨 论
一、标本接种 我们常规方法是接种0.5mL肝素抗凝血,之后改良法为接种0.8mL肝素抗凝血,细胞核型明显增多,接种量的多少还应根据实验室情况决定。接种血液量的多少也会对培养结果有影响,接种的太少,细胞稀薄,减慢了细胞生长速度;接种的太多,培养过程中细胞的营养成分不够,影响生长,难以得到合适的细胞。婴幼儿患者因外周血淋巴细胞中血红素含量高,会影响细胞的生长,我们适当减少接种量会改善细胞生长情况。因此,我们要本着年龄越小,接种量越少的原则进行种植细胞,4岁以下儿童接种量约为成人外周血接种量的4/5,新生儿约为成人外周血接种量的2/5[5]。接种后的肝素抗凝血标本放4℃冰箱保存备用,当有标本需要复查时可混匀后再次接种,我们最长接种保存了11d的样本,仍然能得到很好的细胞核型[5]。同时患者可以随时采集标本,放冰箱储存后集中处理,这样减少了患者往返医院的不便,极大的方便了患者标本采集,为患者节约了宝贵时间。影响人外周血染色体培养的因素非常多,比如实验室环境、操作人员的操作手法和经验、标本本身质量等,我们通过总结发现溶血标本和近期使用过抗生素治疗的标本,接种培养后很少能得到细胞核型,这是导致培养失败的最主要原因,在采集样本时就需要特别注意询问患者近期服药情况,按标准流程采血,采血过程要流畅,避免接种有质量问题的标本,这能有效的减少培养失败的情况。
二、培养时间 以前常规培养时间为72h,之后我们试过培养48h,发现染色体分裂相较少。培养96h较72h细胞分裂相增多2倍多,如果有更多的细胞分裂相在筛选时就可以留下更多优质的染色体核型,能得到更为清晰的染色体核型结果,这样显著提高了检测分析诊断效率。我们根据标本量集中接种,集中处理,减少了很多重复操作时间,极大的节约了标本制备的工作时间。
三、秋水仙素作用 秋水仙素的作用原理是通过干扰细胞中微管组装,抑制纺锤丝的进一步形成,让细胞停留在有丝分裂的中期[6]。加入秋水仙素的数量浓度、培养作用时间与细胞有丝分裂中期分裂相的多少及染色体的形态密切相关[7]。秋水仙素的作用浓度越高或者培养作用时间越长,能得到的中期分裂细胞就会越多,相反,如果秋水仙素的作用浓度越低或者培养作用时间越短,得到的中期分裂细胞就会越少。根据这个原理我们运用到改良方法中,加大了秋水仙素的浓度,减少了培养作用时间,仅这个步骤就节约1h多的作用时间,并且染色体的大小及分散情况更好,最终显带效果比常规方法条带更清晰,更容易发现异常结果,极大地提高工作人员检测诊断能力。
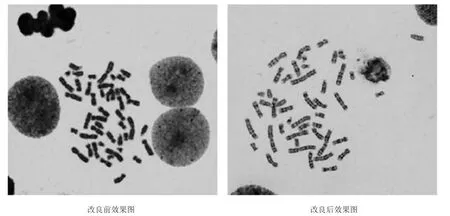
图1 改良前后外周血染色体核型原始结果比较

表1 改良前后主要操作步骤的改变情况

表2 改良前后分裂相数量和效果比较
四、低渗处理 低渗处理是人染色体标本制备中很重要的一步操作,低渗的作用是使细胞膜破裂,把染色体分散开,滴片时更好的平铺于玻片上,清除干扰染色体背景下杂质,便于染色体分散着色等[8]。如果低渗时间太短,分散良好的染色体会减少,干扰杂质偏多,显带效果变差,若低渗时间较长,又会使染色体破裂丢失很多,最后也无法分析结果[9]。笔者在实验工作中通过摸索低渗10min,15min,20min,25min及30min条件发现,当低渗时间为20min和25min时均可得到质量较好的染色体核型结果。因此,笔者将低渗处理时间改良为20min,方法与学者徐本锦[10]的一致。低渗过程中,低渗操作的时间和操作手法直接影响着最终染色体分散及显带的效果[11-13]。低渗液操作前30min需放37℃的水浴箱中恒温备用,要充分让低渗液与细胞液吹打混匀。
五、离心处理 离心处理的方法也影响着最终染色体核型的结果,操作时需要合适的离心力大小和离心时间[2]。离心力太小,干扰杂质不易清除,固定效果变差,显带效果差,染色体模糊不便分析,若离心力太大,低渗好的细胞容易破碎,大量染色体丢失,显带后检测会出现染色体太少或没有的情况,导致结果分析困难。笔者改良后在1700转条件下离心7min可得到的染色体数量比较合适。
综上所述,通过工作实践,改良方法比常规方法所得到的染色体核型显带结果质量更好,操作更简便,结果更稳定。实验操作时间也可根据工作需要灵活调整,标本可集中接种统一收获细胞,有效地节约了大量的工作时间,减少了重复的工作流程和试剂的反复浪费,且提高了检测质量和工作效率,同时增加了患者的服务体验,因此笔者认为改良方法是一种操作简便、结果稳定、显著提高分析诊断效率、有效的节约成本、有利于科室及患者的方法。

