3种冷季型草坪草对四氯乙烯胁迫的抗性响应
晋 松, 金 杰, 吴 克
(合肥学院 生物与环境工程系 安徽省环境污染防治与生态修复协同创新中心, 合肥 230601)
四氯乙烯(Tetrachloroethylene,PCE,又名全氯乙烯),是一种常见的氯代烃类衍生物,因其具有优良的溶解力、良好的洗涤效果和优良热稳定性等特点,被用作干洗剂、金属脱脂溶剂、脱硫剂及有机合成中间体等[1-2],在精密机械、微电子、制药、干洗、农药等领域得到广泛应用。自实现工业化生产以来,PCE的生产能力得到发展,截至2016年8月份,四氯乙烯全球年产量约70万t,我国总产能约30.2万t;其中约有10%~15%通过废水进入土壤、地表水及地下水底层和包气带中形成羽状污染带[3-4],是地下水体中检出率最高的有机污染物[5],其污染范围已扩展到全球[6-7]。PCE易被人体和动物表皮、黏膜吸收[8],长期吸入该物质可产生致癌效应[9],因而被各个国家或地区普遍列入“优先控制污染物”中首要监控对象,对PCE污染水体和土壤的生态修复正逐步成为全球有机污染物环境研究的热点。
目前,PCE污染的毒理研究主要集中于动物和人体[10-11],对植物的毒理效应研究尚处于起步阶段,且多限于大豆、小麦等经济作物,但实际受PCE直接影响的植物应多以野生地表植被为主。同时,采用植物修复法对PCE污染的水体和土壤进行生态恢复还具有成本低、侵入性低、促进碳隔离和环境稳定等优点,易于为大众所接收。因此,本文选取高羊茅(Festucaelata)、黑麦草(Loliumperenne)、鸭茅(Dactylisglomerata)这3种耐旱、休眠期短、根系发达,且于自然生态环境和人工造景中均普遍栽培的冷季型草坪草为供试物种,通过模拟室内水培环境,研究水体中PCE污染对植物种子萌发、幼苗生理影响,以及对植株体内活性氧清除系统的毒理效应,从而筛选出对PCE敏感性和抗逆性较强的植株,以期为今后深入探讨地表植被对PCE毒害的植物修复机制及指示生物角色等研究提供理论依据。
1 材料与方法
1.1 试验材料与设计
供试植物:高羊茅(贝克Pixie)、黑麦草(启明星 Morningstar)、鸭茅(阿索斯 Athos),购于安徽省畜牧技术推广总站草业中心。供试溶液采用Hoagland营养液。
选取饱满种子,以0.2%双氧水浸泡15 min消毒,后蒸馏水淋洗、滤纸吸干。预处理后,将每品种50粒种子放于铺垫2层滤纸的培养皿中。通过半致死试验确定浓度范围,以Hoagland营养液为稀释液、10%乙醇为助溶剂,一次性施入PCE,配置成浓度梯度分别为4、8、12、16和20 mg/L的溶液,以原液为对照(CK)。将培养皿置于25 ℃±1 ℃环境下,设置光强不低于40 μmol/m2·s,每日光照15 h培养,滤纸保持湿润。设置6个PCE浓度梯度及3个草坪草品种处理的正交试验,每处理3个重复。
1.2 测试指标及方法
1.2.1 种子萌发情况测定
种子萌发24 h后,分别于第4天、第7天统计其发芽势、发芽率,连续20 h观察记录其发芽情况,直至对照组发芽率不再变化为止并计算发芽指数。
发芽势(%)=4 d发芽种子数/供试种子总数×100%
发芽率(%)=7 d发芽种子数/供试种子总数×100%
发芽指数Gi=Σ(Gt/Dt)
Gi为发芽指数,Gt为t时间内的发芽数,Dt为相应的发芽天数。
1.2.2 幼苗生理指标测定
20 d后,以电导仪(DDS-11D型)测得电导率,以相对电导率表征细胞膜透性。采用硫代巴比妥酸法测定MDA含量[12](μmol/g·FW) ;采用酸性茚三酮法测定脯氨酸含量(μg/g·FW) 。
1.2.3 幼苗叶片抗氧化酶活性测定
分别采用南京建成生物工程研究所出售的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性测定试剂盒进行测定,测试方法分别为黄嘌呤氧化酶法、比色法及可见光法。酶活性单位以U/g·min(FW)表示。
1.3 数据分析
数据分析采用SPSS13.0统计软件,用平均值和标准误表示测定结果;对同一品种草坪不同PCE浓度处理进行组间差异显著性分析(P<0.05,P<0.01,采用One-Way ANOVA过程) 和多重比较(采用SNK-q检验法)、Pearson相关系数计算。
2 结果与分析
2.1 PCE对草坪草种子萌发的影响
梯度浓度PCE处理下,3种草坪草种子的萌发状况存在明显差异(表1)。高羊茅种子萌发状况较对照组无显著差异,发芽率、发芽势、发芽指数与PCE处理间相关系数分别为-0.59、-0.69、-0.74,无显著相关性。
PCE处理下鸭茅、黑麦草种子发芽率、发芽指数持续受抑,但低浓度PCE(0~8 mg/L) 对鸭茅种子发芽势有轻微促进作用。当PCE浓度达20 mg/L时,鸭茅、黑麦草种子发芽率分别较之对照组降低51.4%、31.5%。鸭茅种子发芽势、发芽率、发芽指数与PCE处理间相关系数分别是-0.81(P<0.01)、-0.96(P<0.05)、-0.86(P<0.05);黑麦草种子发芽势、发芽率、发芽指数与PCE处理间相关系数分别为-0.87、-0.85、-0.73,均呈现显著相关性(P<0.05)。
2.2 PCE对草坪草幼苗叶片细胞膜透性的影响
由图1可知,3种供试草坪草幼苗叶片的电导率随PCE浓度的递增呈持续升高趋势。在PCE最高浓度下,高羊茅、黑麦草、鸭茅叶片电导率分别为对照组的2.95倍、5.16倍、4.62倍,与PCE处理的相关系数分别为0.98、0.95、0.95,均呈极显著正相关(P<0.01)。

表1 PCE对草坪草种子萌发的影响(平均数±标准误)
注:不同小写字母表示不同PCE浓度处理组间差异显著(P<0.05);下同
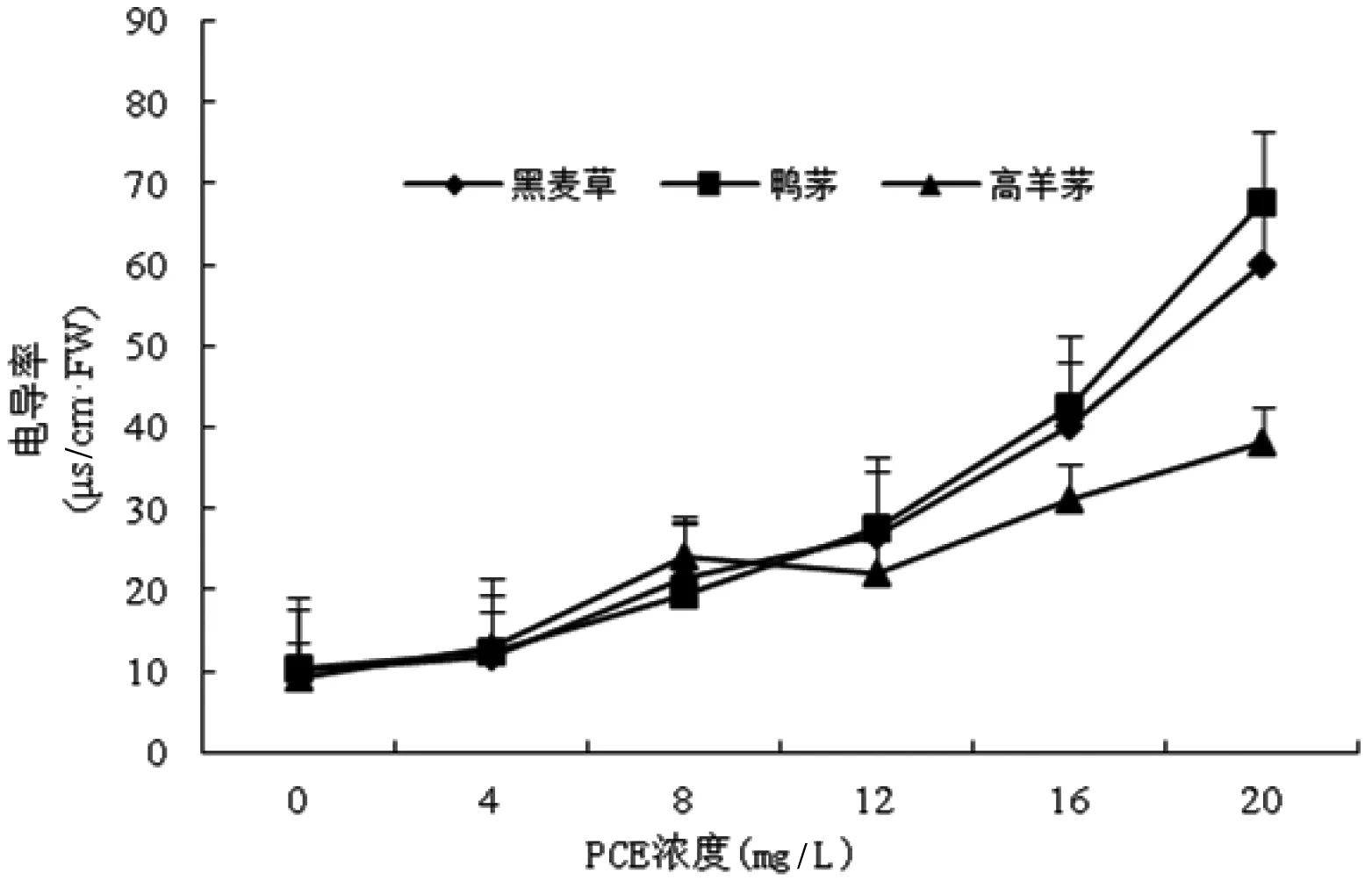
图1PCE对草坪草幼苗叶片细胞膜透性的影响
Figure 1 Effects of PCE on CMP in leaf of turfgrass seedling

图2 PCE对草坪草叶片MDA含量的影响
2.3 PCE对草坪草幼苗叶片MDA含量的影响
如图2所示,随着PCE浓度的增加,3种草坪草幼苗叶片的MDA含量逐渐上升,当PCE浓度为20 mg/L时,高羊茅、鸭茅、黑麦草叶片MDA比之对照组分别增长了4.44倍、3.82倍。而黑麦草叶片MDA含量受PCE浓度影响不大,其峰值仅比对照组增加了14%。高羊茅、鸭茅、黑麦草的MDA含量与PCE处理间相关系数分别为0.95、0.92、0.94,呈极显著正相关(P<0.01)。
2.4 PCE对草坪草叶片幼苗脯氨酸含量的影响
PCE处理下,3种草坪草幼苗叶片脯氨酸含量具有显著差异(图3)。低浓度PCE(0~8 mg/L)影响下,高羊茅叶片脯氨酸含量减少,至PCE浓度为8 mg/L时降至最低,较对照组减少46.91%。而后随着PCE浓度的继续升高(8~20 mg/L),脯氨酸在叶片中逐渐累积,并在较高浓度PCE(16~20 mg/L)影响下急剧增长,最高值较对照组高出1.72倍,高羊茅脯氨酸含量与PCE处理间相关系数为0.82(P<0.05)。
鸭茅、黑麦草叶片的脯氨酸含量随着PCE浓度的增加而呈持续升高的趋势,当PCE浓度为20 mg/L时达到最高值,其峰值分别为对照组的4.07倍、5.61倍,鸭茅、黑麦草脯氨酸含量与PCE处理间相关系数分别为0.97(P<0.01)、0.95(P<0.01)。

图3 PCE对草坪草叶片脯氨酸含量的影响
2.5 PCE对草坪草幼苗叶片抗氧化酶的影响
2.5.1 PCE对幼苗叶片SOD活性的影响
在梯度浓度PCE胁迫下,3种供试植株幼苗体内SOD活性变化趋于一致(图4)。低浓度PCE(0~8 mg/L)诱使黑麦草、鸭茅叶片SOD活性略有上升,当PCE浓度为8 mg/L时两种植株SOD的活性峰值较CK分别增长了56.3%、72.9%。当PCE为20 mg/L SOD活性最低,此时鸭茅、黑麦草叶片的SOD活性分别为CK的73.6%、50.7%。PCE对鸭茅、黑麦草叶片的SOD活性抑制率分别为26.4%和49.3%。
高羊茅叶片SOD活性抗性高峰出现在较高浓度的PCE处理组中(12 mg/L),此时SOD峰值较对照组增长了68.5%。之后,当PCE继续升高至浓度为20 mg/L,高羊茅叶片SOD活性仍较对照组高出17.6%。高羊茅、鸭茅、黑麦草叶片的SOD活性与PCE处理间相关系数分别为-0.841(P<0.05),-0.965(P<0.01),-0.954(P<0.01)。

图4 PCE对3种草坪草的叶片SOD活性的影响
2.5.2 PCE对幼苗叶片CAT活性的影响
在PCE处理下,3种供试植株幼苗叶片CAT活性均先上升继而下降;较低浓度PCE处理(高羊茅<12 mg/L,鸭茅、黑麦草<8 mg/L)对叶片的CAT活性具有诱导作用(图5)。高羊茅叶片CAT活性于PCE 12 mg/L时呈现抗性峰。高羊茅、鸭茅、黑麦草最高CAT活性分别为对照组的1.94倍、3.15倍、4.41倍。较高浓度PCE(高羊茅>12 mg/L,鸭茅、黑麦草>8 mg/L)对叶片CAT活性具抑制效应。高羊茅、鸭茅、黑麦草叶片的CAT活性在PCE影响下抑制率分别为15.3%、14.7%、27.9%,与PCE处理间的相关系数分别为-0.710,-0.977(P<0.01),-0.886(P<0.01)。
2.5.3 PCE对幼苗叶片POD活性的影响
由图6可知,低浓度PCE处理下(0~8 mg/L),高羊茅、黑麦草和鸭茅叶片中POD活性均随PCE浓度的递增呈上升趋势,说明低浓度的PCE可以促进高羊茅幼苗的生长,高羊茅、黑麦草和鸭茅叶片POD活性的峰值分别较对照组上升了34.9%、25.3%、53.6%。随PCE浓度继续升高,3种草叶片POD活性则逐渐下降。高羊茅、黑麦草和鸭茅叶片POD活性与PCE处理之间的相关系数为-0.852(P<0.05)、-0.572、-0.653,高羊茅叶片POD活性与PCE浓度之间呈显著负相关,黑麦草和鸭茅叶片POD活性与PCE浓度之间无显著相关性。

图5 PCE对草坪草叶片CAT活性的影响

图6 PCE对3种草坪草POD活性的影响
3 讨论
较植株成体而言,种子萌发和幼苗生长阶段对外界环境不利因素更为敏感[13]。本试验结果显示,PCE处理对高羊茅种子萌发不构成剂量效应;鸭茅、黑麦草种子萌发虽均呈受抑趋势,但相同PCE浓度下(0~8 mg/L)黑麦草种子的劣变程度高于鸭茅。因此,高羊茅种子萌发对PCE胁迫具有抗性,黑麦草表现出敏感性。
MDA是细胞膜脂过氧化作用的重要产物,其含量指示膜脂过氧化程度。在较低PCE浓度下(0~12 mg/L),PCE对高羊茅的质膜损伤较小,黑麦草与鸭茅细胞质膜抗性较差。高浓度PCE(16~20 mg/L)胁迫下高羊茅的细胞膜脂质过氧化作用最强。
生物细胞对膜脂过氧化的主要应对策略是调整渗透势平衡,其中,脯氨酸就是一类具代表性的渗透调节物质,对稳定生物大分子结构、清除过量活性氧自由基及减轻膜脂过氧化反应等具有重要意义[14]。本试验中,鸭茅、黑麦草叶片的脯氨酸含量在外加PCE后立即进行累积,高羊茅则先抑制继而累积;高羊茅叶片脯氨酸含量最高、黑麦草最低。该结论证实,脯氨酸累积是植株对PCE毒害的应激响应,PCE抗性强的品种可积累较多的脯氨酸,因此,脯氨酸含量可作为衡量植物对PCE胁迫进行适应性代谢调整的生理指标,这与张义贤[15]和Metha[16]等人的研究成果一致。
SOD、POD、CAT等酶活性之间的动态平衡是维持超氧自由基和H2O2稳态水平的关键[17]。本研究中,低浓度PCE胁迫下的植株细胞能够提高酶活性,但在更高浓度PCE或更长时间胁迫下,草坪草叶片细胞无法通过提高抗氧化酶活力来消除胁迫产生的氧化压力,导致活性氧过量积累,对蛋白质、脂类、核酸等生物大分子造成氧化损伤,引发活性氧过量累积[18-19]。结合电导率、MDA和脯氨酸的变化趋势,本研究进一步证实,逆境条件能够通过促使活性氧生成增多,或抗氧化酶清除能力减弱[20]。此外,SOD作为活性氧清除的首要位点[21],而POD作为敏感性较高的适应性酶,两者都能够更好地反映植物体内代谢水平及对外界环境的适应性[22]。
在各组PCE处理中,高羊茅SOD、CAT活性的抗性峰出现均迟于鸭茅和黑麦草,且SOD、POD活性基本持续高于鸭茅和黑麦草,亦证实高羊茅叶片抗氧化酶系统的平衡阈值高于鸭茅、黑麦草,对PCE胁迫的抗逆性优于其他两种草坪草;鸭茅的活性氧清除系统最敏感。3种草坪草对PCE浓度的抗性顺序从高到低依次为高羊茅、鸭茅、黑麦草。
4 结论
1) PCE处理(0~20 mg/L)对高羊茅种子萌发无显著剂量-效应关系,3种草坪草种子萌发对PCE胁迫的抗性从高到低依次为高羊茅、鸭茅、黑麦草。
2) PCE处理下,植株叶片脯氨酸含量大量积累,积累效率与对PCE的抗性大小成正比,其含量可以作为衡量植物对PCE胁迫抗性强弱的生理指标。
3) 综上,高羊茅对于PCE胁迫的抗逆性优于鸭茅和黑麦草,黑麦草对PCE胁迫最敏感。因此,高羊茅可作为PCE污染地区生态修复的地面植被,而黑麦草对PCE的土壤和地下室污染具有生物指示意义。

