弱激光预照射联合有氧运动对增龄大鼠骨骼肌SIRTs/PGC-1α轴及IGF-1蛋白表达的影响
刘延莹 杨海平 冯庆鲲 李方晖
1 肇庆学院体育与健康学院(广东肇庆526000)
2 南京师范大学体育科学学院(江苏南京210046)
肌肉减少症是一种以骨骼肌(Ⅱ型肌纤维为主)质量、肌力和功能增龄性减退为主要特征的退行性病变,已成为对老年人口危害最严重、影响最广泛的全球性医学难题之一。随着人口老龄化的加速,肌肉减少症的防治已成为重要的研究课题。长期以来,抗阻运动被认为是对抗肌肉减少症的有效方式[1]。然而,老年人进行抗阻运动存在一定的难度和风险[2]。鉴于有氧运动对老年人心肺功能、体成分以及心血管健康有改善作用,往往作为老年人推荐的运动方式。研究显示[3],老年人进行9~12 个月适宜有氧运动后,腓肠肌Ⅰ型和Ⅱa 型肌纤维横截面积均增大,毛细血管密度增多。此外,有氧运动可诱导老龄小鼠骨骼肌线粒体发生一系列适应性改变,对提高线粒体功能、防止肌细胞凋亡有重要意义[4]。然而,在临床应用方面,肌肉减少症患者的运动水平很低[5],直接采用运动疗法容易造成损伤[6,7]。
弱激光疗法(low level laser therapy,LLLT)是通过照射生物系统产生光生物调节作用(photobiomodulation,PBM)来刺激或抑制生物功能的一种有效康复手段,不会对生物系统产生不可逆的损伤[8]。研究发现,LLLT 可用于肌肉减少症的防护[9,10]。然而,单独采用LLLT的作用较有限[11]。近年来,研究者逐渐探究LLLT和运动二者联合对骨骼肌的调节作用。文献报道,运动前采用LLLT 预照射不仅延迟骨骼肌疲劳发生[12],而且有效提高骨骼肌功能和运动能力[13,14]。因此,运动前采用LLLT 预照射疗法对运动水平较低的肌肉减少症患者的治疗具有重要借鉴意义。
然而,目前LLLT联合有氧运动干预肌肉减少症的机制尚不明确。线粒体稳态失衡是肌肉减少症发生机制之一[15,16]。研究指出,有氧运动效应主要是激活过氧化物酶体增殖物激活受体γ辅激活子1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)引起线粒体生物合成增加[1]。PGC-1α是线粒体生物合成的关键调控者,对衰老骨骼肌线粒体稳态调节起重要作用[17]。Ⅲ型组蛋白去乙酰化酶(Sirtuins,SIRTs)是乙酰胺腺嘌呤二核苷酸(Nicotimide AdenosineDinucleotide+,NAD+)依赖的去乙酰化酶,在衰老和衰老相关性疾病中发挥重要调控作用[18]。SIRTs包括SIRT1-SIRT7七个家族成员。研究表明,SIRTs通过调控PGC-1α转录活性调节衰老骨骼肌线粒体稳态[18,19]。胰岛素样生长因子1(insulin like growth factor 1,IGF-1)是骨骼肌蛋白质合成的重要调控因子,对于维持肌肉质量至关重要[20]。IGF-1 激活引起骨骼肌肥大效应是对抗增龄性肌肉减少的有效途径[1]。事实上,PGC-1α与氧化应激、炎症和骨骼肌蛋白质水解等多个信号通路之间存在“串流”[17]。Sendri 指出,PGC-1α可通过抑制叉头转录因子(Forkhead box O,FOXO)的转录活性影响IGF-1/磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号轴降低衰老骨骼肌蛋白质降解[21]。Ruas等进一步研究发现,PGC-1α基因亚型PGC-1α4在肌纤维肥大效应中起重要作用,可能与激活IGF-1表达有关[22]。这些研究表明,IGF-1可能是PGC-1α的下游调控因子。因此,骨骼肌SIRTs-PGC-1α轴激活不仅有利于维持线粒体稳态,还可能激活IGF-1。研究发现,LLLT[23]和体育运动[24]可以增加NAD+和其还原形式NADH的比值(NAD+/NADH),提高SIRTs 活性。然而,LLLT 联合有氧运动如何调控SIRTs-PGC-1α轴?对IGF-1 蛋白表达的影响如何?尚不清楚。基于此,本研究探讨LLLT联合有氧运动对SIRTs-PGC-1α轴和IGF-1蛋白表达的影响,探讨LLLT预照射联合有氧运动对增龄骨骼肌肌肉质量减少的效应及可能机制,为肌肉减少症的防治提供理论依据。
1 对象与方法
1.1 实验动物分组
32只18月龄雌性SD大鼠购于广州中医药大学动物中心,体重平均为378.4± 11.2 g,在室温20~24℃、光照时间07:00~19:00 条件下,分笼饲养,适应性喂养1 周后,随机分为安静对照组(sedentary control,SC组)、有氧运动组(aerobic exercise,AE 组)、弱激光照射组(low level laser therapy,LLLT 组)和LLLT 预照射联合有氧运动组(LLLT pre-irradiation combined aerobic exercise,LLLE组),每组各8只。
1.2 实验方案
SC 组大鼠自由生活;AE 组参照Bejma 等[40]18月龄大鼠训练负荷方案,进行为期8 周、速度15 m/min、坡度5°、每天15 min 跑台运动,负荷强度相当于60%~75% VO2max;LLLT 组采用810 nm Ga-Al-As 激光器照射大鼠双侧大腿前侧中间部分,每侧照射两个点,单点照射时间30 s,照射面积0.4 cm2,输出功率50 mW,功率强度125 mW/cm2,能量密度为3.75 J/cm2,1 次/天,5 d/周,持续8 周;LLLE 组大鼠每次运动前进行弱激光预照射,方案分别同LLLT组和AE组,1次/天,5 d/周,连续8周。
1.3 测试指标与方法
1.3.1 腓肠肌指数
最后一次实验结束48 h后将大鼠麻醉处死称重,取两侧腓肠肌组织称重并计算腓肠肌指数:腓肠肌指数=[腓肠肌质量(mg)/体重(g)]。
1.3.2 总mRNA提取及Real Time-PCR反应
取50~100 g 腓肠肌组织块加入液氮和Trizol 在研钵中研磨成粉,然后按试剂说明书操作步骤进行总RNA 提取、逆转录反应和PCR 反应。所需试剂购自大连宝生物科技公司。去乙酰化酶1-7(sirtuin1-7,SIRT1-7)、PGC-1 α、线 粒 体 转 录 因 子A(mitochondrial transcription factor a,TFAM)和核呼吸因子(nuclear respiratory factor 1,NRF-1)扩增引物基于Genebank查找序列采用Primer Express 3.0软件设计,由上海英维捷基生物公司合成。以大鼠β-肌动蛋白(β-actin)作为内参,根据公式2-△△Ct计算目的基因的相对表达量。

表1 基因引物序列(5’-3’)
1.3.3 Western Blot测定IGF-1蛋白表达
使用RIPA裂解液裂解腓肠肌组织,采用BCA蛋白定量试剂盒测定蛋白浓度,并统一调成3 μg/μl,分装,-80℃保存备用。取出蛋白样品,放入沸水中煮沸8 分钟使蛋白变性,冷却后待用。依据BCA 法所测的蛋白浓度,在上样孔内加入等量的总蛋白。经12%SDS-PAGE 分离后,将蛋白转至NC 膜上。用5%脱脂奶粉室温封闭2 小时,洗涤后加入IGF-1 一抗(1︰200稀释,购自Santa Cruz Biotechnology公司),4℃孵育过夜。次日用1 × TBST 洗膜10 min × 3 次,加山羊抗鼠二抗(1∶10000 稀释,购自Santa Cruz Biotechnology公司),室温孵育1.5 小时,1 × TBST 洗膜5 min × 4次。取适量ECL 荧光底物(购自Pierce 公司)A 液和B液按1∶1 比例混匀后,将膜浸泡其中,室温孵育3~5 min后,用滤纸将膜表面液体擦干,并将其置于暗室,取医用X光底片覆盖,曝光1分钟后,依次显影、定影。
1.4 统计学处理
使用SPSS17.0 软件进行数据处理,实验结果均以均值±标准差()表示,采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 不同干预方法对增龄大鼠腓肠肌质量和腓肠肌指数的影响
表2结果显示,各组大鼠体重均没有显著性差异(P>0.05);与SC组相比,AE组、LLLT组和LLLE组腓肠肌质量(P<0.05)和腓肠肌指数(P<0.01)增加;LLLE 组腓肠肌指数高于AE组(P<0.05)和LLLT组(P<0.05)。
2.2 不同干预方法对增龄大鼠腓肠肌SIRTs 基因mRNA表达的影响
图1结果显示,与SC 组相比,AE 组SIRT1(P<0.01)、SIRT2(P<0.05)以及SIRT3-7 mRNA(P<0.01)表达升高,LLLT 组SIRT1-5 mRNA(P<0.05)表达升高,LLLE 组SIRT1(P<0.01)、SIRT2(P<0.05)、SIRT3(P<0.01)、SIRT4(P<0.05)、SIRT5(P<0.01)和SIRT7 mRNA(P<0.01)表达均升高;与AE 组相比,LLLT 组SIRT3 (P<0.05)、SIRT6 (P<0.01)和SIRT7 mRNA(P<0.01)表达降低,LLLE 组SIRT1(P<0.05)、SIRT3 mRNA(P<0.01)表达升高,SIRT6 mRNA表达降低(P<0.01);与LLLT 组相比,LLLE 组SIRT1 mRNA (P<0.05)、SIRT3(P<0.01)和SIRT7 mRNA(P<0.01)表达升高。
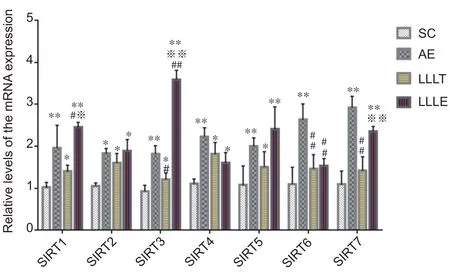
图1 不同干预组增龄大鼠腓肠肌SIRT1-7 mRNA表达
2.3 不同干预方法对增龄大鼠腓肠肌线粒体生物合成相关基因mRNA表达的影响
图2结果显示,与SC组相比,AE组(P<0.01)、LLLT组(P<0.05)和LLLE 组(P<0.01)的PGC-1α mRNA 表达水平均升高,LLLE组的PGC-1α mRNA 表达水平高于AE 组(P<0.05)和LLLT 组(P<0.01);与SC 组相比,AE 组、LLLT 组和LLLE 组NRF-1 mRNA(P<0.05)和TFAM mRNA(P<0.01)表达水平升高,三组间无显著性差异(P>0.05)。

图2 不同干预组增龄大鼠腓肠肌PGC-1α、NRF-1和TFAM mRNA表达
2.4 不同干预方法对增龄大鼠腓肠肌IGF-1蛋白表达的影响
图3结果显示,与SC组相比,AE组(P<0.05)、LLLT组(P<0.05)和LLLE组(P<0.01)的IGF-1蛋白表达水平均升高;LLLE组的IGF-1蛋白表达水平高于AE组(P<0.05)和LLLT组(P<0.05)。

图3 不同干预组增龄大鼠腓肠肌IGF-1蛋白表达
3 讨论
增龄过程伴随骨骼肌质量减少,是肌肉减少症的典型特征。动物研究表明,大鼠性成熟期(6~12月龄)后,后肢骨骼肌质量逐渐下降,表现为肌纤维数目和横截面积减少,到老年期约减少20%~25%[11]。Marzetti 等[25]研究不同月龄(8、18、29 和37月龄)大鼠腓肠肌质量变化趋势发现,大鼠骨骼肌质量从18月龄开始下降,随着年龄增加逐渐下降并伴随DNA 凋亡片段的增加。也有研究发现,大鼠增龄至22月龄时,腓肠肌质量和体积均显著下降[26],腓肠肌质量和腓肠肌指数分别比3月龄年轻大鼠降低24%和20%[27]。本研究选取18月龄自然衰老的雌性大鼠,干预8周后终止实验,即最终研究对象为20月龄大鼠。结合上述文献推测,本研究大鼠在20月龄时已经出现明显的增龄性骨骼肌质量减少。
3.1 弱激光预照射联合有氧运动对增龄大鼠腓肠肌质量的影响
体育运动是应对肌肉减少症的有效措施[28]。耐力运动过程中,骨骼肌被长时间动员,可促进肌纤维横截面积、线粒体体积、线粒体酶活性和抗氧化水平增加、抑制凋亡信号,诱导骨骼肌产生良好适应。Pasini 等[29]研究发现,8周大强度运动可使16~18月龄增龄大鼠肌肉减少症得到明显改善。Song 等[30]研究揭示,12 周中等强度大负荷量(15 m/min,15° incline,60 min/day,5 days/week)运动使27月龄增龄大鼠腓肠肌质量增加了14.4%。Kang 等[31]研究报道,12 周中等强度跑台运动(17.5 m/min,10%坡度)使22月龄增龄大鼠比目鱼肌质量增加6%,比目鱼肌指数增加11%。本研究发现,8 周中等强度低负荷量有氧运动(60%~75%VO2max,15 m/min,5° incline,15 min/day)诱导20月增龄大鼠腓肠肌质量和腓肠肌指数分别增加23%和19.4%。然而,Andersen 等[26]发现,18月龄雌性增龄大鼠经过9 周适度跑台运动(5 days/week,1 h/day,8 m/min)后,腓肠肌质量和体积均没有显著增加。漆正堂等[4]研究也发现,以65%~75%最大负荷进行每天1 h连续4 周耐力运动后,老龄小鼠骨骼肌不但质量没有改变,而且DNA 氧化损伤可能加剧。由此可见,尽管有氧运动可作为干预增龄性骨骼肌质量减少的有效手段,但具体实施方案可能有待于进一步优化。
目前,LLLT在改善肌肉功能和治疗肌萎缩方面显示出良好的应用前景。Nakano 等[10]研究揭示,LLLT 可通过刺激肌卫星细胞增殖和血管生成促进废用性萎缩骨骼肌康复。Corazza 等[9]发现,连续12 周LLLT(850 nm,100 mW,120 J/cm2,0.5 cm2)照射可显著增加围绝经期大鼠股直肌体积分数。本研究发现,来自Ga-Al-As 激光器的LLLT(810 nm,125 mW/cm2,0.4 cm2,30 s)照射处理8周(1次/天,5次/周),腓肠肌质量和腓肠肌指数分别比对照组增加18%和15%,表明单独LLLT 对增龄大鼠骨骼肌质量减少也具有一定效果。然而,LLLE组大鼠的腓肠肌质量和腓肠肌指数升高更为明显,分别比对照组增加37.7%和37.5%。可见,LLLE 干预能更有效阻止增龄大鼠骨骼肌质量减少。Amadio 等[11]研究也发现,LLLT(808 nm,1.071 W/cm2,0.028 cm2,40 s)预照射联合游泳运动(90 min/day,6 days/week)干预6 周可将老龄大鼠显著减少的腓肠肌横截面积恢复到年轻大鼠水平,单独运动也能引起老龄大鼠腓肠肌横截面积显著增加,然而单独LLLT 没有显著效果。尽管本研究没有测定腓肠肌横截面积,但从腓肠肌质量和腓肠肌指数评价指标不难发现,LLLE 对增龄性肌肉减少干预效果优于单独LLLT或AE干预,二者可能具有叠加效应,与我们的研究结果一致。
3.2 弱激光预照射联合有氧运动对增龄大鼠骨骼肌SIRTs基因和线粒体生物合成相关基因表达的影响
线粒体生物合成能力下降导致骨骼肌线粒体稳态失调,是肌肉减少症发生机制之一[15,16]。PGC-1α是线粒体生物合成的主要调控者,可调控下游基因如NRF-1 和TFAM 表达,对骨骼肌线粒体稳态调节起重要作用。SIRTs 是哺乳动物衰老过程主要的调控因子[32]。研究指出,SIRTs在抗氧化防御、线粒体动力学、自噬等线粒体应激反应中起至关重要的作用[33]。SIRTs 可通过去乙酰化调控PGC-1α转录活性,调节线粒体生物合成[18,19]。可见,SIRTs-PGC-1α轴对调控骨骼肌线粒体生物合成,维持衰老骨骼肌线粒体稳态发挥重要作用。
SIRTs 是体育运动发挥有益效应的分子基础[24]。目前,运动对SIRT1和SIRT3的影响研究较多。耐力运动训练后,增龄骨骼肌SIRT1和SIRT3活性升高[34]。然而,运动对骨骼肌SIRT2、SIRT4~SIRT7 的影响研究较少。本研究发现,8 周中等强度AE 促进增龄大鼠腓肠肌SIRT1~7 mRNA表达水平均显著升高。耐力运动是刺激PGC-1α表达的有效方式[17]。体育运动过程中,细胞能量感受器腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK)激活引起NAD+/NADH 比值增加,进而激活SIRTs,同时AMPK诱导PGC-1α磷酸化并使其在随后的SIRTs 去乙酰化过程中激活[35]。本研究发现,8 周AE 后,腓肠肌PGC-1α、NRF-1 和TFAM mRNA 表达均显著增加。提示,AE 可能激活SIRTs/PGC-1α轴,增加NRF-1 和TFAM mRNA 表达,提高增龄大鼠骨骼肌线粒体生物合成,有利于维持衰老骨骼肌线粒体稳态。
LLLT 可以增加NAD+/NADH 比值[23],提高SIRTs 活性。本研究发现,8 周LLLT 诱导增龄骨骼肌SIRT1-5 mRNA、PGC-1α、NRF-1 和TFAM mRNA 表达均增加。可见,LLLT 在一定程度上影响增龄骨骼肌SIRTs水平,引起PGC-1α下游基因mRNA表达改变。本研究还发现,LLLE诱导增龄大鼠骨骼肌SIRT1-7、PGC-1α、NRF-1 和TFAM mRNA 水平均升高。此外,LLLE 组SIRT1和SIRT3 mRNA水平均高于AE组和LLLT组,这与LLLE 对PGC-1α mRNA 的影响效果恰好一致。研究揭示,SIRT1和SIRT3去乙酰化并激活PGC-1α,在调控线粒体功能方面具有协同作用[36]。据此推测,LLLE可能主要通过双重调控SIRT1/SIRT3-PGC-1α轴,诱导NRF-1和TFAM表达,提高线粒体生物合成能力,从而实现对衰老骨骼肌线粒体稳态调控。
3.3 弱激光预照射联合有氧运动对增龄大鼠骨骼肌IGF-1蛋白表达的影响
骨骼肌蛋白质合成减少和降解增加是肌肉减少症发生重要机制之一。研究发现[37],IGF-1一方面通过激活PI3K/Akt/mTOR 通路促进蛋白质合成,另一方面通过抑制氧化应激诱导的线粒体功能失调和细胞色素c释放保护细胞免于凋亡,在延缓增龄性骨骼肌丢失中起重要作用。长期以来,抗阻运动被认为是刺激IGF-1表达的最有效方式[1]。本研究发现,8周AE也可引起增龄大鼠骨骼肌中IGF-1蛋白表达增加。骨骼肌中IGF-1 表达可以被LLLT 所促进[38]。本研究发现,8 周LLLT可促进增龄大鼠骨骼肌IGF-1 蛋白表达。此外,LLLE组IGF-1 蛋白表达极显著升高。Corazza 等[9]发现,LLLT、抗阻运动以及LLLT联合抗阻运动可显著增加切除卵巢大鼠股直肌IGF-1浓度和体积分数。遗憾的是,本研究没有进行形态学测定,但结合腓肠肌质量和指数测定结果不难发现,AE组、LLLT组和LLLE组IGF-1蛋白的变化与腓肠肌质量和腓肠肌指数改变一致。提示,IGF-1蛋白表达增加促进增龄骨骼肌质量增加。
本研究还发现,LLLE 促进IGF-1 蛋白表达效果优于AE 和LLLT。这与LLLE 对SIRT1、SIRT3 和PGC-1α mRNA的影响效应一致。研究揭示[17],PGC-1α牵涉在控制肌肉质量和功能的一系列细胞事件中。PGC-1α水平升高可通过降低凋亡、自噬和蛋白酶体降解阻止衰老骨骼肌质量减少[39]。Sendri[21]发现,PGC-1α可通过IGF/PI3K/AKT/mTOR 轴降低衰老骨骼肌蛋白质降解。Ruas等[22]研究进一步发现,PGC-1α亚型PGC-1α4表达增加可引起IGF-1 表达增加和肌肉生长抑制素myostatin基因表达降低,诱导肌纤维肥大。有趣的是,PGC-1α4 转基因表达小鼠,其骨骼肌质量和力量均增加[22]。这些研究表明,IGF-1 可能是PGC-1α的下游调控因子。结合上述LLLE 对增龄大鼠肌肉减少的干预效果以及对SIRT1/SIRT3-PGC-1α轴的调控作用,可以推测,LLLE促进增龄大鼠骨骼肌质量增加可能主要与LLLE 双重调控SIRT1/SIRT3-PGC-1α轴,一方面促进NRF-1和TFAM mRNA表达,维持线粒体稳态,同时激活IGF-1蛋白表达有关。
4 结论
弱激光预照射联合有氧运动对增龄性骨骼肌质量减少干预效果优于有氧运动和弱激光疗法,可能主要依赖于双重调控SIRT1/SIRT3-PGC-1α轴,一方面提高增龄骨骼肌线粒体生物合成能力,维持线粒体稳态,另一方面,激活增龄骨骼肌IGF-1蛋白表达。

