基于蛋白质组学技术的羚羊角的研究与分析
王玉团,石峰,杭宝建,梁翠荣,咸瑞卿,巩丽萍
山东省食品药品检验研究院,山东 济南 250101
羚羊角为牛科动物赛加羚羊SaigatataricaLinnaeus的角。临床多以粉末直接入药,具有平肝息风、清肝明目、散血解毒之功能[1],特别是治疗婴幼儿高烧能起到立竿见影的效果,并且作用持久、不易反复回升、无毒副作用[2-3]。此外还具有非常好地清肺热和抗惊厥等药理作用,故羚羊角在120多种中成药中广泛使用。
羚羊角素有“羚羊仙角”的美誉,价格非常昂贵,目前市场上去掉骨塞的一等品每千克售价约20 000元,未去掉骨塞的一等品每千克售价约13 000元。以质嫩、色白光润如玉、有血丝者为佳(角壳最嫩的角尖部位)。根据上述市场等级规格划分及性状描述可知,羚羊角角壳与骨塞价格和药效具有一定差异,故在《中华人民共和国药典》(以下简称《中国药典》)1995年版之前的历版中均规定羚羊角需要用去掉骨塞制成的羚羊角粉才能供临床使用[4-5]。但鉴于赛加羚羊已被列入中国一级保护野生动物名录、濒危野生动植物物种国际贸易公约(CITES)附录II、迁徙物种公约(CMS)附录II以及IUCN红色名录中极危物种行列,为保护野生赛加羚羊,合理利用羚羊角的骨塞(质量约占整支羚羊角的40%),《中国药典》在1995年版之后规定不再去掉骨塞,骨塞也全部等同角壳一并入药,但因两者价格差异巨大(骨塞价格仅为角壳的1%左右),且现行标准中没有定量检验项目,故市场上销售的羚羊角粉大量使用骨塞来代替角壳,以降低生产成本。该现象在中成药中更加突出,严重影响了含羚羊角制剂的临床疗效。羚羊角角壳的主要成分为角蛋白质,骨塞的主要成分为磷酸钙,同时也含有少量角蛋白质和骨胶蛋白质等,虽然文献报道角壳和骨塞都具有明显的解热作用,但解热作用效果角壳约是骨塞的3倍[6]。鉴于两者所含成分和价格差异非常明显,考虑到骨塞所含的磷酸钙为其骨架支撑部分,与羚羊角功能联系较弱,故认为可能是角壳所含的角蛋白质和骨塞所含的骨胶蛋白质及角蛋白质与羚羊角的功能关系密切,故非常有必要对角壳和骨塞所含的蛋白质成分进行深入研究,以合理地使用羚羊角。
目前对羚羊角成分研究主要集中在氨基酸和微量元素的组成与差异两个方面[7-10],也有基因方面的研究报道,而羚羊角的主要功能成分角蛋白还没有进行过深入研究,对动物类中药材进行研究分析,目前非常有效的方法是通过蛋白质组学技术进行研究,将羚羊角样品进行适当酶解处理,通过Nano-LC-Orbitrap液质联用仪进行多肽分离及质谱数据采集,结合UniPortKB收录的Capra Hircus蛋白质组数据库,采用PEAKS Studio软件进行多肽和蛋白质序列的鉴定。
1 仪器与材料
1.1 仪器
EASY-nLC 1000纳升液相联用Fusion-Orbitrap高分辨质谱(Thermo Scientific公司);ReproSil-Pur C18-AQ Trap富集柱(0.2 mm×3.5 cm,5 μm)和ReproSil-Pur C18-AQ分离柱(75 μm×25 cm,3 μm)为实验室自制。
1.2 材料
Millipore-10 K超滤管;胰蛋白酶(Sigma公司,批号:SLBG6452V);羚羊角对照药材(中国食品药品检定研究院,全部为角壳部分,批号:1064-0801);羚羊角骨塞(本单位标本馆留存样品,经山东中医药大学彭艳丽主任药师鉴定为SaigatataricaLinnaeus角的骨塞);盐酸胍、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(EDTA二钠)、二硫苏糖醇(DTT)、碘代乙酰胺(IAA)、碳酸氢铵、乙酸均为分析纯;甲酸、乙腈为质谱纯。
2 方法与结果
2.1 供试品溶液的制备
精密称取羚羊角对照药材10 mg,骨塞粉末30 mg,分别加10 mL变性缓冲液(含6 mol·L-1盐酸胍、1.2 mol·L-1Tris和2.5 mmol·L-1EDTA二钠),加0.5 mL的0.5 mol·L-1DTT溶液,置于60 ℃保温处理12 h,取出,放冷至室温。加入1.2 ml的0.55 mol·L-1IAA溶液,摇匀,避光反应30 min。离心,取上清液50 μL置于超滤管中,离心脱盐,截留物加200 μL的1%碳酸氢铵溶液和5 μL胰蛋白酶溶液(10 mg·mL-1),置于37 ℃恒温培养箱中酶解12 h,0.22 μm滤膜过滤,即得。
2.2 纳升液相色谱条件
色谱柱为上述自制的富集柱和分离柱。流动相A为0.1%甲酸,流动相B为乙腈,梯度洗脱程序见表1,进样量为1 μL,流速300 nL·min-1。

表1 纳升液相色谱梯度洗脱程序
2.3 高分辨质谱条件
采用Fusion-Orbitrap高分辨质谱仪,Nanospray Flex离子源,以正离子模式进行采集,喷雾电压为2.1 kV,离子传输毛细管温度为277 ℃,S-Lens传输效率设置为60%。一级质谱采用Orbitrap作为质量分析器,分辨率为60 000(m/z400),采集范围为350~1550 Th;二级质谱采用离子阱作为质量分析器,采用Rapid Scan模式进行扫描,采用HCD碎裂模式,碎裂能量NCE设置为40%。
2.4 数据采集
本方法分析时间为70 min,采集的总离子流图见图1。

注:A.角壳;B.骨塞。图1 Fusion-Orbitrap采集的羚羊角总离子流图
2.5 数据处理方法
因目前没有赛加羚羊完整的蛋白质组数据库,故选择与其亲缘关系较近的Capra Hircus(山羊)蛋白质组数据库进行比对。利用蛋白质解析软件PEAKS Studio 8.5采用UniPortKB收录的Capra Hircus(截至2018年1月1日)作为参考蛋白质组数据来处理质谱数据。为了得出更有效的数据进行下一步分析,必须进行参数的合理设置。其中相应的软件参数设置如下:-10 lgP(Peptide)≥20、-10 lgP(Protein)≥20、FDR(Peptide-Spectrum Matches)=0.1%、FDR(Peptide Sequences)=0.1%、Ascore(Post-translational modification of Peptide)≥0、Peptide mutation ion intensity≥0%、Proteins unique peptides≥0、ALC(De novo only)≥50%、Protein Coverage(Top10)。-10 lgP为质量值,表示被测错的概率,-10 lgP值越大,被测错的概率越大,-10 lgP≥20代表被测错的概率不大于1%。FDR为容错率False discovery rate,是指在某个体系中能减少一些因素或选择对某个系统产生不稳定的概率。FDR值越低,对效果影响越大,结果越集中。设定无论氨基酸修饰还是变异大小全部进行检测,并对覆盖度前10的蛋白质进行排序。
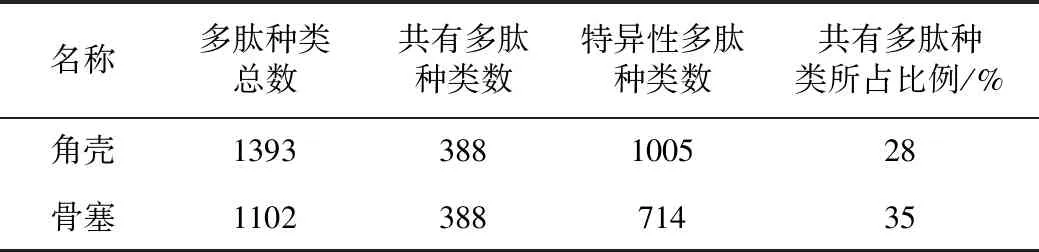
表2 多肽检测结果
3 分析
3.1 总离子流图分析
由图1可知,角壳和骨塞酶解后多肽的总离子流色谱图具有一定的相似性,特别是在约15、30、37、44、52、56 min处均具有很高色谱峰出现,主要的色谱峰保持较高的一致性。同时在约26、32、50、65 min处两者总离子流图又具有明显的不同,可以很好地将两者进行区别。特别是50 min处两者具有明显的不同,骨塞比角壳多出一个色谱峰,提示两者多肽组成具有某些差异。综上,角壳和骨塞的多肽组成具有一定的相似性,也存在某些差异。

表3 覆盖度前10的蛋白质组成
注:共有的蛋白质用正体标示,差异性蛋白质用斜体标示。
3.2 多肽检测种类及差异性分析
根据表2结果可知,角壳中多肽种类更加丰富,比骨塞多出约300种,说明角壳具有更多的多肽及蛋白质种类和数量。角壳和骨塞两者共有的多肽数近400种,共有多肽种类所占总多肽种类数分别为28%和35%,说明两者的多肽组成具有一定的相似性,同时也说明两者的多肽和蛋白质组成也存在明显差异,该分析结果与总离子流图分析结果具有相关性。
3.3 覆盖度TOP 10 蛋白组成的分析
将蛋白质分子选用特异性胰蛋白酶进行切割,酶解后的供试品为复杂的肽段组成的混合物,然后经过液相联用质谱仪进行检测,将检测信号转换成肽段信息,再通过与数据库中蛋白质进行结构比对,进而计算得到覆盖度。基于蛋白质覆盖度的高低可以预测目标物中蛋白质的组成。角壳中前10的蛋白覆盖度在81%~99%,覆盖度均较高;骨塞中前10的蛋白覆盖度在56%~73%,覆盖度较低,最低者接近50%,故试验中选择了覆盖度前10的蛋白进行比较分析。角壳中覆盖度前10的蛋白质全部为角蛋白质,而骨塞中覆盖度前10的蛋白质有80%是角蛋白质和20%是骨胶蛋白质,提示角壳和骨塞蛋白质组成存在明显差异。同时两者覆盖度前10的蛋白质有8个是相同的,说明两者的主要蛋白质存在较高的相似性。角壳中蛋白质覆盖度较高,提示角壳中所含蛋白质在结构上与对应的蛋白质最为相近。
4 讨论
完整的羚羊角包括外层的角壳和内部的骨塞两部分,基于蛋白质组学技术对两部分进行了深入研究,比较分析两者多肽及蛋白质组成差异,发现两者多肽和蛋白质在数量及种类上都存在明显差异,但也有相当高的相似性。研究表明骨塞在一定条件下可以替代角壳使用,不去掉骨塞的羚羊角直接磨成粉使用具有一定的合理性,可以扩大药源,充分利用骨塞部分,可更好地保护野生动物,但也必须控制好骨塞的用量比例,毕竟两者多肽种类方面也存在明显差异。现行《中国药典》中羚羊角粉无任何质控项目,应进一步提高《中国药典》中羚羊角粉的质量控制水平,将角壳和骨塞的用量比例控制在合理范围内,确保羚羊角临床用药的安全性和有效性。本研究尚未对角壳和骨塞的主要蛋白质和多肽进行定量研究,应进一步探究角蛋白的量效关系,为羚羊角的合理利用提供更多的技术支持。

