冠心病患者血小板和淋巴细胞比值与冠脉斑块稳定性及预后的相关性*
朱志远,王海燕,吴 波,王宏宝,李 微,白旭东,任燕妮,何雪琴,周 坛,戴 军
(同济大学附属杨浦医院安图分院心内科,上海 200093)
冠状动脉粥样硬化作为一种复杂的炎性疾病,直接影响冠心病(CHD)的发生发展,早期评估冠脉斑块的性质和变化对于CHD的风险分层及预后至关重要。现研究证实,斑块的稳定程度与斑块内炎性反应程度密切相关,不稳定性是影响心脑血管事件发生的独立危险因素[1-2]。目前,临床监测斑块稳定性的血清炎性标志物较多,但缺乏足够的灵敏度和特异度,或操作过程复杂[3]。血小板与淋巴细胞比值(PLR)是一种新型非特异炎症指标,近年来研究发现其与多种慢性炎症、自身免疫性疾病等密切相关,多用于恶性肿瘤、糖尿病的诊断及预后评估[4],有研究认为,PLR水平与CHD密切相关,且对肌钙蛋白水平的升高具有预测价值[5],但其对CHD患者冠脉斑块稳定性及预后预测价值报道仍较少。本研究分析CHD患者PLR变化,探讨其对冠脉斑块稳定性及预后的评估价值。
1材料与方法
1.1 研究对象 回顾性分析2017年1月~2018年6月在安图医院心内科收治的CHD患者(CHD组),共62例。入组标准:①均符合《内科学》中CHD的诊断标准[6],并经冠状动脉造影检查后确诊,血管内超声显示至少1支冠脉狭窄程度>50%;②年龄≤80岁;③排除脑卒中病史、恶性肿瘤、严重感染及心肝肾功能不全者。其中男性35例,女性27例;年龄47~73岁,平均年龄55.71±5.26岁。冠脉病变支数:单支33例,双支16例,三支及以上3例。另选择本院同期健康体检者30例作为对照组。其中男性15例,女性15例;年龄40~80岁,平均年龄55.23±4.87岁。两组研究对象性别构成比、年龄等比较,差异均无统计学意义(P>0.05)。本研究设计符合《赫尔辛基宣言》,患者或家属均签署同意书。
1.2 试剂和仪器 iLab血管内超声显像仪,美国强生(Jonson & Jonson)公司VITROS5600型全自动生化分析仪,日本Sysmex CS-5100型全自动血凝分析仪,迈瑞(Mindray)公司(国产)BC-6900血细胞分析仪。
1.3 方法
1.3.1 冠脉斑块性质及分组:采用血管内超声显像仪,按照美国心脏病学会与欧洲心脏病协会(AHA/ESC)联合制定的《冠脉血管内超声的检测指南》[7]对图像进行分析,并明确斑块性质,分为稳定性斑块和易损斑块。其中稳定与易损斑块同时存在的患者归为易损斑块组(n=35),其余归为稳定斑块组(n=27)。
1.3.2 生化指标检测:患者入院后(对照组体检时)抽取清晨空腹肘部静脉血5 ml,置于肝素抗凝管中,3 000 r/min离心(离心半径为10 cm)10~15 min后,保留上清液用于检测。采用全自动生化分析仪检测空腹血糖(FPG)、餐后2 h血糖(2 h PG)、糖化血红蛋白(HbAlc)、血肌酐(Scr)、尿素氮(BUN)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)和C反应蛋白(CRP);采用全自动血凝分析仪检测纤维蛋白原(FIB);采用血细胞分析仪进行血细胞检测,记录血液中白细胞(WBC)、血小板(PLT)、淋巴细胞(LYM)绝对数,PLR通过公式计算=PLT/LYM。
2结果
2.1 各组血细胞检测及各项生化指标比较 见表1。各组高血压病史、糖尿病病史,CRP,Scr,BUN,FIB,PLT,LYM和PLR比较,差异均有统计学意义(均P<0.05)。与对照组比较,稳定斑块组和易损斑块组高血压、糖尿病比例、Scr,BUN,FIB,PLT和PLR明显升高,LYM明显降低,差异均有统计学意义(均P<0.05);与稳定斑块组比较,易损斑块组糖尿病比例、CRP,Scr,BUN,FIB和PLR明显升高,差异均有统计学意义(均P<0.05)。
2.2 CHD患者冠脉斑块稳定性的多因素回归分析 见表2。以CHD患者冠脉斑块是否稳定为因变量(稳定=0,不稳定=1),将上述稳定斑块组和易损斑块组间分析有意义的变量纳入多因素逐步logistics回归分析,结果显示,CRP,FIB和PLR均是CHD患者冠脉斑块不稳定的独立危险因素(P<0.05)。
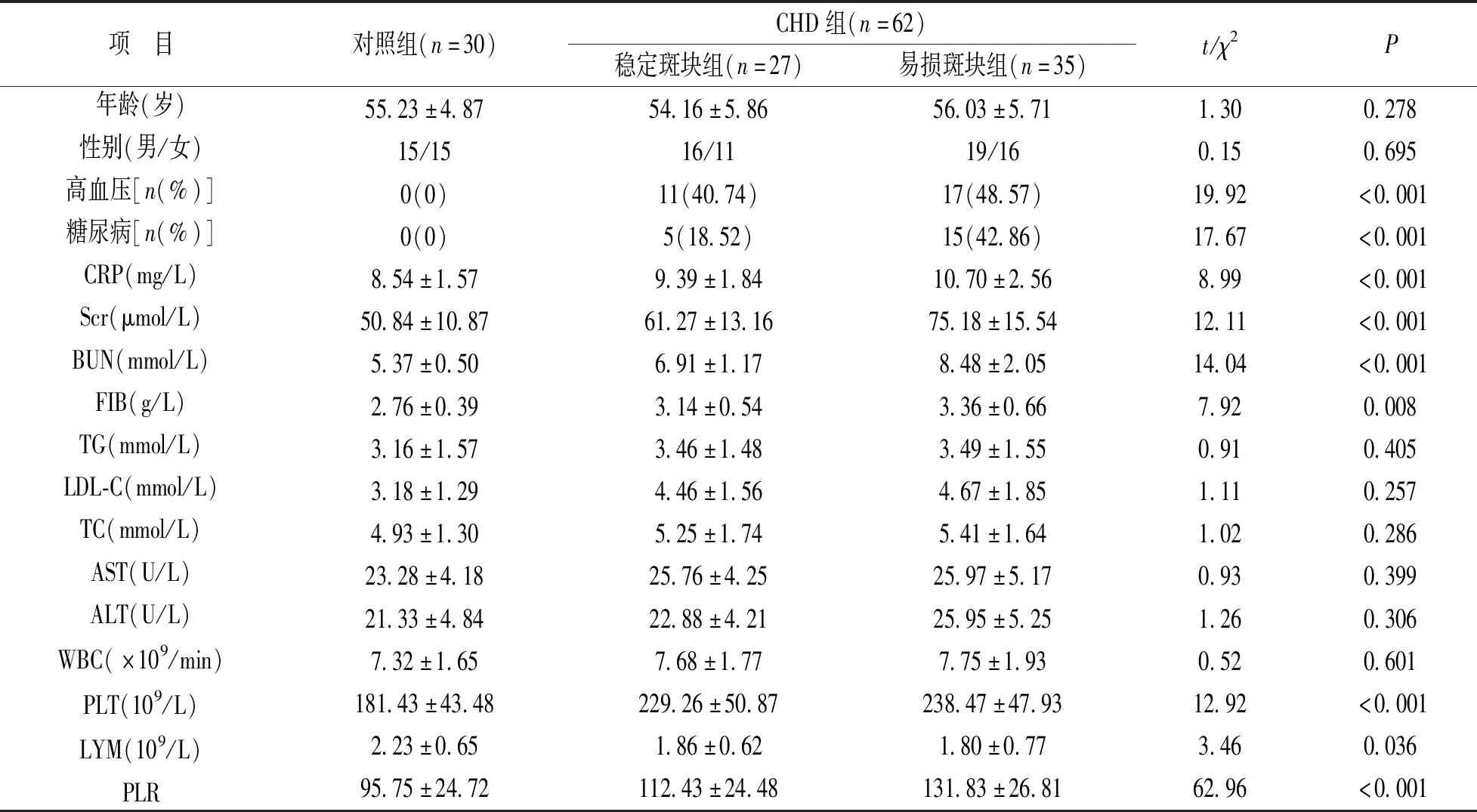
表1 各组生化指标比较
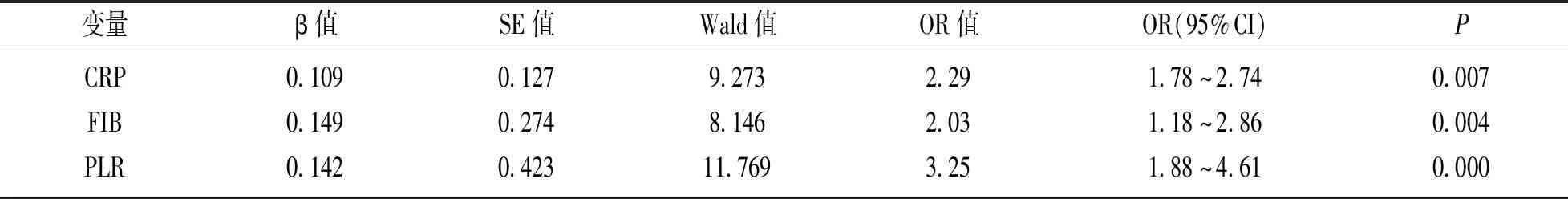
表2 CHD患者冠脉斑块稳定性的多因素logistic回归分析
2.3 各指标对CHD患者冠脉斑块稳定性的预测价值 对CRP,FIB和PLR进行ROC曲线分析,结果显示CRP,FIB和PLR联合预测CHD患者冠脉斑块稳定性的AUC为0.804[95% CI:0.731~0.853)],此时PLR最佳cut-off值为117.6,灵敏度为83.1%,特异度为81.9%,均显著高于三个指标的单独预测结果(P<0.05)。见图1。
2.4 不同PLR值患者的预后比较 以PLR最佳cut-off值117.6为临界值分为低PLR组(<117.6)和高PLR组(≥117.6)。随访6个月期间,高PLR组不良心血管事件(MACE)的发生率显著高于低PLR组,差异有统计学意义(P<0.05)。见表3。
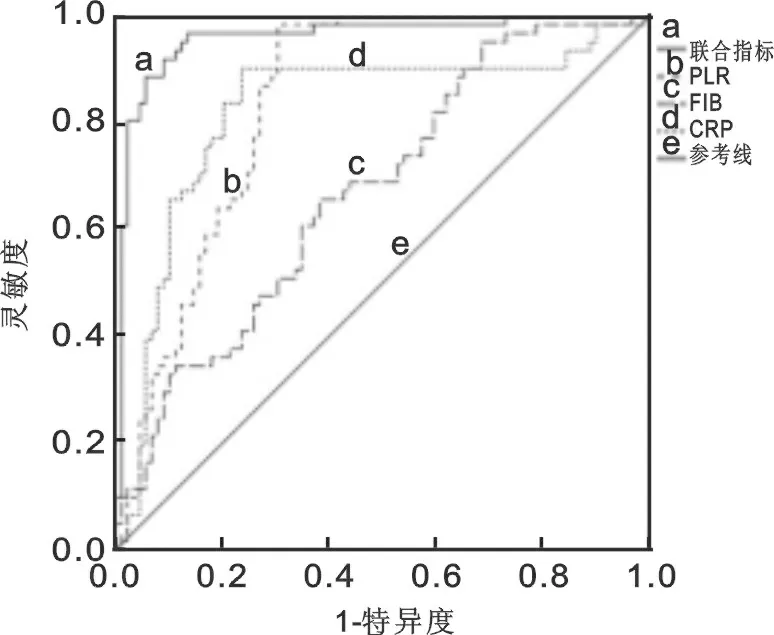
图1 各指标对CHD患者冠脉斑块稳定性的ROC曲线

表3 不同PLR值患者的预后比较[n(%)]
3讨论CHD患者由于冠脉斑块破裂、脱落形成管腔内血栓,进而导致管腔进一步狭窄闭塞,最终进展为急性冠脉综合征,尤其是易损斑块在心血管疾病的演变过程中发挥着关键作用[8]。有研究指出,易损斑块多由占斑块面积40%以上的脂质核心与较薄纤维帽(厚度<150 μm)组成,极易出现破裂引发血栓[9]。目前,临床上对冠脉斑块尚缺乏特殊有效治疗手段,抗凝或抗血小板药物虽能一定程度上抑制斑块形成,降低斑块厚度,但总体临床有效率仍不理想,且停药后斑块复发风险仍较高[10]。现研究广泛证实,炎症反应与冠脉斑块密切相关,是否能通过炎性反应标志物鉴别斑块的稳定性及预后一直是近年来该病防治研究的热点问题[11]。
血细胞检测常用于反映感染与炎症状态,但由于项目较多,单纯凭借个别项目的判断可能造成误判[12]。近年来,PLT,LYM及中性粒细胞等部分指标愈发引起关注,研究表明上述指标变化可反映机体感染状态下血细胞有形成分消耗、生成的变化,有助于提高血细胞检测在炎症性疾病中的诊断价值[13]。PLR是近年来证实的炎症指标,常作为炎症所致斑块形成的指标。血小板源自成熟巨核细胞的细胞质,通过介导免疫细胞和内皮细胞之间的相互作用,间接调节淋巴细胞功能,释放促炎症介质。机体炎症状态下,血小板细胞增殖增加,而免疫功能抑制,淋巴细胞凋亡增加,PLR能够更好体现促炎与抗炎反应的平衡,其意义优于单纯的细胞亚型计数[14]。
本研究结果显示,CHD患者Scr,BUN,FIB,PLT,LYM及PLR均与正常人群有明显差异,易损斑块组和稳定斑块组PLT,LYM无明显差异,但易损斑块组PLR明显升高(P<0.05),说明PLR可较PLT和LYM更敏感地反映CHD患者斑块稳定程度[15]。进一步分析发现,PLR是影响冠脉斑块稳定性的独立危险因素(P<0.05),ROC曲线分析显示CRP,FIB和PLR联合预测对于斑块稳定性具有更高的灵敏度和特异度,其预测效能高于三个指标的单独预测(P<0.05)。由此可见,PLR可作为一种心脑血管疾病患者冠脉斑块稳定性的良好标志物,联合FIB和CRP等指标能更加全面反映病情变化,以便于及时调整治疗策略,最大限度地改善预后。PLR是两种血细胞检测项目的综合反映,比单一项目更加稳定,可克服标本处理过程多种因素对血液样本的干扰,同时规避应激因素对WBC各亚型绝对值的影响[16]。此外,多因素回归结果还发现FIB与斑块稳定性存在相关性,其可能原因在于其刺激平滑肌增殖影响纤维帽的形成,微血栓的多次形成导致斑块构成及稳定性受到影响[17]。
在预后方面,高PLR组MACE的发生率显著高于低PLR组(P<0.05),与孟新颜等[18]研究结果一致,提示PLR升高可能预示不良预后。AYCA等[19]研究发现,PLR>150时提示存在血栓形成,敏感度、特异度分别为70%和76%。另有研究表明,高PLR(>137)的CHD患者冠脉相关的MACE及病死率均较低PLR患者显著升高[20]。
综上所述,PLR是CHD患者冠脉斑块稳定性的独立危险因素,且与预后密切相关,有助于指导临床决策,尤其适用于基层医院。但本研究为回顾性分析,下一步将扩大样本进行前瞻性研究,深入探讨治疗前后PLR的变化及其对CHD患者预后的评估价值。

