血清维生素D结合蛋白水平检测对大鼠肝毒性诊断的评价研究*
苗玉发,康慧君,王 超,张河战
(中国食品药品检定研究院,药物非临床安全评价研究北京市重点实验室,北京 100176)
已上市药物撤市最常见的单一原因是药物诱导的肝毒性。然而,大多数因肝毒性撤市的药物如酮康唑、溴芬酸、异丙异烟肼和曲列格酮等,在治疗剂量下导致肝衰竭的发生率不超过万分之一。在药物开发阶段,尽管进行了详细的临床前毒性研究和人体临床研究,也很少能发现严重肝毒性的病例。因此,如果能在肝脏发生不可逆损伤之前,用灵敏度较好的生物标志物来预测即将发生的严重肝毒性,及时调整用药或停药,则有可能避免进一步的肝损伤。本研究构建3种肝毒性模型,评价潜在的新型肝毒性生物标志物血清维 生素D结合蛋白(vitamin D binding protein,VDBP)和其它常用肝毒性指标对肝毒性的诊断价值,以期找到更加灵敏的诊断指标。
1材料与方法
1.1 研究对象 SPF级Wistar雄性大鼠128只,7周龄,160~200 g,购自北京维通利华实验动物技术有限公司。动物在中国食品药品检定研究院安全评价研究所SPF级屏障系统[SYXK(京)2016-0045] 中饲养,每笼1~3只,自由摄食和饮水。解剖前16~18h禁食,正常供水。笼具采用PC聚碳酸酯鼠盒(L×W×H:294 mm×190 mm×125 mm),每周更换2~3次。饲养室12 h照明,保持21℃~24℃的温度,31%~64%的湿度和每小时10~20次以上的换气次数。研究遵循实验动物“3R”原则,并保证实验动物应有的福利。实验动物福利伦理委员会(IACUC)批准号:IACUC2014026。
1.2 试剂和仪器 7180型全自动生化分析仪(日本HITACHI公司),5810R型台式高速离心机(德国Eppendorf公司),200 mg酮康唑(KTZ)片剂(西安杨森制药公司),四氯化碳(CCl4)(北京化工厂);500 mg对乙酰氨基酚(APAP)片剂(青岛黄海制药有限责任公司),大鼠VDBP试剂盒(上海将来实业股份有限公司);丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、总胆红素(TBIL)、总胆汁酸(TBA)、胆碱酯酶(CHE)和5’核苷酸酶(5’-NT)试剂和校准品均购自日本和光纯药工业株式会社。谷氨酸脱氢酶(GLDH)、单胺氧化酶(MAO)和苹果酸脱氢酶(MDH)试剂和校准品均购自长春汇力生物技术有限公司;其余试剂均为国产分析纯。
1.3 方法
1.3.1 CCl4肝毒性模型的构建[1]:CCl4用精制花生油配制成30 ml/dl的溶液,使用当天配制。实验设置CCl4组和正常对照组。CCl4组32只大鼠,正常对照组8只大鼠。30%(v/v)CCl4给药体积为10 ml/kg,灌胃给药,共给药1次。给药结束后2,4,6和7h分别解剖8只动物。正常对照组给予等量生理盐水1次后7 h解剖8只动物。
1.3.2 KTZ肝毒性模型的构建:KTZ片剂直接溶于注射用水充分混匀配成40 mg/ml混悬溶液,放置冰箱冷藏备用,使用前充分混匀。实验设置KTZ组和正常对照组。KTZ组48只大鼠,正常对照组8只大鼠。KTZ给药剂量为225 mg/kg,灌胃给药,每天给药1次,共给药8次。第一次给药设为第0天,在1,2,3,4,6和8天,分别解剖8只动物,解剖动物当天不给药。正常对照组给予等量生理盐水1次后第8天解剖8只动物。
1.3.3 APAP肝毒性模型的构建[2]:APAP片剂直接溶于注射用水充分混匀配成200 mg/ml混悬溶液,放置冰箱冷藏备用,使用前充分混匀。实验设置APAP组和正常对照组。APAP组24只大鼠,正常对照组8只大鼠。APAP给药剂量为2 g/kg,灌胃给药,共给药1次。给药结束后4,8和24 h分别解剖8只动物。正常对照组给予等量生理盐水1次后24 h解剖8只动物。
1.3.4 动物解剖、血清制备及指标检测:动物用50 mg/kg硫喷妥钠麻醉后,腹腔大静脉取血2~3 ml,室温静置约40 min后,3 000 r/min离心,吸取上层血清用于指标检测。ALT,AST,ALP,TBIL,TBA,CHE,GLDH,5’-NT,MAO和MDH等指标用7180型全自动生化分析仪测定。VDBP用ELISA试剂盒测定,测定步骤参照试剂盒说明书。
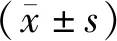
2结果
2.1 CCl4肝毒性模型中各指标检测结果 见表1。与对照组相比,ALT,AST,TBIL和CHE在CCl4给药后4 h起升高,且差异具有统计学意义(P<0.05)。GLDH,MAO和MDH在给药后6 h起升高,且差异具有统计学意义(P<0.05)。ALP,TBA和5’-NT与对照组的差异无统计学意义(P>0.05)。VDBP浓度在CCl4给药后2 h起降低,并一直持续到7 h,且差异具有统计学意义(P<0.05)。

表1 CCl4肝毒性模型中各指标检测结果
2.2 KTZ肝毒性模型中各指标检测结果 见表2。与对照组相比,ALT在KTZ给药6天后升高,且差异具有统计学意义(P<0.05)。AST和TBIL在给药后8天升高,且差异具有统计学意义(P<0.05)。ALP,TBA,CHE,GLDH,5’-NT,MAO和MDH在给药后任何时间点与对照组的差异均无统计学意义(均P>0.05)。VDBP浓度在KTZ给药后1天起降低,并一直持续到第8天,且差异具有统计学意义(P<0.05)。

表2 KTZ肝毒性模型中各指标检测结果
2.3 APAP肝毒性模型中各指标检测结果 见表3。与对照组相比,ALP在APAP给药后4 h和8 h点升高,且差异均具有统计学意义(均P<0.05)。CHE在给药后8 h点升高,且差异具有统计学意义(P<0.05)。ALT和TBIL在给药后24 h点升高,且差异具有统计学意义(P<0.05)。AST,TBA,GLDH,5'-NT,MAO和MDH在给药后任何时间点与对照组的差异均无统计学意义(均P>0.05)。VDBP浓度在APAP给药后第4 h起降低,并一直持续到24 h,且差异具有统计学意义(P<0.05)。
3讨论肝细胞损伤最传统的生物标志物是血清ALT。肝损伤时肝细胞被破坏,细胞内的ALT释放入血,导致血清中ALT含量升高。AST在肝脏和心肌中均大量存在,肝损伤时,AST也一定程度升高。但AST的生物分布决定AST升高未必是由于肝损伤引起,心肌细胞损伤同样也能导致AST升高[3-4]。本研究在KTZ和APAP肝毒性模型中,ALT的特异度和灵敏度都优于AST。在CCl4肝毒性模型中,由于CCl4的剂量大,毒性强,所有动物都出现了严重的肝损伤,所以ALT和AST都显示相当的诊断价值。

表3 APAP肝毒性模型中各指标检测结果
ALP常以同工酶的形式存在于多个组织中,但血清中的ALP主要来自肝脏、骨骼和肠道。ALP在胆汁淤积时升高较为明显,是诊断胆汁淤积的敏感指标。有文献报道,在肝癌患者血清中ALP也显著性升高[5]。TBA是由胆固醇转化而来,在胆囊中储存和浓缩,并释放到肠道中帮助消化食物。TBA可以通过肝肠循环被重复利用,当肝肠循环受阻或肝胆系统病变,血清中的TBA就会升高。5’-NT仅由肝脏合成,因此对于肝脏病变的诊断具有较好的特异度。文献显示,5’-NT活性在梗阻性黄疸和肝癌患者中均升高,且差异具有统计学意义,而在肝硬化患者中的差异不具有统计学意义[6]。本研究中所构建的3种急性肝毒性模型,均以肝细胞损伤为主,未出现胆道梗阻或胆汁淤积现象,因此,与对照组相比,ALP,TBA和5’-NT在给药后各时间点的差异均无统计学意义。在APAP肝毒性模型中4 h和8 h时间点ALP降低没有实际的临床意义,可能与动物禁食有关。
CHE主要存在于肝脏、红细胞和脑中,大鼠肝脏损伤时,肝细胞膜破坏,血清中的CHE会升高。总胆红素是血红蛋白的分解产物,包括直接胆红素和间接胆红素。资料显示,肝硬化患者中TBA和TBIL水平显著升高,差异有统计学意义,这说明血清中TBA和TBIL浓度变化与肝实质损害程度密切相关[7-8]。本研究在3种肝毒性模型中,TBIL仅在最末次时间点升高,且差异具有统计学意义,说明TBIL在这3种模型中预测肝毒性的灵敏度不足。CHE在KTZ肝毒性模型中的差异不具有统计学意义,在APAP肝毒性模型中仅有8 h时间点升高且差异具有统计学意义,可见CHE在KTZ和APAP肝毒性模型中诊断肝损伤的价值不高。
GLDH是一种线粒体酶,肝脏、心肌及肾脏含量丰富,肝细胞损伤可导致血清中GLDH含量升高。MAO活性高低能反映肝纤维化的程度,是诊断肝硬化的重要指标。各种肝炎急性期患者血清MAO不增高,但暴发性重症肝炎或急性肝炎中有肝坏死时,血清MAO活性可升高[9-10]。MDH是一种氧化还原酶,可催化草酰乙酸和苹果酸之间的可逆性转化,主要参与三羧酸循环、乙醛酸循环、苹果酸-天冬氨酸循环等代谢途径。MDH在肝脏中含量丰富,以线粒体和胞浆中分布居多。当肝脏损伤时,细胞内MDH释放入血导致外周血中MDH含量增加。MDH常用于心肌梗塞、急性实质性肝损伤、肝癌、肺癌的早期诊断用酶[11]。本研究中,GLDH,MAO和MDH在CCl4肝毒性模型中,给药后6 h升高且差异具有统计学意义,有一定的诊断价值,而在KTZ和APAP肝毒性模型中的差异不具有统计学意义,无法预测肝毒性的发生,不具有诊断价值。
大鼠VDBP主要由肝脏合成和分泌,是一种分子量约为52~54kDa的酸性糖蛋白,在维生素D甾醇类物质转运中起重要作用。VDBP不但能与血液中维生素D及其代谢产物25(OH)D特异性结合,还能与肌动蛋白结合,阻止肌动蛋白的聚合[12]。临床上,肝纤维化和肝癌患者外周血中VDBP的含量较低,且降低的水平与疾病的严重程度密切相关[13]。本研究在3种肝毒性模型中,从给药后第一个观察时间点开始,VDBP降低且差异具有统计学意义,这证实VDBP在这3个肝毒性模型中比其它所有指标都具有较好的灵敏度,可以更早期的预测这3种模型中的肝细胞损伤。综上所述,VDBP作为潜在的肝毒性生物标志物具有很好的诊断价值,可以继续在更多的肝毒性模型中进行验证。

