大麦蛋白质二硫键异构酶基因家族的鉴定与表达分析
时丽洁 蒋枞璁 王方梅 杨 平,* 冯宗云
1 四川农业大学农学院大麦青稞研究中心,四川成都 611130;2 中国农业科学院作物科学研究所,北京 100081
蛋白质二硫键异构酶(protein disulfide isomerase,PDI)基因家族编码一类含有硫氧还蛋白(thioredoxin,TRX)结构域的PDI 蛋白和PDI 类蛋白(PDI-like)。这些蛋白大量存在于真核细胞的内质网腔(ER)中,具有催化蛋白质二硫键氧化还原反应、协助蛋白质分子异构以及保障成熟的蛋白质分子正确折叠等功能,行使类似分子伴侣的作用[1-4]。典型的PDI 蛋白由5 个基本结构域(a,b,b',a',c)组成,其中具有氧化还原催化活性的两处位点位于a 和a'结构域的-CGHC-(-Cys-Gly-His-Cys-)序列中,而结构域b和b'则是在异构化反应中起着结合底物、维持结构的作用[5-7];c 结构域对钙离子(Ca2+)具有高亲和性,且在其 C 末端富含酸性氨基酸序列(典型的如-KDEL-),为内质网定位信号[8-9]。除了上述典型的结构域,一些PDIL 蛋白中还含有额外结构域,如D、COPII、J 和ARMET,可以根据它们对PDIL 蛋白进行更细致的分类[10-11]。
植物中的PDI 家族基因一般被命名为PDI 类蛋白基因(PDIL),前人对拟南芥、水稻和玉米的PDIL蛋白序列进行聚类分析,根据功能结构域的组成类型及数目,认为在植物中至少存在8 个PDIL 蛋白亚家族(命名为PDIL1-PDIL8)[12]。大多数的PDIL 蛋白被定位在内质网腔内,辅助蛋白质合成过程中的正确折叠;但是,也有个别的PDIL 成员定位在细胞的其他位置,如线粒体、叶绿体、高尔基体、分泌囊泡或质膜上,行使的功能也非常多样化[10,13-15]。植物PDIL基因的生物学功能研究,多集中在种子发育与贮藏蛋白代谢方面。拟南芥的AtPDIL2-1基因可以影响胚珠的结构,并通过引导花粉管的生长来促进胚囊的发育[16]。AtPDIL1-1基因则作为分子伴侣,在内种皮细胞发生程序性死亡过程之前抑制半胱氨酸蛋白酶向液泡的运输[14]。水稻的OsPDIL1-1基因被证实是种子醇溶蛋白和谷蛋白在内质网中正确组装和配送所必需的,该基因的缺失将导致水稻胚乳形成粉状淀粉,同时诱发细胞的内质网胁迫(ER-stress)反应[17-21]。在玉米胚乳中过量表达PDI基因,将导致贮藏蛋白结构的改变,由此推测该基因调控着蛋白体的合成与交联[22]。近年来,PDIL基因在植物应对生物或非生物胁迫反应中的作用越来越受到关注。拟南芥在受到化学试剂诱导的内质网胁迫条件下,有6 个PDI基因的表达会显著上升[23]。干旱、冷胁迫、盐分胁迫和ABA 处理,会诱导玉米中的PDI基因表达量上升[24]。而小麦中也有一些PDI基因会在非生物胁迫条件下上调表达[25]。另外,陆续有研究报道小麦中的某些PDI基因还参与了植物对真菌病害的抗病反应[26-27]。
大麦(Hordeum vulgare)是重要的禾谷类作物,具有耐寒、耐旱、耐贫瘠等优异特性。大麦黄花叶病是欧洲与东亚国家大麦生产中一种流行的病害,由大麦黄花叶病毒(Barley yellow mosaic virus,BaYMV)或大麦温性花叶病毒(Barley mild mosaic virus,BaMMV)感染引起,该病毒借助中间宿主禾谷多黏菌(Polymyxa graminis)在土壤中传播,从大麦根系入侵[28-29]。近年来克隆的一个大麦黄花叶病广谱抗性基因HvPDIL5-1就是PDIL基因家族的成员,并且已被证实HvPDIL5-1基因可以作为感病因子(即基因功能丢失后,导致隐性抗病性),参与BaYMV/ BaMMV 对大麦的感染过程[30]。
目前,在禾本科物种水稻[12]、玉米[12]、小麦[31]以及二穗短柄草[32]中均有针对PDIL基因家族的系统的鉴定与分析,但在大麦中还没有类似的报道。本研究利用开放的数据库资源,鉴定出了大麦的PDIL基因,对它们进行了序列结构、系统发生、以及时空表达模式的分析,并且通过定量PCR 实验检测了这些基因在大麦接种病毒前后的表达差异。
1 材料与方法
1.1 HvPDIL 基因家族成员的生物信息学分析
1.1.1 不同物种中PDIL基因的序列来源 拟南芥(Arabidopsis thaliana)的13 个PDILs基因、水稻(Oryza sativa)的12 个PDILs基因、小麦(Triticum aestivum)的9 个PDILs基因和玉米(Zea mays)的12个PDILs基因的核苷酸序列与氨基酸序列(FASTA文件)均下载于NCBI 数据库(https://www.ncbi.nlm.nih.gov/)。
1.1.2HvPDIL基因家族成员的鉴定 通过已知的水稻12 个PDILs基因序列,在NCBI 和大麦数据库BARLEX(https://apex.ipk-gatersleben.de/apex/f?p=284)中对大麦全基因组序列进行BLAST 检索,获得大麦的PDILs基因序列及其在数据库中的编号(Accessions)。利用NCBI 中检索出的HvPDILs基因序列在 BARLEX(https://apex.ipk-gatersleben.de/ apex/f?p=284)数据库中再次检索,获得各个HvPDILs基因的位点编号(ID)及染色体物理位置,同时使用MapChart 软件绘制HvPDILs基因的染色体分布图。
1.1.3 大麦PDILs 蛋白的结构分析 利用在线软件ExPASy(https://web.expasy.org/protparam/)分析氨基酸编码序列长度及蛋白质理化性质(分子量、等电点),采用SignalP 4.1(http://www.cbs.dtu.dk/services/ SignalP/)预测大麦PDIL 蛋白的信号肽。利用NCBI保守结构分析(Conserved Domains)在线工具(https:// www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析大麦PDIL 蛋白的保守结构域。
1.1.4HvPDIL基因家族的系统进化分析、组织和时空表达分析 利用MEGA7.0 软件对大麦、小麦、水稻、玉米和拟南芥的PDILs 氨基酸序列进行多序列比对(ClustalW),将多序列比对结果采用Neighbor-Joining 方法进行系统进化树构建,重复1000 次。HvPDILs基因的组织和时空表达数据来源于 BARLEX 数据库(https://apex.ipk-gatersleben.de/ apex/f?p=284),将HvPDILs基因的表达丰度FPKM值统一取对数log2FPKM 标准化,使用GraphPad Prism 7 软件进行数据展示。
1.2 HvPDILs 基因在大麦黄花叶病毒侵染条件下的表达差异分析
1.2.1 大麦材料的种植与接种 将大麦黄花叶病易感品种“Igri”种植在正常温室条件下(白天20°C,14 h;夜晚18°C,10 h),两周苗龄幼苗通过叶片摩擦接种大麦温性花叶病毒(BaMMV-ASL),接种方法如前人所述[33];以不含病毒的ddH2O 作为摩擦接种的阴性对照(Mock)。将接种后的植株移到低温培养箱中(白天12°C,14 h;夜晚8°C,10 h)培育。
1.2.2 RNA 提取与反转录和BaMMV 病毒检测
在接种后5 周,取接种病毒与接种ddH2O 的大麦幼苗新生叶,各取6 个单株作为生物学重复。利用TRIzol 试剂(Invitrogen,USA)提取总RNA。利用RT Kit with gDNA Eraser 试剂(北京金百特生物技术有限公司)进行反转录,合成cDNA。将cDNA 按1∶10 稀释后作为PCR 模板,采用BaMMV 特异性引物检测植株感染情况(表3)。
1.2.3 荧光定量 PCR 检测基因表达 采用BatchPrimer 3 设计HvPDILs基因的qPCR 引物(表3),并进行qPCR 检测引物的扩增效率。qPCR 反应体系为15 μL,包含2 μL cDNA,1.5 μL primer-F/R(5 μmol L-1),7.5 μL SYBR-mix,2.5 μL ddH2O。反应程序为:95°C 预变性2min;95°C 15 s,61°C 20 s,45 个循环;溶解曲线程序为65~95°C,每个循环+0.5°C、维持5 s。以HvUBIQUITIN为内参基因[30],检测各个HvPDIL基因的相对表达量。
2 结果与分析
2.1 HvPDIL 基因家族成员的鉴定与结构分析
利用水稻中已鉴定的12 个PDILs基因序列为参考,在NCBI 数据库中进行核苷酸序列检索,其中OsPDIL1-2与OsPDIL1-3检索到大麦的同一个基因(AK368066.1),另外在 NCBI 数据库以及大麦BARLEX 数据库中都无法检索到与OsPDIL2-2同源的大麦基因,所以最终确认了10 个HvPDILs基因(表1)。与之对应,在大麦BARLEX 数据库中找到10 个HvPDILs基因相应的基因编号与物理定位,它们分布在除了3H染色体之外的其他6 条染色体上(图1)。其中,9 个HvPDILs基因编码序列长度均在1500 bp 左右,而HvPDIL5-1基因的编码序列仅456 bp。
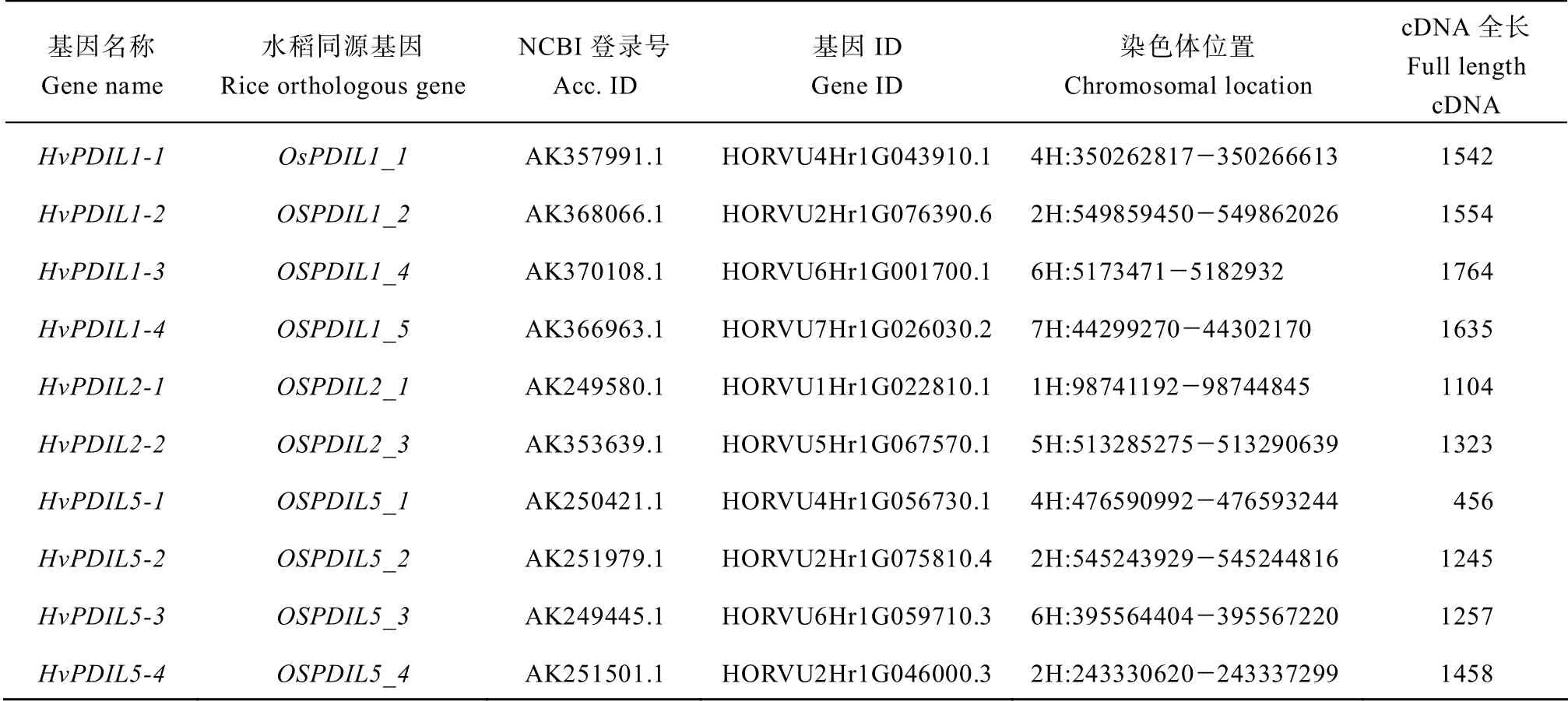
表1 大麦PDI 基因家族信息 Table1 Identified PDI genes in barley genome
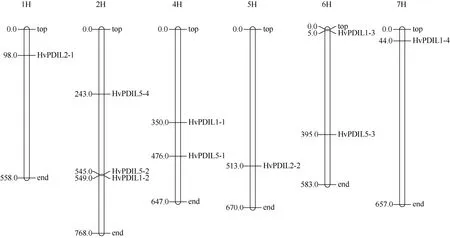
图1 HvPDILs 基因的染色体分布 Fig.1 Chromosomal location of HvPDILs
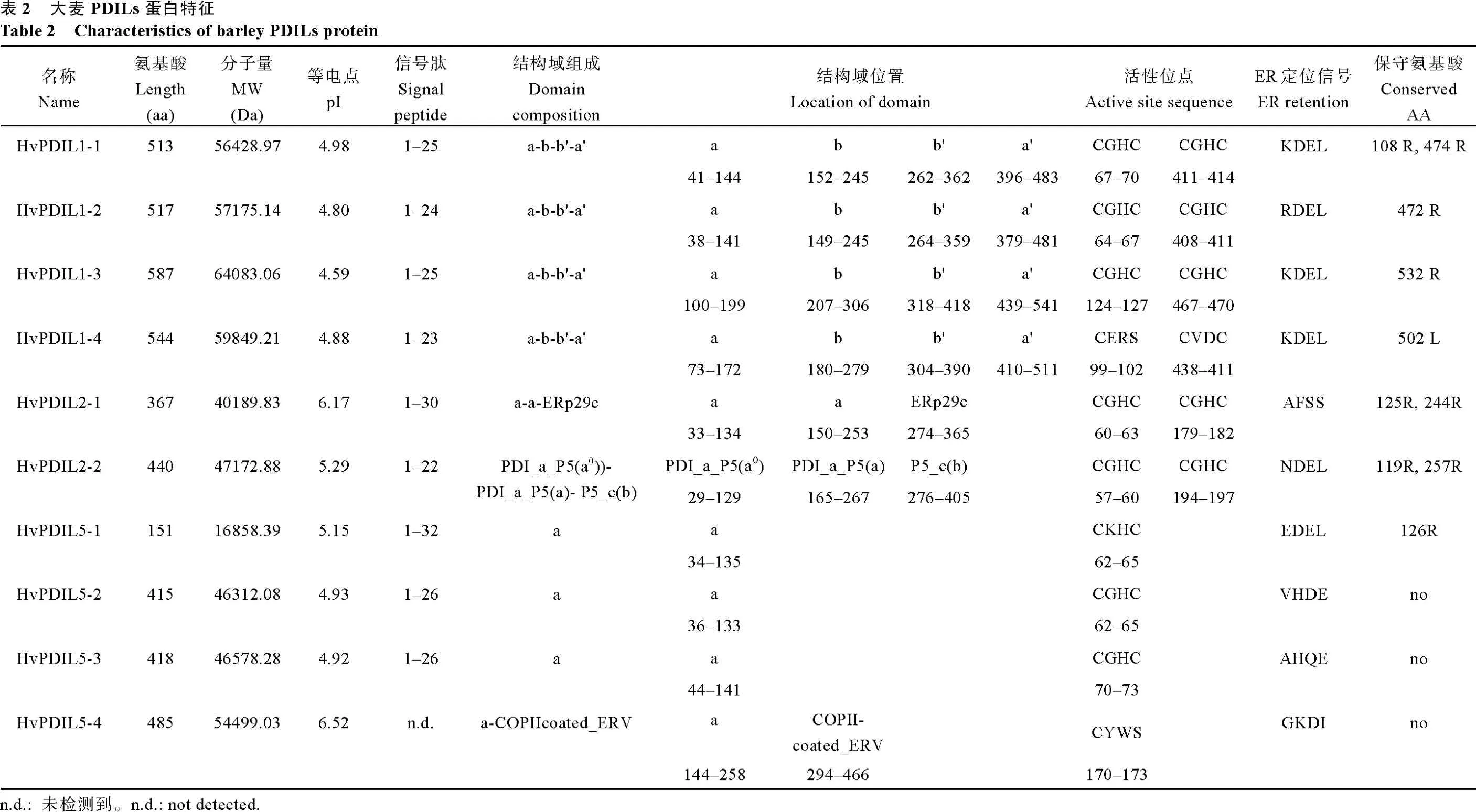
根据功能结构域的组成和数目,PDIL 被分成PDIL1、PDIL2 和PDIL5 三个亚家族[12]。通过分析10 个大麦PDIL 蛋白的保守结构域和功能元件(图2和表2),发现其中PDIL1 类的4 个蛋白都具有PDIL蛋白典型的-a-b-b'-a'-型结构域;PDIL2 类的2 个蛋白具有-a-a'-型结构域,其中HvPDIL2-2 蛋白还含有一个P5_c 结构域,它类似b 结构域,在催化时具有底物结合功能;PDIL5 类的4 个蛋白具有-a-型结构域。具有氧化还原催化活性的a 或a'结构域中通常含有保守氨基酸序列“C-X-X-C”,除了HvPDIL5-4蛋白(“C-X-X-S”)之外,其他HvPDILs 蛋白均含有该保守氨基酸序列(表2)。PDIL 蛋白 C 末端的“K-D-E-L”序列为典型的内质网定位信号,HvPDIL1-1、HvPDIL1-3 和HvPDIL1-4 蛋白具有该特征序列,部分家族成员含有“R-D-E-L”(如HvPDIL1-2 蛋白)、“E-D-E-L”(如HvPDIL5-1 蛋白)或者“K-E-E-L”(如HvPDIL2-2 蛋白)等定位信号,暗示这些基因的编码蛋白也定位于内质网。此外,HvPDIL2-1 和HvPDIL5-4 蛋白分别含有特殊结构域ERp29 和COPIIcoated_ERV(Endoplasmic reticulum vesicle transporter,内质网囊泡转运体),两者是常见于哺乳动物细胞内质网中的蛋白,其具体的生物学功能尚不清楚。
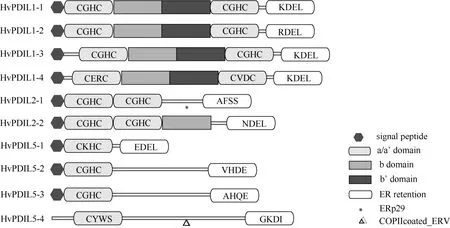
图2 大麦PDILs 蛋白的结构示意图 Fig.2 Graphic representation of barley PDIL-likes proteins
?
2.2 HvPDIL 基因家族的系统进化分析
依据编码氨基酸序列的相似性,构建了5 个物种PDILs 的系统进化树(图3)。这5 个物种的PDILs蛋白聚类成8 个系统发育分支,大麦的10 个PDILs分布于这8 个分支中,暗示在植物中这些PDILs 可能是直系同源蛋白,推测其生物学功能也是保守的。相对于水稻OsPDILs 和玉米ZmPDILs,大麦HvPDILs 与小麦TaPDILs 的系统进化关系最近(如HvPDIL1-1 和 TaPDIL1-1),呈现一一对应的关系,暗示大麦与小麦的PDILs 的生物学功能可能具有相似性。
2.3 HvPDILs 基因的组织与时空表达分析
从大麦BARLEX 数据库下载了10 个HvPDILs基因的表达丰度数据,该数据包含胚胎、幼根、苗期地上部分、新生穗、第3 节间分蘖、前期灌浆籽粒、后期灌浆籽粒、黄化苗、主穗、浆片、内稃、外颖壳、穗轴、灌浆期根部、衰老叶共15 个时期及组织的表达情况。图4显示,在不同时期和不同组织中10 个HvPDILs基因均有所表达,推测这些基因均具有生物学功能。其中,HvPDIL1-1(在15 个时期及组织中的表达丰度范围为57.25~8524.67,平均值为973.67)和HvPDIL2-1(在15 个时期及组织中的表达丰度范围为81.66~508.02,平均值为237.06)均呈现总体很高的基因表达水平,HvPDIL1-2(在15 个时期及组织中的表达丰度范围为0.07~6.94,平均值为 1.41)和HvPDIL1-3(在15 个时期及组织中的表达丰度范围为0.12~1.33,平均值为0.59)总体表达量很低,其他6 个基因表达丰度较高,在不同的组织中略有差异。值得注意的是,HvPDIL1-1在籽粒发育时期的表达丰度最高,暗示其在大麦籽粒的发育过程中发挥重要的作用。
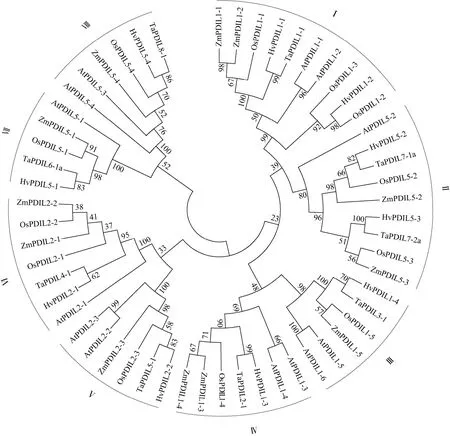
图3 大麦与小麦、水稻、玉米、拟南芥PDILs 同源蛋白的系统进化树 Fig.3 Phylogenetic tree of PDIL homologous proteins from barley,wheat,rice,maize,and Arabidopsis
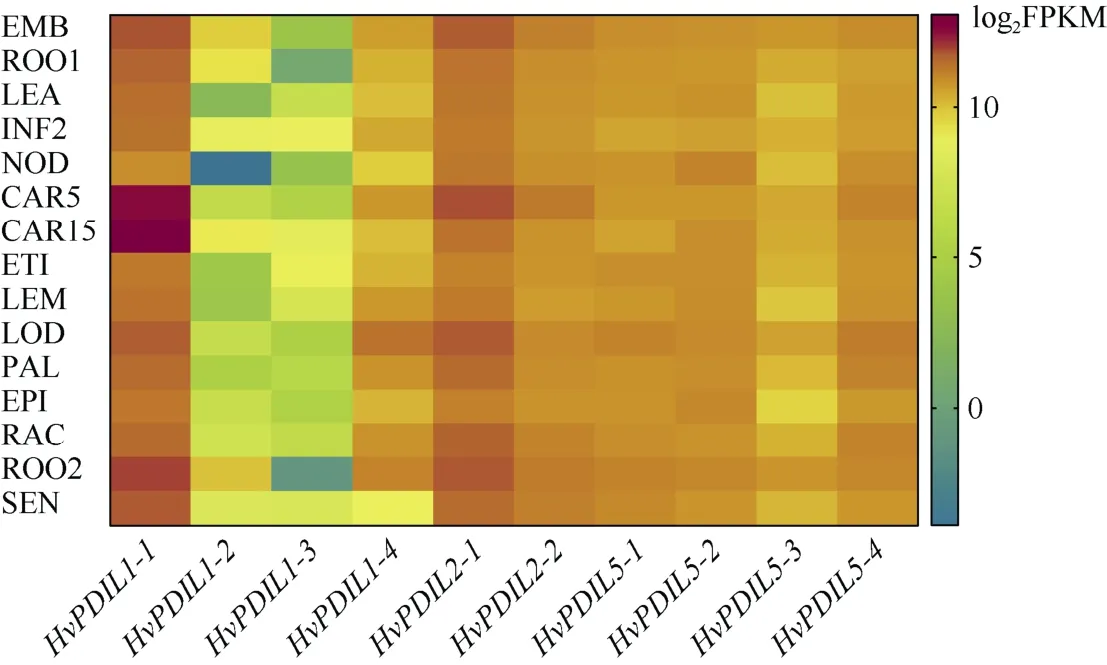
图4 HvPDILs 基因的组织表达情况 Fig.4 Transcriptional abundance of HvPDILs in different tissues
2.4 BaMMV 接种后HvPDILs 基因的表达分析
我们先前的研究结果证实,HvPDIL5-1作为感病因子参与BaYMV/BaMMV 病毒感染过程,该基因功能丢失可导致对大麦黄花叶病的广谱抗病性[30]。为了探究这些HvPDILs在大麦黄花叶病感染过程中的作用,我们分析了BaMMV 接种后HvPDILs基因表达水平的变化。首先,以HvUBIQUITIN为内参基因[30],采用BaMMV 的特异性引物进行扩增(表3),qPCR 证实接种后的叶片中含有BaMMV。随后,采用本研究设计的10 对HvPDILs基因特异性引物(表3),分析在感病叶片和对照叶片中10 个HvPDILs基因的相对表达水平。如图5所示,对照叶片中HvPDIL1-1、HvPDIL1-3和HvPDIL1-4这3 个基因的表达水平较高,但是病毒感染后这些基因表达水平显著降低。HvPDIL5-1的表达水平很低,病毒接种后其表达水平也显著降低。HvPDIL5-4在感病叶片中的表达水平显著高于对照,说明病毒感染会诱导该基因表达。这些在病毒接种后出现显著表达差异的HvPDILs基因,很可能与BaMMV 感染过程相关。而HvPDIL1-2、HvPDIL2-1、HvPDIL2-2、HvPDIL5-2及HvPDIL5-3这5 个基因的表达水平没有发生显著性变化。
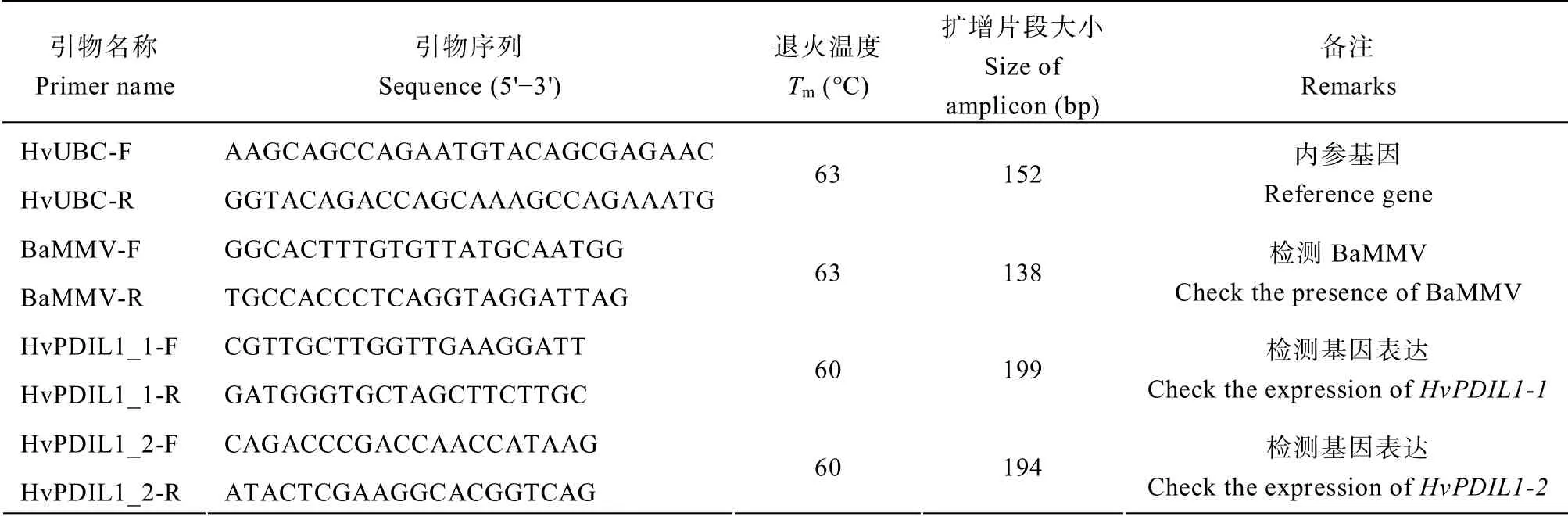
表3 qPCR 引物及扩增片段 Table3 Primers used for qPCR and length of amplified fragments
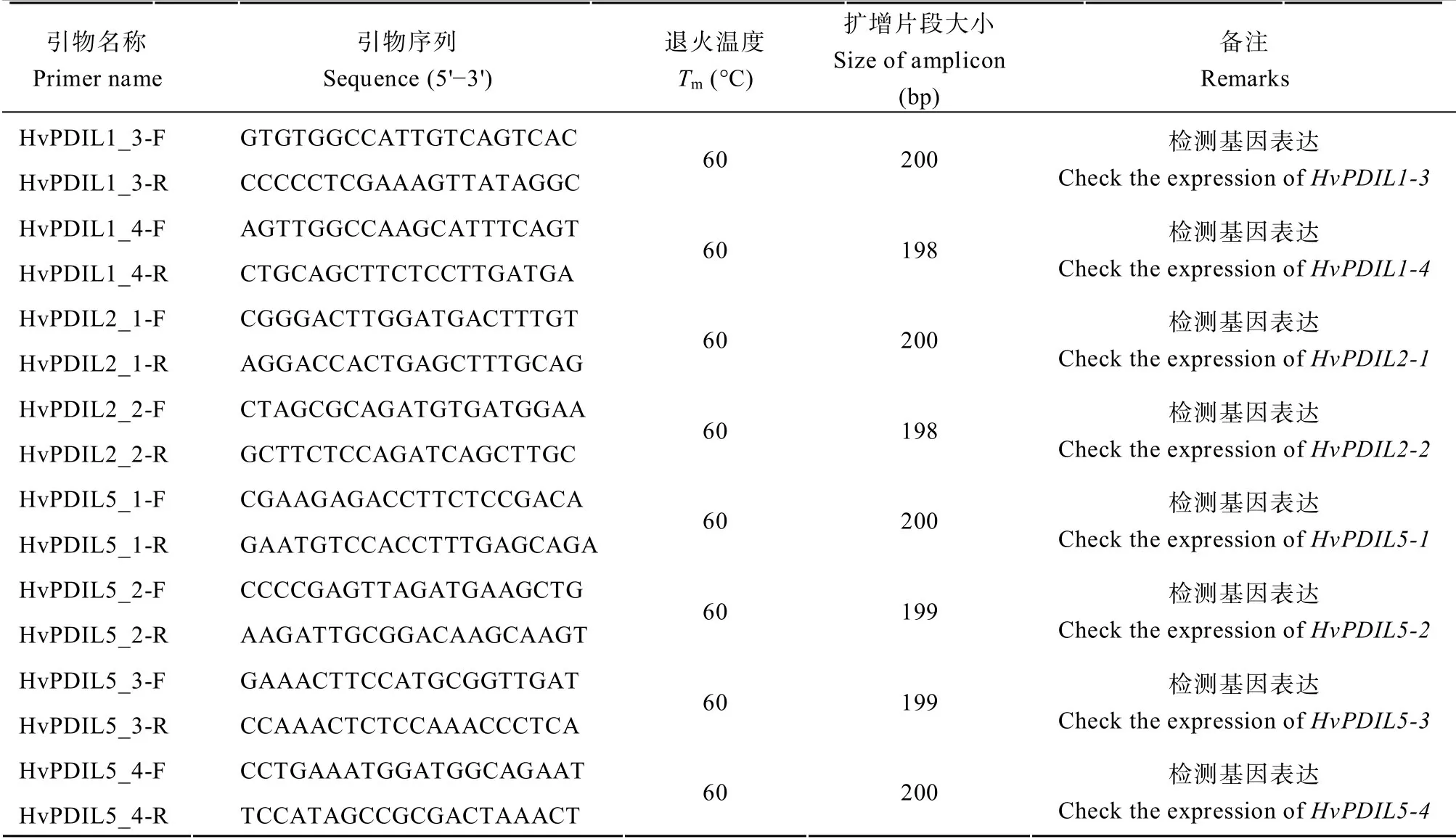
(续表3)
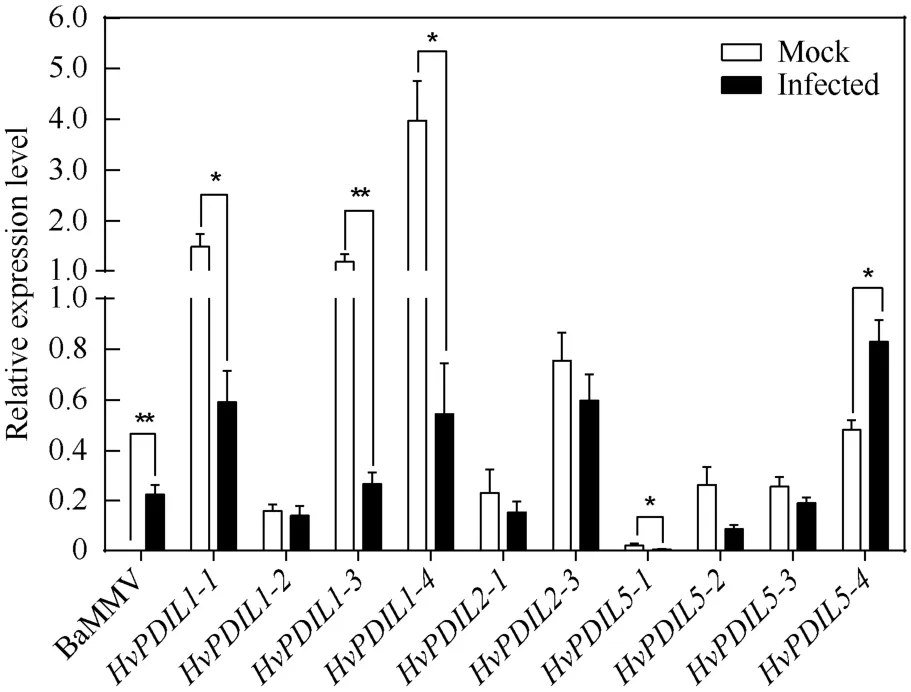
图5 病毒接种后叶片中HvPDILs 基因的相对表达分析 Fig.5 Relative expression level of HvPDILs in leaves of virus-infected plants
3 讨论
蛋白质二硫键异构酶在真核生物中行使着重要功能,其生化功能包括催化二硫键的形成与断裂,辅助蛋白质正确折叠;其生物学功能包括参与生长发育、生物或非生物胁迫应答等。本研究从大麦中鉴定出10 个HvPDILs基因,生物信息学分析显示其具有该蛋白家族成员典型的序列结构和亚细胞定位信号,分属于PDIL1、PDIL2 和PDIL5 三个亚家族,其中PDIL1 亚家族成员同时具有氧化还原催化活性位点(a 或a')和底物结合位点(b 或b'),而PDIL5 亚家族成员不具有底物结合位点。由此推测,PDIL5 亚家族中的成员在行使催化功能时,需要与其他因子作用形成功能复合体,才能锚定底物。近年有研究者发现,来源于簇毛麦的一个PDI-V基因在感染小麦白粉病菌后出现显著的差异表达,其编码蛋白可以与E3 泛素连接酶CMPG1 互作,从而参与小麦白粉病的抗病反应[27]。
本研究发现HvPDIL1-1在各组织中的表达水平很高,尤其是在籽粒发育时期,与之前报道的HvPDIL1-1在籽粒发育后期的胚乳中表达最为丰富一致,由此推测HvPDIL1-1在淀粉颗粒和贮藏蛋白的形成过程中发挥重要作用[34]。PDIL1-1 作为PDILs最典型的家族成员,其直系同源蛋白具有较高的氧化还原活性[35]。在水稻中OsPDIL1-1基因被证实参与种子醇溶蛋白和谷蛋白的组装和配送以及淀粉状胚乳的发育[17-21]。而本研究发现,BaMMV 接种后叶片中HvPDIL1-1基因的表达相较于对照显著降低,由此我们猜测该基因在不同组织中发挥着不同功能,在籽粒中调控胚乳的发育,而在叶片中则响应病毒侵染、参与抗病或感病过程。大麦黄花叶病是由双链病毒感染的土传病害,该病毒颗粒只编码10 个成熟蛋白,因而其生命周期的完成需要借助寄主感病因子参与。前期我们已经证实,HvPDIL5-1作为病毒必须的感病因子,参与了病毒的感染过程[30]。本研究发现,BaMMV 病毒感染后多个HvPDILs基因的表达水平显著上调或下调,说明这些HvPDILs参与抗或感大麦黄花叶病的过程。值得注意的是,对比本研究与前人的研究结果发现[12,31-32],植物PDILs 家族基因的编码序列通常位于1000 bp 到2000 bp 之间,而PDIL5-1基因编码序列通常小于500 bp,显示其是一个非常特殊的家族成员。相对该基因家族的其他成员,PDIL5-1基因发生了较大的结构分化,推测该基因可能源自于物种进化早期其他家族基因的部分复制。大麦HvPDIL5-1在各个组织、发育时期中整体表达水平较低(图4),病毒侵染后该基因进一步下调表达(图5)。尽管植物中PDIL5-1基因在系统进化中是高度保守的,HvPDIL5-1基因功能缺失的突变体具有对大麦温性花叶病毒的抗性,但是在植株生长发育等其他方面没有异常[30]。因此,推测该基因与其他家族成员存在功能冗余,为其选择性丢失从而导致病毒抗性提供了可能。
4 结论
在大麦中共鉴定出10 个HvPDILs基因,分别定位在大麦的6 条染色体上,根据功能结构域的组成形式可分为PDIL1、PDIL2、PDIL5 三个亚家族;其中5 个HvPDILs基因在大麦接种BaMMV 后出现显著的表达上调或下调,说明这些基因可能参与大麦黄花叶病感染过程,但是各个HvPDILs基因或独立作用或结合互相拮抗/协同作用都有待后续继续研究。

