水稻OsUBA基因的表达及其在促进种子萌发和开花中的功能
张双双 王立伟 姚 楠 郭光艳 夏玉凤 秘彩莉
河北师范大学生命科学学院,河北石家庄 050024
在真核生物中,自噬是在液泡(植物和酵母)或溶酶体(动物)中将胞内组分降解的细胞学过程。参与自噬途径的基因称为自噬相关基因(aut ophagy- associated g enes,ATG)[1]。在营养缺乏时,生物通过非选择性自噬途径将胞内组分(包括蛋白质和细胞器)大规模降解,以实现营养物质的回收和再利用[2]。此外,通过自噬途径还可以将受损的细胞器和有毒的大分子选择性地清除,即选择性自噬。选择性自噬由自噬受体介导,自噬受体不仅能识别自噬底物,还能与自噬体的标记蛋白 ATG8(在哺乳动物中也称LC3,microtubule-associated protein 1 l ight chain 3)相互作用,从而将自噬底物运送至自噬体进行降解[3]。
p62(也称Sequestosome-1,SQSTM1)和NBR1(Next toBRCA1 gene1,NBR1)是哺乳动物中最主要的选择性自噬受体[4-5],两者的结构域组成和排列顺序相似——N端的PB1(Phox andBem1p,PB1)结构域,中间的锌指结构域ZZ,C端的UBA(Ubiquitin associated,UBA)结构域。UBA结构域介导了p62和NBR1与单泛素和/或多聚泛素链间的结合,PB1结构域则介导其自身的多聚化及与其他有PB1结构域的蛋白间的相互作用[5-7]。
虽然p62在人类中的研究已经非常广泛而深入,但其在植物中同源蛋白的研究却屈指可数,迄今只在拟南芥、烟草和马铃薯中有过相关报道。与p62相比,拟南芥中的NBR1无论在结构域组成还是氨基酸序列上都与哺乳动物中的NBR1 更相似。AtNBR1有2个UBA 结构域,但只有C末端的UBA结构域能够与泛素结合[8]。AtNBR1在热、氧化、盐和干旱等非生物胁迫反应中发挥着重要作用,而且这些生物学功能依赖于NBR1与ATG8的相互作用[9]。Ntjoka2是烟草中的NBR1蛋白。Ntjoka2能够与ATG8f 结合;过量表达Ntjoka2的烟草植株对营养缺乏的反应减弱[10]。Ntjoka2可以以单体或寡聚体的形式存在;Ntjoka2通过PB1-PB1间的相互作用参与自噬体的形成[11]。此外,Joka2类蛋白(即NBR1蛋白)也参与植物的防御反应。PexRD54是来源于爱尔兰马铃薯致病疫霉的效应蛋白,PexRD54 与寄主ATG8CL间的结合刺激了自噬体的形成。PexRD54可以将Joka2从ATG8CL复合体中解离出来从而干扰Joka2在植物病原防御反应中的积极作用[12]。综上所述,已报道的植物中的NBR1类蛋白参与了生物/非生物胁迫反应以及对营养缺乏的响应,但尚未有此类蛋白参与植物发育过程的相关报道。
本实验室前期从小麦中克隆了一个含有UBA结构域的基因,将其命名为TaUBA。分析表明,TaUBA的结构域组成和排列方式与人类的p62及NBR1类蛋白非常相似。研究表明,过量表达TaUBA的拟南芥株系耐盐性下降;去掉UBA结构域或ZZ结构域的点突变可解除TaUBA对盐胁迫反应的抑制效应[13]。由于小麦的转化效率较低,在小麦中研究基因的功能比较困难。为了深入研究NBR1类蛋白在植物中的功能,本实验室通过Blast找到了TaUBA在水稻中的同源蛋白并将其命名为OsUBA(XP_015625351)。结构域分析表明,OsUBA与TaUBA、AtNBR1以及Ntjoka2的结构域组成一致,是水稻中的NBR1类蛋白,即水稻中的自噬受体。
本研究拟对水稻中的NBR1类蛋白OsUBA进行生物信息学分析,通过对OsUBA p:Gus水稻株系的Gus染色研究OsUBA的表达特性,通过在水稻中过量表达OsUBA研究OsUBA的功能。
1 材料与方法
1.1 试验材料
1.1.1 植物材料及处理 水稻(Oryza sativaL.)日本晴种子由本院朱正歌教授惠赠。水稻日本晴和各转基因水稻株系均种植于河北师范大学(河北省石家庄市)院内的水稻池中。用于开花期统计的OsUBA过表达水稻株系及野生型分别于2017年6月3日种植、11月10日收获;2018年5月17日种植、11月8日收获。在种子萌发率统计试验中用到的水稻材料种植于2017年5月18日、收获于11月10日。
1.1.2 主要试剂和菌株 RNA 提取试剂RNAiso Plus、cDNA 第1 链合成试剂盒Reverse Transcriptase M-MLV(RNase H-)、限制性核酸内切酶和T4 DNA连接酶均购自Takara(大连)公司;pGEM-T 载体购自Promega 生物技术有限公司,TransTaq HiFi DNA Polymerase 购自北京全式金生物技术有限公司;大肠杆菌感受态细胞 DH5α感和农杆菌感受态细胞EHA105 为实验室自行制备,SanPrep 柱式DNA 胶回收试剂盒、普通Taq酶及其他生化试剂购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 水稻OsUBA基因的克隆与序列分析 基于OsUBA的mRNA 序列(XM_015769865),应用Primer 5 设计引物OsUBA-F1(5′-ATGTCCGGCCGG AGCTCG-3′)和OsUBA-R1(5′-TCACTGGTCTTTCT TCTCCCT-3′)用于OsUBA的扩增。提取正常培养5 d的水稻日本晴根的总 RNA,然后将其反转录为cDNA 第1 链作为模板扩增OsUBA的开放阅读框ORF。PCR 扩增程序为94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,30 个循环;72℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测及胶回收纯化后,与pGEM-T 载体16℃连接过夜(约10 h),转化大肠杆菌DH5α杆感受态细胞,将PCR 鉴定呈阳性的克隆送生工生物工程(上海)股份有限公司测序,测序正确的阳性克隆命名为T-OsUBA。
利用在线分析软件 SignalP 4.1 Server(http:// www.cbs.dtu.dk/services/SignalP/)、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)分别分析OsUBA基因编码蛋白的信号肽序列、跨膜结构域以及磷酸化位点数目;利用Psort(http://www.psort.org/)软件预测OsUBA 蛋白的亚细胞定位情况。
1.2.2 水稻OsUBA基因启动子区域的克隆与序列分析 根据水稻参考基因组(Oryza sativa japonicaGroup cultivar Nipponbare chromosome 2,IRGSP- 1.0)Os02g0593700 上游的基因组序列信息(22,981,857~22,989,595)设计引物OsUBAp-F1(5'-AAGCTTCACAAAGTACAATGGGAACAAA-3',Hind III)和OsUBAp-R1(5'-GTCGACCGCGGGGGTGCGG GC-3',SalI),以正常培养2 周的日本晴幼苗叶片的 DNA 为模板进行PCR 扩增,PCR 程序为:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸4 min,35 个循环;72℃再延伸10 min。PCR 产物经电泳、胶回收、连接pGEM-T 载体和转化大肠杆菌DH5α 后测序验证,将验证正确的克隆命名为T-OsUBAp1,并利用PlantCARE[14]在线分析软件分析OsUBA启动子的序列特征。
1.2.3OsUBA p:Gus 载体和OsUBA基因过量表达载体的构建 以含T-OsUBAp1的菌液为模板,以OsUBAp-F2(5'-AAGCTTCACAAAGTACAATGGGA ACAAA-3',HindIII)和OsUBAp-R2(5'-GTCGAC CG CGGGGGTGCGGGC-3',SalI)扩增带有HindIII/SalI酶切位点的OsUBA启动子片段,将PCR 产物胶回收后连接pGEM-T 载体,转化E.coliDH5α 感受态细胞,挑取阳性克隆测序验证,验证正确的克隆命名为T-OsUBAp2。提取pCAMBIA1391Z 和T-OsUBAp2的质粒,分别用HindIII/SalI进行双酶切,电泳回收目的条带,连接、转化大肠杆菌DH5α,阳性克隆经菌液PCR 和HindIII/SalI 双酶切进行鉴定,鉴定正确的克隆即为构建成功的OsUBA p:Gus载体。
以含 T-OsUBA的菌液为模板,以OsUBA-F2(5'-TCTAGAATGTCCGGCCGGAGCT-3',XbaI)和OsUBA-R2(5'-GGTACCTCACTGGTCTTTCTTCTC- 3',KpnI)扩增带有XbaI 和KpnI 酶切位点的OsUBA基因的 CDS 片段,将 PCR 产物胶回收后连接pGEM-T 载体,转化E.coliDH5α,阳性克隆经测序验证后命名为T-OsUBA-OX。提取pCAMBIA1300 和T-OsUBA-OX 的质粒,XbaI/KpnI 双酶切(37 ,3℃ h)后电泳并回收目的条带,16℃连接过夜(约10 h),将连接产物转化大肠杆菌DH5α,阳性克隆经菌液PCR 和XbaI/KpnI 双酶切鉴定,鉴定正确的克隆命名为35S:OsUBA,即构建成功的OsUBA过表达载体。
1.2.4OsUBA p:Gus和35S:OsUBA表达载体转化水稻 提取OsUBA p:Gus和35S:OsUBA的质粒,分别转化根癌农杆菌菌株EHA105 感受态细胞,然后将转化产物涂布于含有卡那霉素(50 μg mL-1)和利福平(50 μg mL-1)的YEP 固体培养基上,经28℃培养72 h,挑取单克隆分别进行PCR 检测及质粒回转大肠杆菌后的双酶切鉴定。鉴定正确的农杆菌克隆可用于转化水稻。
利用农杆菌介导法[15]将含有OsUBA p:Gus和35S:OsUBA质粒的EHA105 重组菌株分别转化水稻日本晴,转化得到T0代转基因水稻株系。将收获的T0转基因水稻种子经过连续2 代潮霉素(50 μg mL-1)筛选直至获得T2代转基因水稻纯合株系。
1.2.5OsUBA p:Gus和35S:OsUBA水稻株系RNA水平的鉴定 对按上述方法筛选到的T2代转基因水稻纯合株系进行RNA 水平检测。
采用 TRIzol 法提取正常培养10 d 的T2代OsUBA p:Gus水稻株系根的总 RNA 并反转录成cDNA,利用RT-PCR 检测Gus(所用引物为GusF:5'-GGGCAGGCCAGCGTATCG-3'和GusR:5'-CGGC GAAATTCCATACCTG-3')基因的表达水平,以水稻Actin基因(GenBank 登录号为AK100267.1)为内对照(引物序列为ActinF:5'-CTTCAACACCCCTGCT ATG-3'和ActinR:5'-TCCATCAGGAAGCTCGTAG-3')。
采用 TRIzol 法提取正常培养10 d 的T2代35S:OsUBA水稻株系叶片的总 RNA,按 照PrimeScript RT reagent Kit with gDNA Eraser(Takara,中国大连)说明书合成cDNA 第1 链,稀释10 倍后作为qRT-PCR 的模板。在 Primer Premier 5.0 软件中设计检测OsUBA基因的qRT-PCR 引物(引物序列为OsUBAqF:5'-CGTCGTCCTCAAGGTGAAGTA-3'和OsUBAqR:5'-CATCCAGCATGACAATATCCC-3'),以水稻Actin基因(GenBank 登录号为AK100267.1)为内参(引物序列为:Actin-qF:5'-CGGGAAATTGT GAGGGACAT-3'和Actin-qR:5'-AGGAAGGCTGGA AGAGGACC-3')。采用 ABI 7300 Real-time PCR System(美国)进行qRT-PCR 检测,并按照TB Green Premix ExTaq(Tli RNaseH Plus)(Takara,中国大连)说明书配置反应体系。qRT-PCR 扩增程序为95 ℃30 s;95 ℃ 5 s,60 ℃ 34 s,45个循环。每个样品设3 个技术重复。利用2-ΔΔCt[16]计算OsUBA基因的相对表达量,利用Graphpad Prism7 软件绘制柱状图。
1.2.6 利用OsUBA p:Gus转基因水稻株系研究OsUBA的表达特性 将OsUBA p:Gus水稻植株的花、开花期主茎的茎节和第2 节间的切片、萌发1 d及3 d 的种子、生长7 d 的幼苗分别移入加有1 mL Gus 染液(Gus 染色液配方:100 mmol L-1磷酸缓冲液pH 7.0,0.5% Triton X-100,20%甲醇和0.5 mg mL-1X-Gluc)的离心管中,37℃染色,待染出理想效果后,吸去反应液,用无水乙醇脱色1~6 h,吸去乙醇,体式显微镜下拍照记录。
用200 μmol L-1ABA 和100 μmol L-1GA分别处理萌发2 d 的种子根24 h,然后Gus 染色25 min,通过对比Gus 染色情况研究ABA 和GA 处理对OsUBA表达的影响。
1.2.7OsUBA过表达水稻株系开花时间和种子萌发率的统计 本实验室于2017年和2018年连续2个年度分别对野生型水稻日本晴及 3 个过表达OsUBA水稻株系(L10、L14 和L15)的开花时间进行了田间调查。每个植株的第1 个穗子开花即记录为开花植株;以所有株系中最早开花的植株出现的那一天定为第1 天,以后每天统计一次各株系中开花的株数,直至所有植株开花结束为止。2 个年度统计的各水稻株系及野生型均为30 株。
为了研究ABA 及GA 处理对OsUBA过表达水稻 株系(L10、L14 和L15)及野生型种子萌发的影响,将水稻日本晴及3 个OsUBA过表达水稻株系的种子(各100粒)经消毒后分别点播于1/2 MS 培养基、含3 μmol L-1ABA 或100 μmol L-1GA 的1/2 MS 培养基上,在光照培养箱(28 ,16 h℃ 光照/8 h 黑暗)中萌发,每12 h统计一次萌发情况,直至所有种子萌发为止。绘制各株系的种子萌发曲线图,独立实验重复3 次。
2 结果与分析
2.1 OsUBA 基因的克隆与序列分析
水稻OsUBA基因的CDS 全长为2538 bp,编码845 个氨基酸残基(图1)。其编码蛋白质的相对分子质量为93.754 kD,理论等电点为5.31,其中脯氨酸和亮氨酸含量最高,分别为10.18%和8.64%;此外,有 107 个带负电荷的氨基酸残基(Asp 和Glu)和79 个带正电荷的氨基酸残基(Arg 和Lys),总体带负电荷,属亲水蛋白。生物信息学分析表明,OsUBA 没有信号肽序列及跨膜结构,预测有3 个磷酸化位点(丝氨酸、酪氨酸、苏氨酸各一个)。亚细胞定位预测显示,OsUBA 蛋白位于细胞核中的概率最大,为64.3%。
在NCBI 网站进行的保守结构域预测显示,该蛋白具有多个介导蛋白相互作用的结构域:位于氨基端的PB1 结构域(21~107 aa)、中间的ZZ 型锌指结构域(430~461 aa)和NBR1 结构域(500~613 aa)以及羧基端的2 个UBA 结构域(769~796 aa 和800~838 aa)(图2),预示其可与多种蛋白质相互作用,生物学功能复杂。

图1 水稻OsUBA 基因的PCR 扩增 Fig.1 PCR amplification of OsUBA gene in rice

图2 水稻OsUBA 蛋白的保守结构域预测 Fig.2 Conserved domain prediction of OsUBA protein
将OsUBA 的氨基酸序列提交至NCBI 数据库,利用 Blast 搜索其在水稻(Oryza sativaL.)、小麦(Triticum aestivumL.)、玉米(Zea maysL.)、谷子(Setaria italicaL.)、短柄草(Brachypodium distachyonL.)、高粱(Sorghum bicolorL.)、拟南芥(Arabidopsis thalianaL.)及烟草(Nicotiana tabacumL.)等植物中的同源蛋白,并利用MEGA6.0软件构建系统进化树(图3)。系统分析表明,所有蛋白聚为两个大的分支,其中,玉米、高粱、谷子、水稻、小麦、短柄草等单子叶植物的NBR1 类蛋白聚为一个分支;拟南芥和烟草等双子叶植物的NBR1 蛋白聚成另一分支。OsUBA 即为水稻中的NBR1 X1 亚型,与水稻中的NBR1 X2 亚型相似性最高,氨基酸水平的一致性高达96.37%。上述结果说明,OsUBA 编码水稻中的NBR1 类蛋白。
2.2 OsUBA 基因启动子区域的克隆与分析
以水稻日本晴基因组DNA 为模板扩增OsUBA启动子区域,扩增片段长1810 bp(图4),将该PCR产物克隆、测序,并与数据库中的序列比对,确认该序列为OsUBA的启动子序列。
在PlantCARE 网站的分析显示,在该启动子区域除含有启动子基本元件TATA-box 和CAAT-box 外,还有光响应元件G-box 和Sp1,与激素相关的顺式作用元件有ABRE、CGTCA-motif、TATC-box、P- box、GARE-motif 和TCA-element,与逆境响应相关的GC-motif 和LTR,及其他组织特异性启动子元件等(表1)。

图3 OsUBA 蛋白及其他植物中的同源蛋白的系统进化分析 Fig.3 Phylogenetic tree of OsUBA and its homologues in plants

图4 OsUBA 基因启动子的PCR 扩增 Fig.4 PCR amplification of OsUBA promoter

表1 OsUBA 基因启动子调控元件预测 Table1 Prediction of cis-elements of OsUBA promoter by PlantCARE software
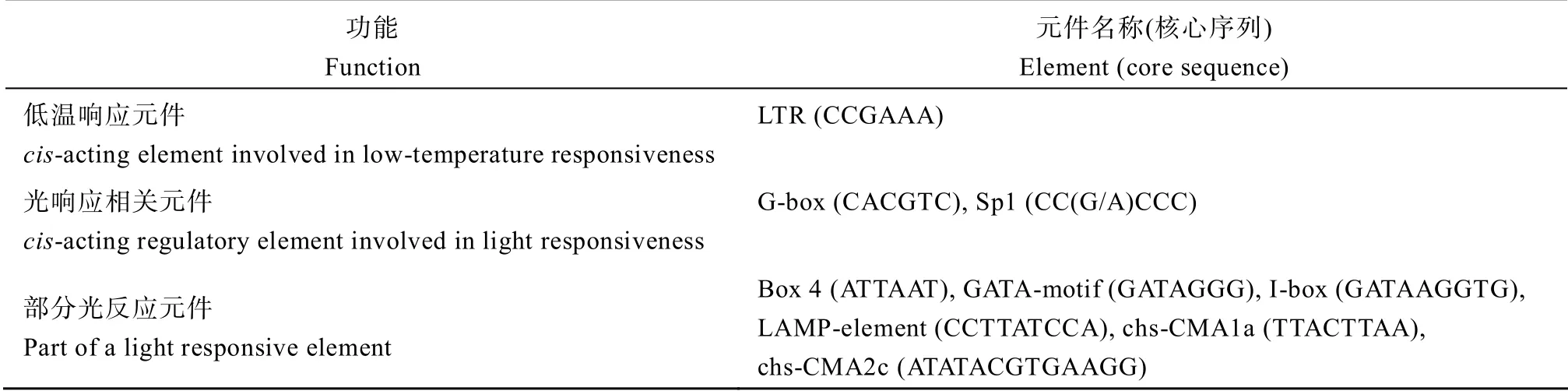
(续表1)
2.3 OsUBA p:Gus 载体的构建及转基因水稻的鉴定
为了系统研究OsUBA基因的表达特性,构建了OsUBA p:Gus载体。按前述方法将OsUBA启动子连接至pCAMBIA1391 载体的HindIII 和SalI 酶切位点之间,阳性克隆经HindIII/SalI 酶切电泳后出现一条1810 bp 的条带(图5),说明OsUBA p:Gus载体构建成功。
将OsUBA p:Gus载体转化水稻日本晴,通过连续的潮霉素筛选获得2 个转基因纯合株系L6 和L12。提取正常培养10 d 的OsUBA p:Gus水稻株系的根的总RNA,检测转基因株系中Gus 的表达。检测表明这2 个株系中Gus均能正常表达(图6),可用于后期对OsUBA表达的分析。
2.4 OsUBA 基因的表达特性分析

图5 OsUBA p:Gus 载体的酶切鉴定 Fig.5 Identification of OsUBA p:Gus vector by double digestion
按前述方法对OsUBA p:Gus水稻株系L6 的各器官及正在萌发的种子进行Gus 染色表明,OsUBA在水稻的根(包括种子根、冠根和侧根)和幼叶(图7-A)、茎(包括茎节和茎的节间,图7-B,C)、花(主要是花药,图7-D)中的表达均较强;在萌发1 d 种子的胚(图7-E)以及萌发3 d 种子的胚芽鞘和胚根中的表达量也很高,暗示其是一个遍在表达的基因,有可能参与植物生长发育的多个生物学过程。

图6 OsUBA p:Gus 水稻株系中Gus 的表达分析 Fig.6 Analysis of Gus expression in OsUBA p:Gus transgenic rice plants

图7 OsUBA 在不同器官和组织中的表达特性 Fig.7 Expression of OsUBA in different organs and tissues
利用200 μmol L-1ABA 和100 μmol L-1GA 分别处理萌发2 d 的OsUBA p:Gus水稻株系24 h,利用Gus 染色研究了ABA 和GA 对OsUBA表达的影响。与处理前相比(图8-A),ABA 处理显著抑制了OsUBA的表达(图8-B);GA 处理后,OsUBA的表达略有升高,但不显著(图8-C)。
2.5 OsUBA 基因过量表达载体的构建及转基因水稻表达水平鉴定
按前述方法将OsUBA基因的 CDS 连接至pCAMBIA1300 载体,所得阳性克隆经菌液 PCR(图9-A)和XbaI/KpnI 双酶切(图9-B)鉴定,电泳检测结果均显示存在一条约2500 bp 的目的基因条带,表明35S:OsUBA载体构建成功。

图8 ABA 和GA 处理对OsUBA 表达的影响 Fig.8 Expression of OsUBA under ABA and GA treatments

图9 35S:OsUBA 载体的PCR 及双酶切鉴定 Fig.9 Identification of 35S:OsUBA vector by PCR and double digestion
将35S:OsUBA载体转化水稻日本晴,通过连续2 代的潮霉素筛选,获得3 个带潮霉素抗性的T2代纯合水稻株系(L10、L14 和L15)。提取这3 个株系和日本晴水稻正常生长10 d 的叶片的总RNA 并反转录为 cDNA,利用qRT-PCR 分析OsUBA在各株系中的表达水平。结果表明,OsUBA在3 个过量表达OsUBA的水稻株系中表达量都很高,分别是野生型的31.4(L10)、32.4(L14)和38.4(L15)倍(图10),这些株系可用于后续对OsUBA 功能的研究。
2.6 过量表达OsUBA 水稻株系的开花时间统计
在2016年,本实验室发现OsUBA过表达株系L15 的开花时间明显早于野生型,同时,另2 个株系L10 和L14 的开花时间虽晚于L15,但仍比野生型早。当时发现这个现象时L15 株系大部分已经开花,因此未能在2016年完整记录这些过表达株系的开花时间的数据。本研究在随后的2017 和2018 连续2年继续观察、统计OsUBA过表达株系及野生型的开花时间,获得了完整的统计数据。整体来看,各株系在这2 个年度的开花时间数据比较一致:OsUBA过表达株系中,L15 开花最早,其次是L10,然后是L14;2 个年度的统计结果均表明这3 个OsUBA过表达水稻株系的开花时间均明显早于野生型对照(图11)。
2.7 ABA 和GA 处理对过量表达OsUBA 水稻株系种子萌发过程的影响

图10 过量表达OsUBA 的水稻株系中OsUBA 的表达水平分析 Fig.10 Relative expression analysis of OsUBA in OsUBA- overexpressing rice plants

图11 OsUBA 过表达水稻株系和野生型的开花时间比较 Fig.11 Comparison of flowering time between OsUBA-overexpressing rice plants and the wild type control

图12 ABA 和GA 处理对OsUBA 过表达水稻株系和野生型种子萌发的影响 Fig.12 ABA and GA treatment affects seed germination of OsUBA-overexpressing rice plants and the wild type control
按前述方法研究了在正常生长条件下以及ABA(3 μmol L-1)和GA(100 μmol L-1)处理对OsUBA过表达水稻株系及野生型萌发的影响。结果表明,OsUBA过表达水稻株系的种子比野生型萌发更快,这种差异在萌发的第1.5 天、2.0 天和2.5 天均非常显著,此后差距逐渐缩小。3 个OsUBA过表达株系中,L10萌发最快,L15 次之,L14 最慢,但3 个过表达株系的萌发始终比野生型快,到7.5 d 时所有种子全部萌发(图12-A);ABA 处理均抑制了OsUBA过表达水稻株 系及野生型种子的萌发,但对OsUBA过表达水稻株系的影响更大。在萌发的第1.5 天影响最显著,此时,野生型的萌发率与对照基本相同,但3 个OsUBA过表达株系仅有对照条件下的 51.4%(L10)、74.9%(L14)和53.5%(L15),可以看出,ABA 对L10 种子萌发的抑制效应最显著,对L14 的影响最小(图12-C);GA 处理均促进了OsUBA过表达水稻株系及野生型种子的萌发。在萌发的1.5 d,GA 对野生型的促进效应比L10 和L15 稍大一些,但对L14 的促进效应稍高于野生型,但差异都微乎其微(图12-B)。以上结果说明,过表达OsUBA促进了种子的萌发,OsUBA过表达株系对ABA 处理更敏感,GA 处理对OsUBA过表达株系种子的萌发稍有促进,但与野生型相比差异不大。3 个OsUBA过表达株系中,L14 的表型最弱。
3 讨论
NBR1 类自噬受体通过与ATG8 蛋白间的相互作用参与自噬体膜的形成和延伸[5,7],在自噬过程中扮演重要角色。迄今为止,植物中有关NBR1 类自 噬受体的研究相对较少。已有研究表明,拟南芥、烟草等植物中的NBR1 蛋白参与了植物的非生物胁迫反应以及对营养缺乏的响应[9-10]。本实验室前期有关小麦中NBR1 蛋白TaUBA 的研究表明,TaUBA 在植物的盐和干旱胁迫反应中起负调控作用[13]。但水稻中此类蛋白的研究还未见报道。
本研究表明,OsUBA基因在水稻花药中的表达较高(图7),过量表达OsUBA的水稻株系开花时间明显提前(图11)。这些结果说明,OsUBA 可能参与对水稻开花时间的调控。开花是植物由营养生长转向生殖生长的重要转折点。在许多植物物种中,开花时间受到光(光周期)和温度的精确调控[17-19]。在OsUBA基因启动子区发现的G-box 和Sp1 元件是常见的光反应元件[20];此外,该启动子区还有多个部分光反应元件,如Box 4、GATA-motif、I-box、LAMP- element、chs-CMA1a、chs-CMA2c 等,这些元件常见于光调控基因的启动子区,对光调控下基因的转录至关重要[21],推测光照影响OsUBA的表达,进而影响转基因水稻的开花时间。此外,有研究表明,自噬途径对花药发育中的代谢调控和营养供应非常重要。在拟南芥花粉萌发过程中,自噬相关基因ATG6是必需的[22];在水稻自噬突变体Osatg7-1中,花药发育受损[23];OsATG7在花药中表达较高;OsATG7 介导的自噬依赖的脂质代谢在花药发育中是必需的[24]。本研究中的OsUBA基因编码选择性自噬受体,推测OsUBA 也可能通过自噬途径介导的能量代谢影响开花时间。
种子萌发是一个复杂的细胞学过程,脂质、碳水化合物和蛋白质等的代谢为种子萌发过程提供能量[25-26];此外,各类激素在种子萌发中也发挥重要作用[27-28],其中,ABA 是种子萌发的负调节剂[29-30],GA 能促进种子萌发和拮抗ABA 的抑制作用[31]。本研究发现,OsUBA在萌发种子的胚中表达量很高(图7);在OsUBA基因启动子区发现了ABA 反应元件ABRE 以及 GA 反应元件 TATC-box、P-box 和GARE-motif 等;进一步的实验也表明,ABA 处理显著抑制OsUBA的表达,GA 处理后OsUBA的表达略有升高(图8);在正常条件下,3 个过表达OsUBA水稻株系种子萌发明显比野生型快(图12-A),ABA 处理显著抑制OsUBA过表达水稻株系的萌发(图12-C),GA 处理对OsUBA过表达水稻株系的萌发稍有促进(图12-B),这些结果与ABA 和GA 对OsUBA表达的影响是一致的,即过量表达OsUBA促进种子的萌发;ABA 处理抑制OsUBA的表达,进而使OsUBA过表达水稻株系的种子萌发速率也显著下降;GA 处理对OsUBA的表达略有增强,相应地,GA 处理后OsUBA过表达水稻株系的种子萌发略快,但与野生型间的差异不显著。此外,也有研究表明自噬途径参与了种子的萌发过程。AT1 和AT2 是拟南芥中两个与ATG8f 相互作用的蛋白,AT1和AT2在种子发育的晚期表达升高;过表达AT1促进了拟南芥种子的萌发;而抑制AT1的表达会延迟种子萌发过程[32];在小麦种子萌发过程中,胚和胚乳中代谢产物的变化差异巨大,在胚乳中,贮藏淀粉及小蛋白类代谢物呈现上升的趋势;而在胚中,蛋白质和脂质代谢产物较多,推测胚中的能量代谢对种子的萌发更重要[33]。据文献报道,Ntjoka2 的作者曾拿到拟南芥AtNBR1突变体的种子,但他们无法获得nbr1的纯合株系,推测AtNBR1的突变影响了种子发育[10];但令人不解的是,在有关AtNBR1的研究中,作者得到了nbr1突变体[9]。综上所述,过量表达OsUBA促进种子萌发,这种影响可能是OsUBA 通过对ABA 和GA 的合成/反应实现的;本研究中的OsUBA编码自噬受体,因此,也有可能是OsUBA 通过自噬介导的能量代谢影响了种子的萌发,抑或是两者兼而有之。
本研究在OsUBA基因的启动子区发现了许多与逆境胁迫有关的元件,如与缺氧有关的 GC- motif、与低温胁迫有关的LTR 元件以及与ABA 反应相关的ABRE 元件;此外,OsUBA基因的启动子区还有与MeJA 和SA 有关的反应元件。MeJA 广泛参与了各种植物逆境胁迫反应及与其他激素的相互作用[34];SA 在植物的抗病反应中发挥重要作用[35],ABA 与植物非生物胁迫的关系密切[36],推测OsUBA 可能也参与植物生物/非生物胁迫反应。此前文献中已有此类蛋白参与植物逆境胁迫反应的相关报道,如拟南芥中AtNBR1的表达受热胁迫诱导,nbr1对热胁迫的敏感性增强,盐和干旱胁迫抗性降低[9];小麦中的NBR1 类蛋白TaUBA 也参与了盐和干旱胁迫反应[13]。
在对OsUBA 及其同源蛋白进行进化分析时,发现在水稻中除了OsUBA 外还有与之同源的蛋白(图3)。我们在前期研究中曾根据OsUBA的不同区域设计/构建了3 个RNAi 载体,并分别得到了3 个载体的纯合株系,但遗憾的是各株系的表型与野生型相比差异均不显著(未发表数据),估计是因为有同源蛋白的存在,推测文中提及的水稻中的3 个NBR1蛋白可能功能冗余;因OsUBA 与OsNBR1 X2 序列相似性更高,两者的功能可能也更相似。综上所述,本文中的OsUBA 除了参与对花期和种子萌发的调控外还可能参与植物的非生物/生物胁迫反应,具有广泛的生物学功能,这需要后期进一步的功能验证。
4 结论
本研究克隆了水稻NBR1 类自噬受体蛋白基因OsUBA,该基因的启动子区含有与各种激素和光反应等有关的顺式作用元件。OsUBA基因在各器官中均有表达,但在花药、根以及萌发中的种子中表达量较高,ABA 抑制OsUBA的表达;OsUBA基因在水稻中的过量表达使种子萌发加快、开花时间提前,ABA 处理显著抑制了过表达OsUBA水稻株系种子的萌发,推测OsUBA基因的表达和功能可能与花的发育、种子萌发以及生物/非生物胁迫反应有关。

