菜籽蛋白水解物的分离纯化及抗肿瘤活性研究
姚轶俊 袁 强 鞠兴荣 王立峰
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心1,南京 210023)(江南大学食品学院2,无锡 214122)
近20年来,随着经济的快速增长和工业化的发展,老龄化,空气污染,和生活方式的改变已经使中国疾病谱发生了改变。癌症是全世界人类死亡和疾病的主要原因。大多数癌症的痊愈率低,治疗费用高,因此癌症给病人带来了巨大的经济负担,并对他们的生活造成了负面影响[1]。癌症是由于环境因素的累积或基因遗传,促使正常细胞不断生长分裂导致无限增殖,最终发展成为肿瘤;肿瘤细胞会逐渐扩散到周围组织,如果不及时治疗,最终会通过淋巴系统和血液扩散到人体各个器官和组织[2]。癌细胞和正常细胞之间的主要区别是,前者失去所谓的自毁信号,生长和增殖无限而且杂乱无章[3]。所以加快对抗肿瘤机制研究,找到抑制肿瘤细胞无限增殖的手段,从而为临床医学中抗肿瘤药物的研发提供理论依据显得尤为重要[4]。目前的癌症治疗方案中,以肽作为药物引起了人们的广泛关注。多肽拥有一定的关键优势来替代化疗分子,例如对于大多数小分子药物,多肽有很好的亲和力,目标特异性强,毒性低[5]。动植物作为潜在抗癌药来源已经被广泛的研究,可以通过降解或加工形成更小分子质量、具有天然稳态机制的蛋白肽[6-7]。王竹君等[8]通过双酶水解螺旋藻蛋白,经超滤,凝胶色谱分离得到D1组分,通过分析该组分的氨基酸序列为 AGGASLLLLR,对HepG-2有显著的抑制作用。Siri等[9]发现重组rtEa4肽通过基质胶膜抑制人乳腺癌细胞(MDA-MB-231)的生长,并且呈现出剂量依赖性,细胞内的uPA,tPA,PAL1等基因的表达受到了显著性的抑制。伍强等人以红毛藻为原料提取R-藻红蛋白,并通过胃蛋白酶和胰蛋白酶水解R-藻红蛋白,分离纯化出活性肽ALLAGDPSVLEDR,研究发现对癌细胞(HepG2、SMMC 7721、Caco-2)增殖具有抑制作用[10]。
菜籽蛋白水解物具有较高的生物活性,具有调节生理功能的作用,如降血压,抗氧化,增强免疫调节,降胆固醇及抑制肿瘤活性[11-13],有着很好的发掘潜力和广阔的应用市场。因此,本实验通过超滤,葡聚糖凝胶柱和半制备液相对菜籽蛋白水解物进行分离纯化,并采用MTT法对各级组分进行分析测定,研究了各组分对结肠癌细胞Caco-2、肝癌细胞HepG2、乳腺癌细胞MBA-MD-231的生长抑制作用,并通过分析各组分对癌细胞抑制率影响的差异性确定了抗肿瘤的主要组分,为后续进一步研究菜籽抗肿瘤分子机制提供参考。
1 材料与方法
1.1 材料与试剂
宁杂19号油菜籽;Sephadex G-15凝胶填料;碱性蛋白酶、风味蛋白酶、青链霉素混合液、胰蛋白酶-EDTA消化液(0.25%);乙腈、三氟乙酸Merck公司;噻唑蓝( MTT)、二甲基亚砜( DMSO);人体肝癌细胞株HepG2、结肠癌细胞株Caco-2、乳腺癌细胞株MBA-MD-231;DMEM培养基、胎牛血清(FBS)。
1.2 仪器与设备
E-812索氏抽提装置;QL-861漩涡振荡器;SpectraMax M2e多功能酶标仪;HERACELL150i-CO2培养箱;25 cm2密封盖培养瓶;SX-500快速自动高压灭菌锅;ALpHA2-4冷冻干燥机;THZ-D台式恒温振荡器;膜分离装置;HD-3紫外检测仪;HL-2恒流泵;XWT-S小型台式记录仪;BSZ-100自动收集器;PHS-3C雷磁pH计;RE52CS旋转蒸发仪;HH-6恒温水浴锅;XD30A倒置式生物显微镜;HERACELL 150i-CO2培养箱。
1.3 方法
1.3.1 菜籽蛋白的制备
将油菜籽脱壳,用索氏抽提脱油,置于通风橱晾干,然后粉碎过筛。将制得的菜籽粉按1/20的质量比充分溶解于去离子水中,然后调节溶液的pH至11.0,在室温下匀速搅拌1 h,然后低速离心(5 000 g,30 min),收集上清液并调节pH为4.5,静置1h后弃掉上清液,用无水乙醇洗涤沉淀2~3次,冷冻干燥即得到菜籽蛋白。
1.3.2 菜籽蛋白水解物的制备
取12.5 g菜籽蛋白,用去离子水溶解后配成质量浓度为50 mg/mL的溶液,将溶液pH调至9.0,并加入6 000 U/g的碱性蛋白酶,于55 ℃水浴中酶解3 h后加入4 000 U/g的风味蛋白酶继续于55 ℃水浴中酶解2 h。水浴过程中用1 mol/L的NaOH保持pH值恒定,反应结束后煮沸15 min灭酶,冷却后调节pH至7,于50 ℃水浴中酶解2 h,水浴过程中用1 mol/L的HCl保持pH值恒定,反应结束后煮沸15 min灭酶,冷却后离心(10 000 g,30 min,4 ℃),收集上清液,过0.45 μm微滤膜后冷冻干燥得到菜籽蛋白水解物(RPHs)。
1.3.3 菜籽蛋白水解物的超滤膜分离
将菜籽蛋白水解物(RPHs)溶于去离子水中,配成质量浓度为1 mg/mL的溶液,通过截留分子质量为1 ku的超滤膜,超滤过程控制压力在0.10~0.5 MPa之间,分别收集0~3 ku分子质量段的菜籽肽液,然后经真空浓缩、冷冻干燥,称量所得该分子质量段冻干粉的质量。
1.3.4 葡聚糖凝胶柱Sephadex G-15分离纯化
在室温下,将葡聚糖凝胶粉末在去离子水中浸泡至少24 h,并用玻璃棒不断搅拌以保证凝胶溶胀,直至凝胶充分溶胀,凝胶体积不再变化;根据填料柱的要求,将溶胀的凝胶同时放入柱中,应注意保持柱子湿润,避免装柱中出现气泡或出现分层;上样前使用至少3-5个柱体积的去离子水平衡凝胶柱,直到记录仪的基线稳定。
上样过程参考了张晶等葡聚糖凝胶G-15柱分离纯化的方法[14]。取8g经超滤膜分离的菜籽蛋白肽组分(配成质量浓度为1 mg/mL),并过0.22 μm的滤膜;样品溶液分多次上样洗脱,每次上样约5 mL,洗脱液采用去离子水,恒流泵的流速设置为18 mL/h,紫外吸收波长设置为280 nm,用自动收集器每10 min收集一管馏分,合并具有相同最大吸收峰的馏分,将所得馏分进行旋转蒸发、冷冻干燥,从而得到葡聚糖凝胶色谱柱分离纯化的组分。为了保证分离组分的一致性,凝胶柱在使用10次后作一次清洗,除去凝胶柱中残留的沉淀和一些顽固的蛋白质;方法是用浓度为1 mol/L氢氧化钠,流速为40 mL/h,反向洗脱凝胶柱3~4个柱体积,再用去离子水正向冲凝胶柱3~4个柱体积再生。
1.3.5 半制备型RP-HPLC分离纯化
参照文献[15],并做一定修改。采用半制备型RP-HPLC对经2.2.3分离得到的功能活性最高的组分进一步分离纯化。将样品配制成0.1 mg/mL溶液后采用0.22 μm一次性过滤器过滤。色谱柱采用XBridgeTM C18 (10 mm×150 mm, 5 μm),进样体积为100 μL,液相洗脱条件如表1,其中流动相A:100%超纯水(含0.1 %三氟乙酸),流动相B:100%乙腈(含0.1 %三氟乙酸),柱温箱温度30 ℃,洗脱流速2.46 mL/min,检测波长215 nm,收集主要洗脱峰,真空浓缩并冷冻干燥后检测各组分的功能活性。色谱图采用系统自带的Empower 2(Water,USA)积分软件处理。

表1 半制备液相RP-HPLC洗脱条件
1.3.6 细胞培养
人体肝癌细胞HepG2、人体结肠癌细胞Caco-2和人体乳腺癌细胞MBA-MD-231,用含有 10%胎牛血清 (FBS),0.1% 双抗的DMEM培养基培养,细胞培养瓶置于37 ℃,5% CO2的细胞培养箱中,隔天换液,使用显微镜观察细胞在培养瓶底部的生长情况,待细胞在瓶底长满后,加入1.5 mL 0.25%的胰酶,放置在培养箱中消化3 min,待细胞脱落后,用移液枪将细胞悬浮液转移到离心管中离心3 min(1 000 r/min,4 ℃),然后吸取1 mL培养液加入到离心管中缓慢吹打20次左右,使细胞密度均匀,按照1∶2或1∶3进行传代。
1.3.7 抗肿瘤活性分析
收集对数生长期的HepG2细胞、Caco-2细胞及MBA-MD-231细胞,通过细胞计数板计数,用DMEM完全培养液调节细胞密度至1×105个/mL,将细胞悬浮液接种于96孔培养板中,每孔加入100 μL细胞悬浮液,同时设置空白组(只加入100 μL不含细胞的培养液,不加细胞和样品);将96孔板置于37 ℃、5%CO2条件下的培养箱中培养24 h,24 h后吸弃培养液,并向每孔中加入100 μL用DMEM稀释的不同质量浓度(50,100,200,300,400,500,1 000 μg/mL)的待测样品,每个浓度均设6个重复,对照组加入等体积的DMEM培养液;将培养板置于37 ℃、5%CO2的培养箱中,继续孵育24 h,24 h后在各孔中加入5 mg/mL的MTT 20 μL,在37 ℃培养箱中继续培养4 h,吸弃孔内培养上清液,每孔加入150 μL DMSO,37 ℃下于恒温振荡器上振荡30 min,待结晶全部溶解后,置于570 nm下测定OD值。细胞存活率和细胞抑制率参照张子栋等[16]的方法分别按式(1)、式(2)计算:

(1)
细胞抑制率=
(2)
1.3.8 数据统计分析
所有实验重复测定3次,结果表示为平均值±标准差(SD)。所有的图形用Graphpad prism 6作图。
2 结果与分析
2.1 菜籽蛋白水解物的超滤分析
2.1.1 超滤膜分离组分得率
由表2可知,通过超滤分离技术将菜籽蛋白水解物分离得到了分子质量小于1 ku的组分,该组分(RPHs)占菜籽蛋白水解物的比例为51.8%,这表明大部分的菜籽蛋白被碱性蛋白酶和风味蛋白酶水解成低分子质量的可回收的菜籽多肽。同时,分子质量<3 ku的菜籽多肽约占总水解物的71.58%,此结果与Girgih等[17]的研究相似,他们发现亚麻籽肽经超滤膜分离后,其中小于3 ku的组分得率是其他各组分得率的3 倍。

表2 RPHs超滤膜分离组分得率
2.1.2 超滤膜分离组分的抗肿瘤活性分析
菜籽蛋白水解物经超滤膜分离后,选取三种肿瘤细胞(人体肝癌细胞株HepG2、结肠癌细胞株Caco-2、乳腺癌细胞株MBA-MD-231)对其进行体外抗增殖活性分析,实验结果如图1所示,在质量浓度为50~1 000 μg/mL的剂量范围内,RPHs对HepG2细胞、MBA-MD-231细胞及Caco-2细胞均有一定的抑制作用,且抑制效果与样品浓度之间呈现出一定的剂量关系。其中,1 000 μg/mL样品作HepG2细胞24 h,抑制率达到(30.66±3.53)%,高于MBA-MD-231细胞(21.34±2.67)%及Caco-2细胞(15.03±1.78)%,研究表明HepG2细胞对RPHs的作用最敏感,所以在接下来的试验中选取HepG2细胞来分析菜籽蛋白水解物的抗肿瘤活性。

a

b
图1 不同浓度的RPHs对3种肿瘤细胞活力和抑制率的影响
2.2 菜籽蛋白水解物的凝胶色谱分析
2.2.1 Sephadex G-15凝胶色谱分离
经过超滤膜分离的组分RPHs进一步通过葡聚糖凝胶色谱柱(Sephadex G-15)进行洗脱分离,得到了2个洗脱峰,以洗脱时间为X轴,以紫外检测的 OD值为Y轴作图,结果如图2所示;收集这2个主要的峰,并分别命名为RPHs-F1和RPHs-F2。根据葡聚糖凝胶柱分离的工作原理可知,RPHs-F2的分子质量小于RPHs-F1。收集各组分的洗脱液,旋转蒸发,冷冻干燥,储存于-20 ℃下待用。

图2 Sephadex G-15分离纯化RPHs的柱层析图
2.2.2 凝胶色谱分离组分的抗肿瘤活性分析
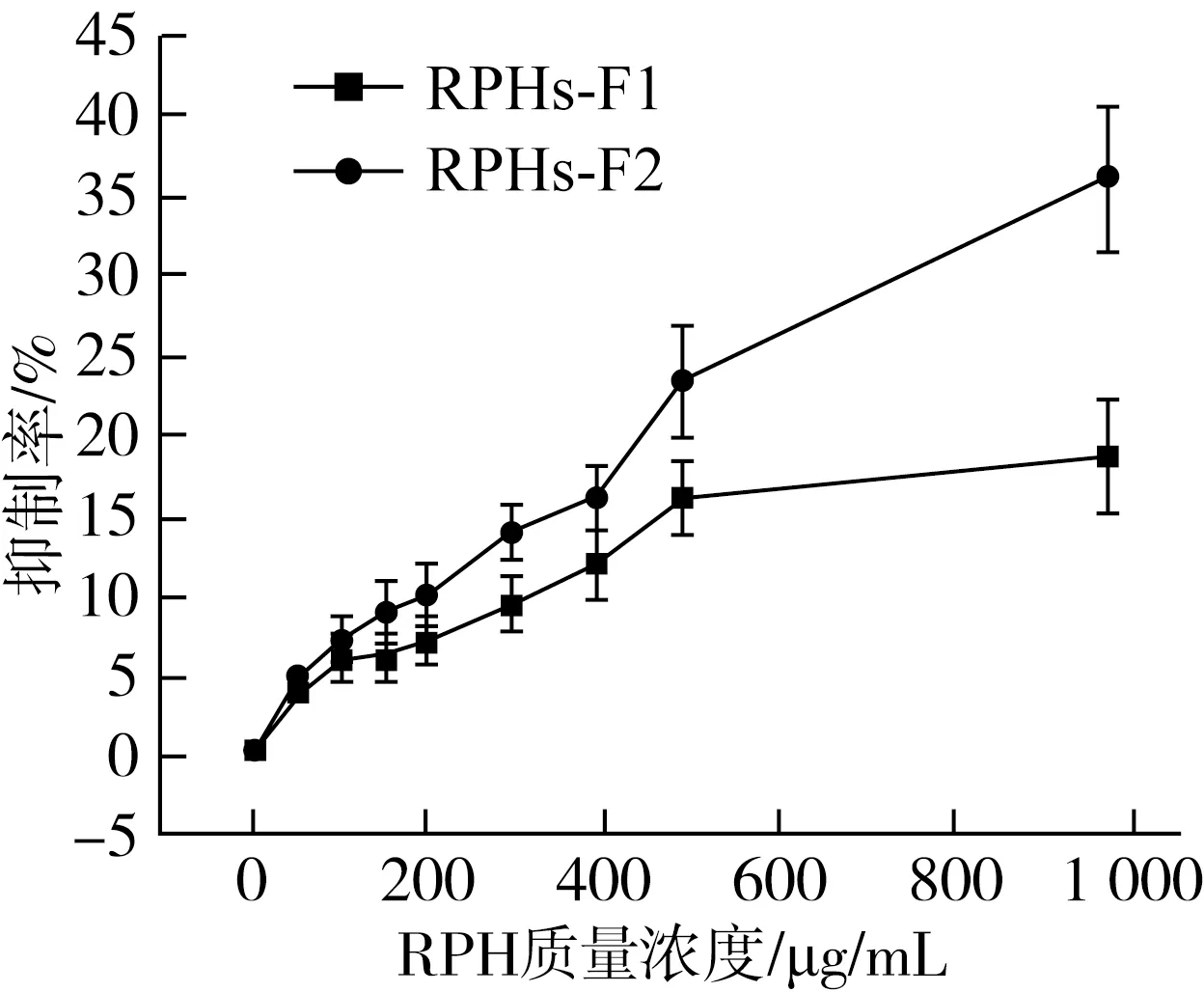
以HepG2细胞为研究对象,采用MTT比色法对葡聚糖凝胶色谱柱分离所得的组分进行体外抗增殖活性的分析。由图3可知,两种组分RPHs-F1、RPHs-F2不同浓度给药处理HepG2细胞24 h,在质量浓度为1 000 μg/mL时,抑制率分别为(18.34±2.44)%,(35.58±2.90)%,说明组分RPHs-F2的抗肿瘤活性优于组分RPHs-F1,并且与分离前组分(抑制率30.66%)相比,抗肿瘤活性有了一定程度的提升;因此,经葡聚糖凝胶色谱柱纯化的RPHs(MW<1 ku)具有更高的抗肿瘤活性。

a
b
图3 不同浓度的凝胶色谱分离组分对HepG2细胞活力和抑制率的影响
2.3 菜籽蛋白水解物的半制备型RP-HPLC分析
2.3.1 半制备型RP-HPLC分离纯化
利用半制备液相RP-HPLC对经超滤膜分离及葡聚糖凝胶柱Sephadex G-15柱层析获得的具有较高活性的功能菜籽肽组分(RPHs-F2)进行进一步的分离纯化,如图4所示,得到4个主要组分,按照出峰顺序依次命名为RPHs-F2-1、RPHs-F2-2、RPHs-F2-3及RPHs-F2-4,以HepG2细胞为模型分别测定了这4个组分的体外抗增殖活性。
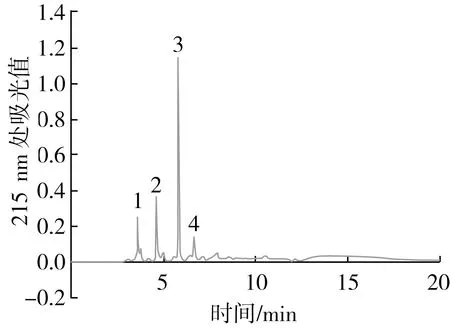
图4 半制备RP-HPLC分离纯化RPHs-F2 的液相色谱图
2.3.2 半制备RP-HPLC分离组分的抗肿瘤活性分析
半制备RP-HPLC能根据多肽分子质量大小、结构等分理处单一组分的肽,对低分子质量肽具有较高的分辨率及纯化度,是目前分离、纯化多肽的主要方法之一。分子质量较低的RPHs-F2经半制备液相分离后得到4种组分,分别对4种进行体外抗增殖活性分析,结果如图5所示,组分RPHs-F2-4对HepG2细胞的体外增殖几乎没有抑制作用(在质量浓度为1 000 μg/mL时,对HepG2细胞的抑制率为11.53%);其余3个组分的抑制作用则相对明显,且与作用浓度之间呈现出一定的剂量依赖性;在各组分样品质量浓度为1 000 μg/mL时,组分RPHs-F2-1,RPHs-F2-2,RPHs-F2-3对HepG2细胞体外增殖的抑制率分别为(28.58±2.93)%,(21.23±4.07)%,(51.53±5.59)%;结果表明,菜籽肽组分RPHs-F2-3显示出更强的抗肿瘤活性。通过与相关文献中菜籽蛋白水解物各组分的抗炎活性对比,发现菜籽蛋白组分的抗肿瘤活性与菜籽抗炎肽的呈现出一定的相关性,来路皓等[18]通过合成γ-炔酸酯类化合物,并检测此种化合物的抗炎和抗肿瘤活性,发现其是一种双重抑制剂,表现出抗炎和抗肿瘤的双重活性;刘仁杰等[19-21]利用缩合和环化手段合成异长叶烷基喹唑啉类衍生物3a~3f,通过MTT法对合成所得化合物进行了人体肝癌细胞抗肿瘤活性
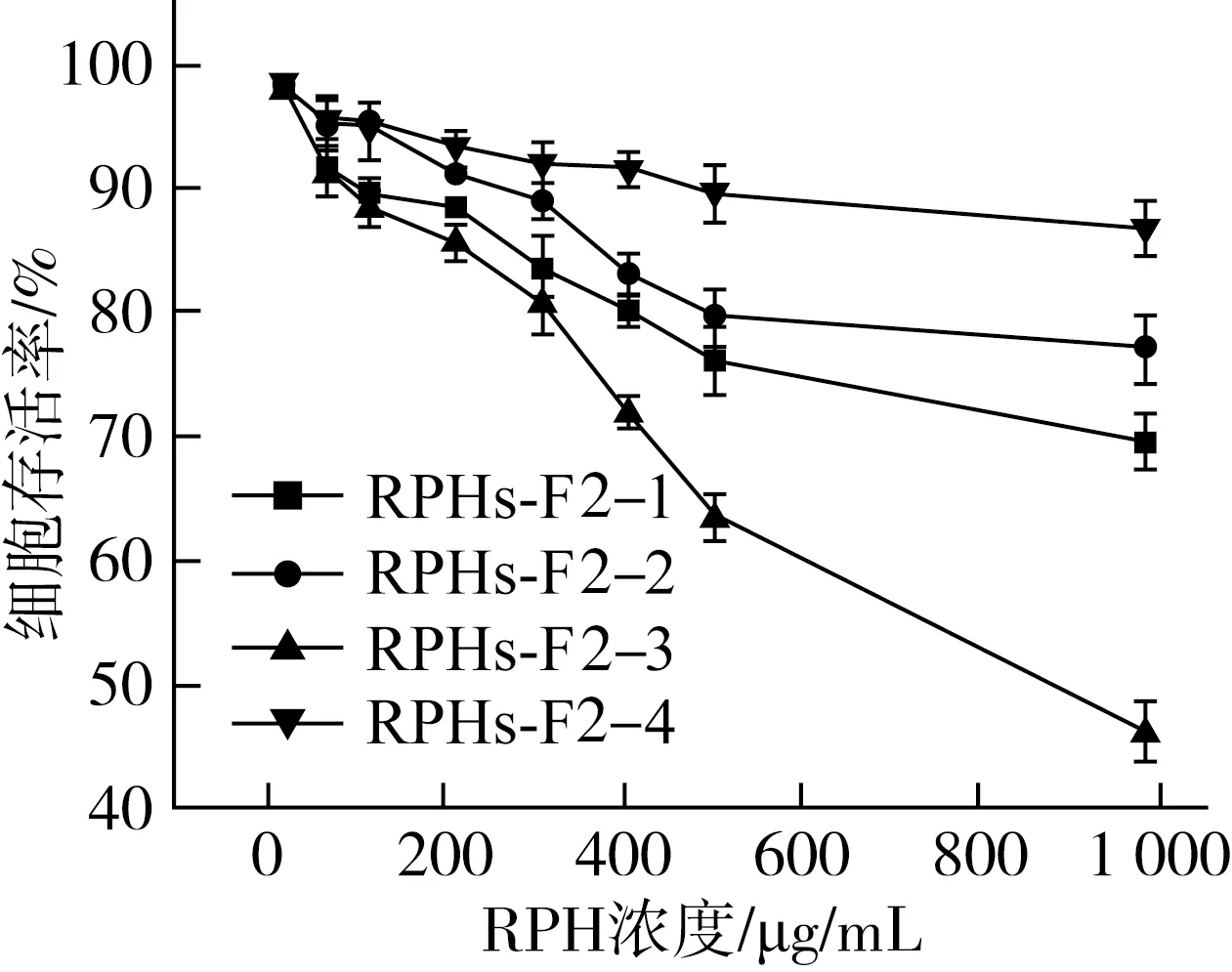

图5 不同浓度的半制备液相分离组分对HepG2细胞活力和抑制率的影响
测定,以及人脐静脉内皮细胞抗炎活性测定,研究发现化合物3f既有较强抗肿瘤的活性也有一定的抗炎活性,因此可以预测抑制炎症发生信号通路和与抑制肿瘤发生发展的信号通路可能有相同的关键因子。其中抗肿瘤活性的具体抑制机制,需要后续进一步通过实验研究分析。
3 结论
本实验将脱壳、脱油后的菜籽饼粕通过碱提酸沉的方法制备得到菜籽蛋白,进一步通过分步酶解(碱性蛋白酶-风味蛋白酶)制备菜籽蛋白水解物;在经过超滤、葡聚糖凝胶柱(Sephadex G-15)以及半制备液相RP-HPLC等一系列分离纯化手段,采用MTT比色法分析RPHs(MW<1 ku)对人体HepG2肝癌细胞、乳腺癌细胞MBA-MD-231及人体结肠癌细胞Caco-2的体外抗增殖活性,筛选出敏感细胞株;进一步测定各组分对敏感细胞株HepG2细胞的体外增殖抑制作用。
实验结果发现,在质量浓度为50~1 000 μg/mL的剂量范围内,RPHs对HepG2细胞、MBA-MD-231细胞及Caco-2细胞均有一定的抑制作用,且抑制效果与样品浓度之间呈现出一定的剂量关系。对同一种细胞而言,样品浓度越高,抑制效果越显著;其中,HepG2细胞对RPHs的作用最为敏感;所以在接下来的试验中选取HepG2细胞来分析菜籽蛋白水解物的抗肿瘤活性。对葡聚糖凝胶色谱柱分离所得的组分进行体外抗增殖活性的分析,两种组分RPHs-F1、RPHs-F2在质量质量浓度为1 000 μg/mL时,对HepG2细胞抑制率分别为(35.58±2.90)%,(18.34±2.44)%,说明组分RPHs-F2的抗肿瘤活性优于组分RPHs-F1,并且与分离前组分(抑制率30.66%)相比,抗肿瘤活性有一定的增强。组分RPHs-F2-4对HepG2细胞的体外增殖几乎没有抑制作用;其余3个组分的抑制作用则相对明显,且与作用浓度之间呈现一定剂量依赖性;在样品质量质量浓度为1 000 μg/mL时,组分RPHs-F2-3对HepG2细胞体外增殖的抑制率最高,为(51.53±5.59)%,所以菜籽肽组分RPHs-F2-3具有更强的抗肿瘤活性。

